椎间盘退变IL-1β激活NF-κB信号通路增强ADAMTS-4的表达△
李 瑶,孙中仪,戴 健,蒋海涛,张 铖,唐晓明*
(1南京医科大学,江苏南京 211100;2.南京江北医院骨科,江苏南京 211500;3.南京医科大学附属淮安第一医院骨科,江苏淮安 223300)
慢性下腰痛是全球最常见的疾病之一,其主要原因是椎间盘退变(intervertebral disc degenera⁃tion,IDD)。IDD的主要特征是细胞外基质(extra⁃cellular matrix,ECM)的丢失,包括II型胶原蛋白(type II collagen,Col II)和聚集蛋白聚糖(aggrecan,Agg)。文献报道,在退变的椎间盘组织中血小板反应蛋白解整合素金属肽酶4(a disintegrin and metal⁃loproteinase with thrombospondin motifs 4,ADAMTS-4)的表达升高,其具有降解聚集蛋白聚糖的能力。在髓核(nucleus pulposus,NP)细胞中,白介素-1β (interleukin-1β,IL-1β) 能明显增加 AD⁃AMTS-4基因表达,同时在退变的椎间盘组织中核因子活化B细胞κ轻链增强子(nuclear factor kap⁃pa-light-chain-enhancer of activated B cells,NF-κB)信号通路活性增加,尤其是其代表性的p65蛋白表达增高。但目前,尚未有文献详细阐明IL-1β如何控制ADAMTS-4表达的细胞机制,以及在ECM降解中的作用。本次研究以人髓核细胞为基础,系统地探讨IL-1β通过NF-κB p65调控AD⁃AMTS-4的转录和表达,为椎间盘退变研究提供新的资料。
1 材料与方法
1.1 组织来源
组织来源为35例行椎间盘切除术患者的切除髓核。该研究得到南京医科大学附属淮安第一医院伦理委员会的批准。所有纳入研究的患者都签署知情同意书。本研究仅包括年龄18~45岁的患者。根据术前影像 Pfirrmann 分级[1],分为未退变 (Pfirrmann<III级)12例,退变(Pfirrmann≥III级)23例的髓核组织。
1.2 髓核细胞的分离和培养
将组织用磷酸盐缓冲液洗涤3次,在0.25%胰蛋白酶中消化20 min,然后在0.2%II型胶原酶、37°C温水摇床中放置约3 h。随后通过70 μm滤网过滤,获取的原代NP细胞接种在DMEM-F12培养基中。本研究采用第一代或第二代细胞。
1.3 不同剂量IL-1β对未退变髓核细胞活力影响
通过细胞计数试剂盒8测定法(cell counting kit-8,CCK-8)测定用于细胞培养实验的IL-1β的最佳浓度。未退变髓核细胞接种在96孔板中(5 000个细胞/孔)。将对5种不同浓度的IL-1β(0 ng/ml、5 ng/ml、10 ng/ml、20 ng/ml、50 ng/ml、100 ng/ml) 一起孵育,孵育48 h后,向其中各加入10 μl WST-8试剂,并将细胞在37°C下孵育2 h。使用Bio-Rad 680酶标仪在450 nm处测量孔的吸光度,计算存活细胞的百分比。
1.4 退变与未退变髓核组织中标志物测量
分别采用RT-PCR和Western blot法检测未退变与退变椎间盘组织获取的髓核组织中的Agg、P65、ADAMTS-4、Col II和 IL-1β水平。
1.5 退变髓核细胞处理
将退变髓核细胞血清饥饿处理以同步细胞周期,分为3组。空白对照组不施加任何处理;IL-1β组加入 10 ng/ml IL-1β 作用 24 h;IL-1β+BAY11-7082组,加入BAY11-7082(5.0 μmol/L)预处理1 h,然后用 IL-1β(10 ng/ml)和 BAY11-7082 处理 48 h[2]。
1.6 检测方法
1.6.1 RT-PCR检测
通过Trizol从NP细胞和NP组织中提取总RNA,然后进行cDNA反转录,根据SYBR Premix Ex Taq试剂盒,使用ABI 7500快速实时PCR系统,通过实时聚合酶链反应(real-time polymerase chain reaction,RT-PCR)分析mRNA,获得了循环阈值,使用2-ΔΔCt值将数据进行计算[3],重复测量3次。基于编码序列设计所有检测物的引物见表1。

表1 RT-PCR检测物的编码序列设计
1.6.2 Western blot检测目标蛋白
使用RIPA试剂盒提取总蛋白,提取蛋白过程中加入蛋白酶抑制剂,防止蛋白降解。并通过电泳、上膜、封闭后,将需要检测的指标进行一抗、二抗孵育,最后使用增强化学发光试剂进行免疫标记。
1.7 统计学方法
使用SPSS 17.0软件进行统计分析。计量数据以±s表示,资料呈正态分布时,组间比较采用独立样本t检验或单因素方差分析;资料呈非正态分布时,采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 IL-1β对未退变髓核细胞活力检测结果
IL-1β对未退变髓核细胞细胞活力影响的CCK-8检测结果见图1,随着IL-1β浓度的升高,髓核细胞的活性逐渐减低,不同剂量IL-1β下未退变髓核细胞活力的差异有统计学意义(P<0.001)。因此本次实验选取10 ng/ml安全剂量作为实验的干预浓度。
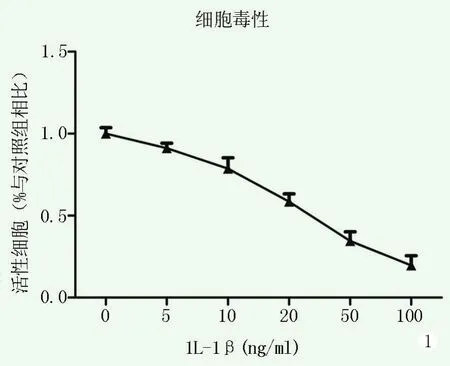
图1 不同浓度的IL-1β对髓核细胞活性影响,随着IL-1β浓度的升高,髓核细胞的活性逐渐减低
2.2 未退变与退变髓核细胞标志物检测结果
未退变与退变髓核组织相关物质mRNA表达的RT-PCR检测结果见表2。与未退变髓核细胞相比,退变髓核细胞的ADAMTS-4和IL-1β的mRNA表达显著升高(P<0.05),而Agg和Col II的mRNA表达显著降低(P<0.05)。
表2 未退变与退变髓核细胞相关物质mRNA表达的RTPCR 检测结果 (±s)

表2 未退变与退变髓核细胞相关物质mRNA表达的RTPCR 检测结果 (±s)
未退变与退变髓核细胞的相关物质蛋白表达的Western blot检测结果见图2。退变组NF-kB信号通路标志物p65的蛋白表达水平随着退变等级的升高,蛋白表达量0.86±0.02,显著高于未退变组的0.63±0.01,差异有统计学意义(P<0.001)。

图2 Western blot在未退变与退变髓核组织上p65目标基因的表达(G2为未退变组织,G3、G5为退变组织)
2.3 不同处理对未退变髓核细胞相关物质表达的影响
IL-1β(10 ng/ml)和 NF-kB信号通路特殊性抑制剂BAY11-7082(5.0 μmol/L)对未退变髓核细胞进行处理,RT-PCR检测结果见表3。与空白对照相比,IL-1β可显著增加未退变髓核细胞AD⁃AMTS-4的mRNA表达,而降低Agg和Col II mRAN的表达(P<0.05),而BAY11-7082可非常显著逆转IL-1β的作用,显著降低ADAMTS-4的mRNA表达,而增加Agg和Col II的mRNA表达(P<0.05)。
表3 不同处理对未退变髓核细胞相关物质mRNA表达的RT-PCR检测结果(±s)与比较
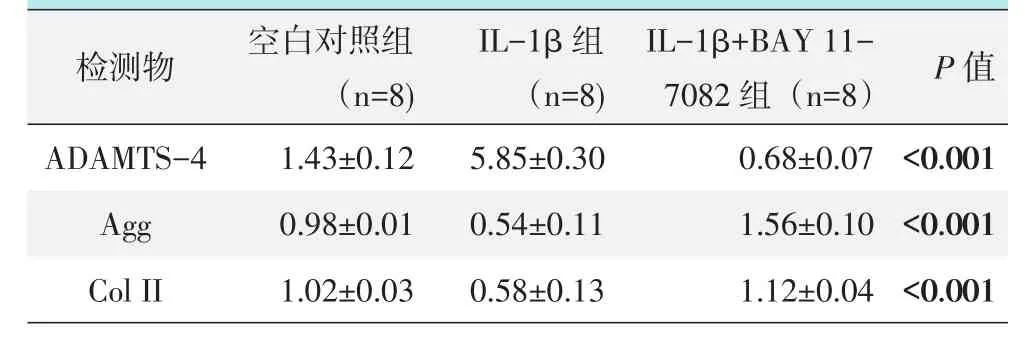
表3 不同处理对未退变髓核细胞相关物质mRNA表达的RT-PCR检测结果(±s)与比较
Western blot检测蛋白表达水平结果见表4及图3,与空白对照相比,IL-1β可显著增加未退变髓核细胞ADAMTS-4的蛋白表达,而降低Agg和Col II蛋白的表达(P<0.05),而BAY11-7082可非常显著逆转IL-1β的作用,显著降低ADAMTS-4的蛋白表达,而增加Agg和Col II蛋白的表达(P<0.05)。
表4 Western blot检测蛋白表达水平结果(±s)与比较

表4 Western blot检测蛋白表达水平结果(±s)与比较

图3 Western blot检测IL-1β和NF-kB信号通路特殊性抑制剂作用于髓核细胞时,ADAMTS-4、聚集蛋白聚糖和II型胶原蛋含量的变化
3 讨 论
IDD是一个全球性的健康问题,尽管IDD的确切病理生理机制尚不清楚,但已有文献研究表明正常椎间盘细胞外基质的合成和降解处于缓慢生理动态更新状态,即合成因子及降解因子相互平衡,一旦这种平衡状态被打破,椎间盘退变就会发生[4,5]。在降解细胞外基质的各种蛋白酶中,具有血小板反应蛋白基序的金属蛋白酶-4(ADAMTS-4)扮演重要的角色[6]。
本研究根据RT-PCR实验结果分析发现,在收集的未退变和退变的椎间盘组织中ADAMTS-4同时存在,然后比较ADAMTS-4基因的表达水平时,与未退变的椎间盘组织相比,退变的椎间盘样本中AD⁃AMTS-4的基因表达显著增加,二者差异有统计学意义。
国外研究表明ADAMTS-4涉及许多不同的生理功能,最主要的是参与聚集蛋白聚糖的代谢[7],其具体的调节机制不清楚。国内外研究表明软骨细胞和成纤维细胞中IL-1β能显著上调ADAMTS-4的表达[8,9]。在本研究中,使用IL-1β不同的浓度,来观察髓核细胞的活性,筛选出10 ng/ml作为实验的标准浓度。用IL-1β处理人NP细胞可明显诱导AD⁃AMTS-4表达。这些结果与以前的报道一致,即炎性因子诱导NP中ADAMTS-4 mRNA的表达[10-12]。虽然其机制尚不清楚,但有文献报道依赖TNF-α的ADAMTS-4在NP细胞中的表达可能受NF-κB信号通路的调控[13]。
NF-κB的激活能促进炎性因子和基质降解酶的表达的上调[14-16]。因此,本研究观察了人椎间盘组织中的NF-κB信号通路的活性,结果发现随着退变等级的升高,NF-κB信号通路的活性也随着升高,聚集蛋白聚糖和II型胶原蛋白显著降低。提示炎性因子IL-1β可能激活NF-κB信号通路的异常表达,进而参与IVD退变的过程。实际上,NF-κB的慢性活化与多种疾病有关,包括肌肉骨骼疾病,例如骨关节炎,骨质疏松症,类风湿性关节炎和肌营养不良症[17-20]。本研究蛋白检测结果表明,IL-1β促进NF-κB信号通路的异常活化,同时也发现ADAMTS-4的表达增加。为了进一步研究IL-1β处理髓核细胞后ADAMTS-4的表达是否由NF-κB信号通路进行调控,在IL-1β处理之前,将NF-κB信号通路的特异性抑制剂BAY11-7082添加到培养基中,前期实验结果证实BAY11-7082浓度为5.0 μM是安全实验剂量,BAY11-7082显著逆转IL-1β对NF-κ信号通路的激活以及ADAMTS-4表达的作用,从而导致人NP细胞中聚集蛋白聚糖和II型胶原蛋白含量的增加。上述实验结果初步表明,通过控制NF-κB-p65信号通路的活性,可以调节NP细胞中ADAMTS-4的表达。同时,聚集蛋白聚糖降解的加速也可能归因于NF-κB通路的异常活化,并在IVD退变中起关键作用。
综上所述,本研究首次通过人髓核细胞的实验研究发现,炎性细胞因子IL-1β通过促进NF-κB信号通路的异常活化,进而调控ADAMTS-4的表达,更重要的是,ADAMTS-4在细胞外基质聚集蛋白聚糖和II型胶原蛋白的降解中起到关键的作用,直接促进椎间盘退变的进展和加剧。本研究的实验结果可能为开发潜在的延缓椎间盘退变的靶点基因,提供重要的参考信息。

