乳腺浸润性小叶癌组织中miR-211-5p、SETBP1 的表达及其意义
翁向前 王叶凌 林 冰 张 爽 苏 俊
1.海南医学院第一附属医院放疗科,海南海口 570102;2.海南医学院第一附属医院普外科,海南海口 570102
乳腺癌是女性常见的恶性肿瘤,全球每年新发病例约210 万例[1]。乳腺癌中以浸润性小叶癌(infiltrating lobular carcinoma,ILC)最为常见。ILC 患者即使采取积极治疗,治疗后患者的生存预后仍较差,因此有必要探索ILC 新的诊断方法及治疗手段[2]。微RNA(microRNA,miR)是小的RNA 分子,与自身免疫性疾病、肿瘤及心血管疾病等的病理生理学过程密切相关[3-4]。miR-211-5p 基因位于15q13.3,在肾癌[5]、宫颈癌[6]等多种肿瘤中表达下调,发挥抑癌基因的作用。SET 结合蛋白1(SET binding protein 1,SETBP1)基因位于18q12.3,SETBP1 能够结合细胞核内SET 原癌基因,促进细胞增殖。研究发现,SETBP1 在多发骨髓瘤、髓系白血病等恶性肿瘤中异常表达升高,并能够促进肿瘤的恶性进展[7]。研究表明,SETBP1 受到多种miRNA(miR-4319、miR-211-5p 等)的转录后表达调控,肿瘤发生时调控SETBP1 的miRNA 表达异常降低,而SETBP1 表达升高,其共同参与肿瘤细胞的恶性进展[8],本研究通过分析miR-211-5p、SETBP1 在ILC 患者中的表达,探讨两者的临床意义。
1 资料与方法
1.1 一般资料
收集2019 年1 月至2020 年9 月海南医学院第一附属医院诊治的82 例女性ILC 患者的临床病理资料。纳入标准:①经组织病理检查确诊为ILC;②首次诊治;③患者对本研究知情同意,能够配合诊治。排除标准:①合并有急性乳腺炎、乳腺脓肿等感染性疾病;②既往有其他恶性肿瘤病史;③合并肺肾等脏器衰竭;④伴有严重心肺功能障碍。年龄30~79 岁,平均(53.1±6.2)岁;肿瘤大小≤2 cm 者39 例,>2 cm 者43 例;伴腋淋巴结转移者31 例,无腋淋巴结转移者51 例;按照2016 年第八版AJCC 乳腺癌TNM 临床分期标准[9]:Ⅰ~Ⅱ期62 例,Ⅲ~Ⅳ期20 例;组织分化程度:高中分化56 例,低分化26 例;孕激素受体(progesterone receptor,PR)阴性34 例,阳性48 例;雌激素受体(estrogen receptor,ER)阳性31 例,阴性51 例;依据免疫组织化学染色和荧光原位杂交检测结果判断c-erbB2的染色结果,阳性63 例,阴性19 例;三阴乳腺癌18 例,非三阴乳腺癌64 例。
1.2 荧光定量PCR 检测
收集术中新鲜获取的ILC 癌组织及癌旁组织(距离癌组织边缘>2 cm 且经病理学检查明确),置于液氮中冻存。实验时取约50 mg 组织,Trizol 法提取组织中总RNA,分光光度计(上海元析仪器有限公司,B-500 型)测定RNA 溶液的吸光度值,将合格的总RNA 用DEPC 水溶解,-80℃条件下保存。以总RNA为模板,进行反转录,合成cDNA。以cDNA 为模板,进行荧光定量PCR。SYBR Green premix plus 试剂盒购自TAKARA 公司,货号DRR041A。购自miR-211-5p正向引物序列:5’-ACGGGAAAGGTTGAAAGGATT-3’,反向引物序列:5’-GGGAAAGGTTGAAAGGATTGT-3’,内参U6 正向引物序列:5’-CTCGCTTCGGCAGCACA-3’,反向引物序列:5’-ACGCTTCACGAATTTGCGTGTC-3’;SETBP1 正向引物序列:5’-CCAACGCGGACAGTGAGAAAT-3’,反向引物序列:5’-CCTCCTTCGTGGCTTTGCTAT-3’,以GAPDH 为内参,正向引物序列:5’-CTGGGCTACACTGAGCACC-3’,反向引物序列:5’-AAGTGGTCGTTGAGGGCAATG-3’。总体系20 μl,其中模板2 μl,聚合酶0.2 μl、上游及下游引物各1 μl、2XSYBR Green Premix 10 μl 及ddH2O 5.8 μl。反应 条件为:94℃2 min,94℃15 s,62℃20 s,70℃10 s,变性退火延伸共35 个循环,每个样本重复3 次。目的基因miR-211-5p、SETBP1 的表达水平分别相对于内参基因U6、DAPDH 的比值为2-ΔΔCt,计算目的基因的相对表达水平。
1.3 统计学方法
采用SPSS 23.0 统计学软件对所得数据进行分析,计量资料采用均数±标准差()表示,组间比较采用t 检验。Pearson 线性相关分析miR-211-5p 与SETBP1 表达的相关性。采用TargetScan Human7.2 在线软件预测miR-211-5p 与SETBP1 的结合位点。以P <0.05 为差异有统计学意义。
2 结果
2.1 ILC 癌与癌旁组织中miR-211-5p 与SETBP1 表达差异
ILC 癌组织中miR-211-5p 的相对表达量明显低于癌旁组织,差异有统计学意义(P <0.05),而SETBP1的相对表达量显著高于癌旁组织,差异有统计学意义(P <0.05)。见表1。
表1 ILC 癌与癌旁组织中miR-211-5p 与SETBP1表达水平比较()

表1 ILC 癌与癌旁组织中miR-211-5p 与SETBP1表达水平比较()
注:ILC:浸润性小叶癌;miR-211-5p:微小RNA-221-5p;SETBP1:SET 结合蛋白1
2.2 ILC 癌组织中miR-211-5p、SETBP1 表达与临床病理特征的关系
不同年龄、肿瘤大小、组织分化程度、ER 表达、PR 表达、c-erbB2 表达、三阴性表达的癌组织中miR-211-5p、SETBP1 表达比较,差异无统计学意义(P >0.05)。与肿瘤TNM 分期Ⅰ~Ⅱ期ILC 癌组织比较,肿瘤TNM 分期Ⅲ~Ⅳ期的ILC 癌组织中miR-211-5p 表达显著较低,而SETBP1 的表达显著较高(P <0.05)。与无腋淋巴转移ILC 癌组织比较,伴腋淋巴转移的ILC 癌组织中miR-211-5p 表达显著较低,而SETBP1的表达显著较高(P <0.05)。见表2。
表2 癌组织中miR-211-5p、SETBP1 表达与临床病理特征的关系()
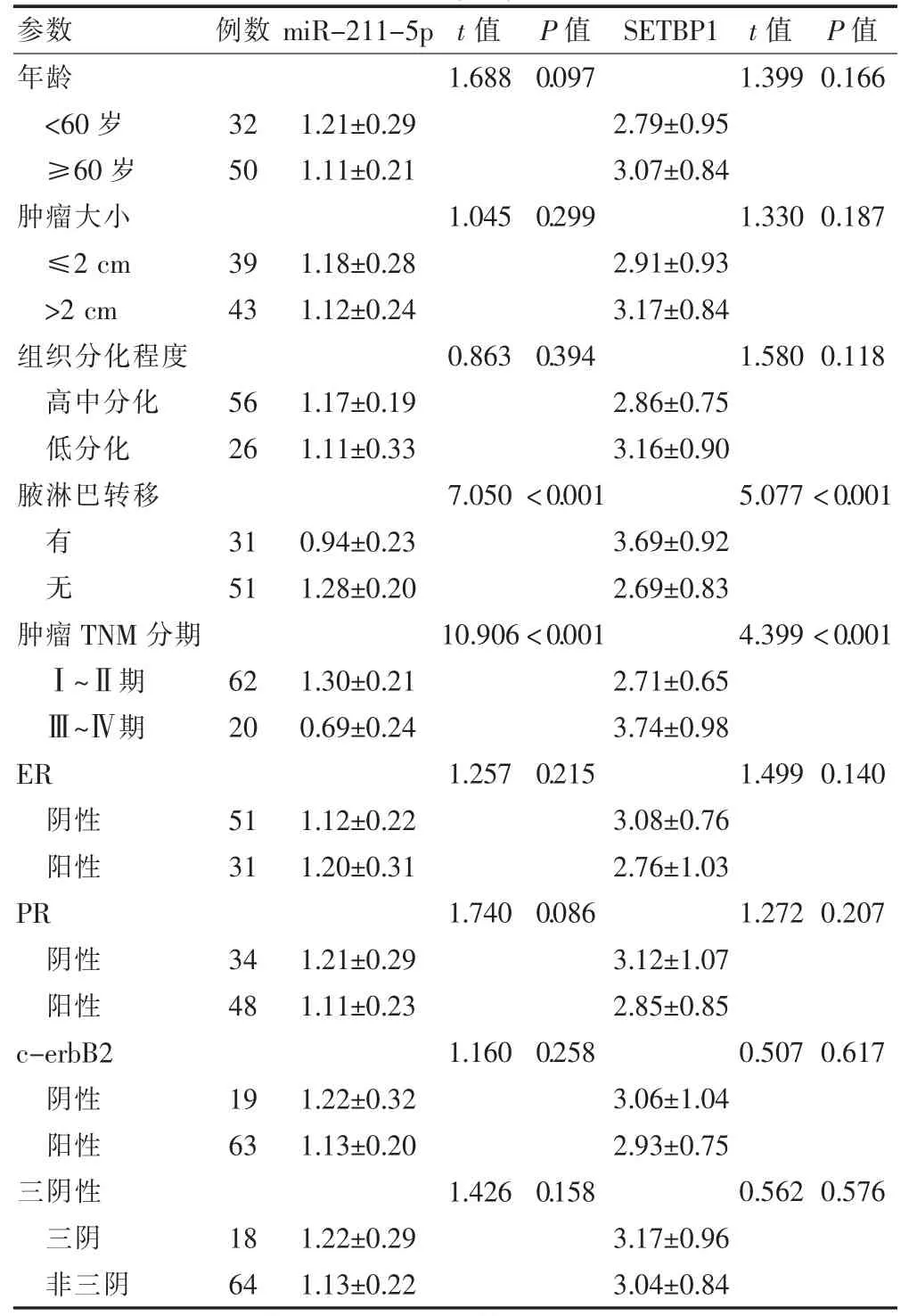
表2 癌组织中miR-211-5p、SETBP1 表达与临床病理特征的关系()
注:ER:雌激素受体;PR:孕激素受体;miR-211-5p:微小RNA-221-5p;SETBP1:SET 结合蛋白1
2.3 ILC 癌组织中miR-211-5p、SETBP1 表达的相关性
ILC 癌组织中miR-211-5p 的相对表达量与SETBP1 的相对表达量呈显著负相关(r=-0.573,P <0.001)。见图1。
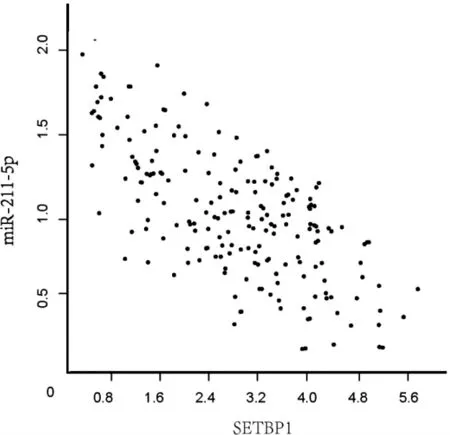
图1 癌组织中miR-211-5p 与SETBP1 相对表达量的相关性
2.4 miR-211-5p 与SETBP1 的结合位点预测
TargetScan Human7.2 在线软件对miR-211-5p与SETBP1 的结合位点进行预测,结果显示SETBP1的3’UTR 区第374 至381 个碱基处存在与miR-211-5p 潜在的互补结合位点。见图2。

图2 TargetScan Human7.2 在线软件预测miR-211-5p与SETBP1 的结合位点
3 讨论
乳腺癌是女性常见的恶性肿瘤,我国每年发病例数达16.9 万例,死亡例数达4.5 万例[10-13]。深入研究ILC 发生发展的分子机制,对寻找新的诊断治疗靶点,意义较大。肿瘤的生物学特征包括无限增殖、凋亡抑制、过度肿瘤血管生成、获得浸润和转移能力、免疫逃逸、代谢异常及基因组不稳定和突变。研究表明,肿瘤中存在多种miRNA 异常表达升高或降低的现象,并通过调控肿瘤细胞的增殖、凋亡及转移等恶性行为,影响肿瘤的发生发展过程[14]。
miR-211-5p 基因位于人类15 号染色体,其能够结合下游靶基因信使RNA 的3’非编码区,降低靶基因信使RNA 的稳定性,抑制下游靶基因的蛋白表达[15]。近年来研究发现,miR-211-5p 在肾细胞癌[16]、宫颈癌[17]等肿瘤中均存在表达降低的现象,导致肿瘤细胞过度增殖,凋亡减少。本研究中,ILC 癌组织中miR-211-5p 的相对表达量显著低于癌旁组织。目前miR-211-5p 表达降低的机制尚不清楚,可能与长链非编码RNA 如F11-AS1 等对miR-211-5p 的表达调控异常有关。有研究报道,长链非编码RNA F11-AS1 能够作为分子海绵结合并抑制miR-211-5p 的表达,降低miR-211-5p 的表达水平,进而促进下游癌基因核受体亚家族成员3 的表达,导致肿瘤的恶性进展[18]。本研究结果亦显示,与肿瘤TNM 分期Ⅰ~Ⅱ期ILC 癌组织比较,肿瘤分期Ⅲ~Ⅳ期的ILC 癌组织中miR-211-5p 表达显著较低(P <0.05)。与无腋淋巴转移ILC 癌组织比较,伴腋淋巴转移的ILC 癌组织中miR-211-5p 表达显著较低(P <0.05)。提示miR-211-5p 的低表达参与促进ILC 的发生发展。肿瘤细胞的过度增殖及转移潜能是肿瘤的重要特征。有研究发现,miR-211-5p在肿瘤中发挥抑癌基因的作用,miR-211-5p 能够结合癌基因Ezrin 信使RNA 的3’非编码区的结合位点,抑制Ezrin 的表达,过表达miR-211-5p 后,Src 信号通路受到抑制,肿瘤细胞的增殖、迁移和侵袭能力减弱,因此,肿瘤中miR-211-5p 表达水平降低激活肿瘤细胞中Src 信号通路,促进肿瘤的增殖及淋巴转移,导致肿瘤进展[19]。
SETBP1 位于人类18 号染色体,参与个体正常细胞的增殖、分化及发育等生物学过程。近年来有学者报道,SETBP1 作为一种致癌基因,在慢性粒细胞白血病、骨髓瘤等肿瘤中存在异常表达升高的现象,其表达水平升高能够促进肿瘤的发生发展[7]。本研究中,ILC 癌组织中SETBP1 的表达水平亦显著升高,其机制尚不清楚。有学者在白血病中发现,SETBP1 基因的SKI 同源域内有4 个氨基酸突变热点,这些基因位点的突变导致泛素连接酶对底物的识别能力降低,导致泛素连接酶降解SETBP1 的功能丧失,引起SETBP1表达的上调,SETBP1 能够进一步激活Janus 激酶1,促进肿瘤细胞的恶性增殖[20-21]。本研究中,与肿瘤TNM 分期Ⅰ~Ⅱ期及无液淋巴转移ILC 癌组织比较,肿瘤TNM 分期Ⅲ~Ⅳ期及伴淋巴结转移患者ILC 癌组织中SETBP1 表达较高,提示SETBP1 的高表达参与促进ILC 的恶性进展。其机制目前尚不清楚,SETBP1 能够促进肿瘤细胞发生上皮间质转化,促进肿瘤细胞的局部浸润及转移的发生。有学者在肺癌中发现,SETBP1 能够诱导肺肿瘤细胞N-钙黏素及Vimentin 等间质性表达,而上皮性标志如E-钙黏素表达降低,使肿瘤细胞发生上皮间质转换,细胞间黏附能力下降,肿瘤细胞易发生局部浸润及淋巴管侵犯,导致肿瘤分期升高及腋淋巴结转移[22-25]。
本研究中ILC 癌组织中miR-211-5p 与SETBP1表达呈明显负相关,其原因可能是SETBP1 是miR-211-5p 的下游靶基因,SETBP1 的表达受到miR-211-5p 的调控。本研究结果亦显示SETBP1 的3’非编码区的第374 至381 个碱基处存在与miR-211-5p潜在的互补结合位点。因此,miR-211-5p 可能通过结合SETBP1 信使RNA 的3’非编码区,降低SETBP1信使RNA 稳定性,抑制SETBP1 的表达。有研究亦证实,SETBP1 是miR-211-5p 的直接下游靶基因,miR-211-5p 能够通过转录后水平抑制SETBP1 的表达,促进肿瘤增殖、浸润及转移[26-27]。但ILC 中二者的具体作用机制有待深入研究。
综上所述,不同肿瘤TNM 分期及是否伴腋淋巴结转移的ILC 癌组织中miR-211-5p 和SETBP1 表达水平有差异,miR-211-5p 和SETBP1 共同参与ILC的发生发展病理过程。针对miR-211-5p 及SETBP1的调控或上游的调控分子进行特异性靶向治疗,可能是一种新的乳腺癌治疗方式,但仍需多中心、大样本的临床资料深入研究两者的临床意义。

