辣椒几丁质酶类基因家族的全基因组鉴定和表达特征分析
刘卓毅 于文菲 蔡文丽 刘子珊 张雨 袁媛 伍炳华 吕美玲



摘 要:几丁质酶(chitinase, EC 3.2.1.14)是一种降解几丁质的糖苷酶,在植物应对非生物和生物胁迫中起重要作用。本研究对辣椒几丁质酶类(Capsicum annuum chitinase-like, CaCTL)基因家族成员进行了全基因组注释、进化分析和基因表达模式分析。从最新的辣椒基因组数据库中鉴定出31个CaCTL成员。根据系统发育进化树将这些成员分为GH18和GH19亚家族,并进一步分为5个亚类(Ⅰ~Ⅴ类)。保守基序分析结果表明,每个亚类中的成员存在功能相关性。对辣椒、矮牵牛以及番茄的CTL基因家族成员同源性分析表明,在矮牵牛和番茄中分别有7个和11个辣椒CaCTL的同源基因。通过qRT-PCR分析发现,在正常环境生长的辣椒植株中,64.2%的GH18亚家族的CaCTL成员表达水平很低,有64.7%的GH19亚家族成员在不同组织中存在差异表达。顺式作用元件分析表明,CaCTL成员启动子区域存在许多激素反应以及生物和非生物应激相关元件。当植物遭受不同的非生物胁迫时,qRT-PCR结果显示,多数CaCTL成员表达上调。当植物遭受高温干旱条件时,多个CaCTL成员的表达上调明显。上述结果丰富了CTL基因家族进化的研究,为探索CaCTL成员的功能提供了数据基础。
关键词:辣椒;几丁质酶类基因;非生物胁迫;进化分析;表达分析
中图分类号:S641.3 文献标识码:A
Abstract: Chitinase (EC 3.2.1.14) is chitin-degrading glycosidase, which plays important roles in the abiotic and biotic defense of plants. In this study, we conducted whole-genome annotation, molecular evolution, and gene expression analyses on the Capsicum annuum chitinase-like (CaCTL) gene family members. Thirty-one CaCTL genes (CaCTLs) were identified from the latest Capsicum genome database. According to the phylogenetic analysis, the genes were divided into GH18 and GH19 subgroups and further subdivided into five classes (Class I to Class V). Conserved motif arrangements indicated the functional relevance within each group. Homology analysis of CTL gene family members in pepper, petunia and tomato indicated that there were 7 and 11 homologous genes of CaCTL members in petunia and tomato, respectively. By qRT-PCR analysis, in the normal growing plants, we found that 64.2% GH18 subgroup CaCTLs showed a very low expression level, 64.7% GH19 subgroup CaCTLs were differentially expressed in different tissues. Cis-acting element analysis showed that many hormone responses, as well as biotic and abiotic stress elements were found in the promoters of CaCTLs. Correspondingly, qRT-PCR showed that many CaCTLs had upre gulated expression profiles when the plants suffered different abiotic stress conditions, especially when plants are subjected to high temperature and drought conditions. The results would enrich the evolutionary process of the CTL gene family and provide a foundation for the exploration of the function of CaCTLs.
Keywords: Capsicum annuum L.; chitinase-like gene; abiotic stress; evolution analysis; expression analysis
DOI: 10.3969/j.issn.1000-2561.2021.11.008
幾丁质酶(chitinase,EC.3.2.1.14)是一种由单基因编码的降解几丁质的糖苷酶,主要水解几丁质多聚体中的β-1,4糖苷键,产生N-乙酰氨基葡萄糖寡聚体。几丁质酶广泛存在于自然界的各类生物中。细菌可以通过合成的几丁质酶分解几丁质获得营养维持生存;真菌中的几丁质酶在其细胞分裂和形态建成等方面发挥作用;昆虫等节肢动物中的几丁质酶在其蜕皮等生长发育中发挥重要的作用[1];人体内的类几丁质酶大多与免疫相关[2]。植物中的几丁质酶表达具有组织特异性,参与植物的营养生长[3]和有性生殖[4]的调控过程。几丁质酶在植物抵御疾病以及环境胁迫方面也发挥重要作用。研究表明,当植物受到干旱[5]、低温[6]、病虫害[7-8]等非生物和生物胁迫时,会引起体内几丁质酶含量的增加。
根据氨基酸序列的差异以及结构域的有无,植物几丁质酶可以分为糖苷水解酶家族18(glycoside hydrolase family 18,GH18)和糖苷水解酶家族19(glycoside hydrolase family 19,GH19)2个亚家族。GH18亚家族成员广泛存在于细菌、真菌、植物、哺乳动物、昆虫和病毒等生物体中,而GH19亚家族成员仅出现在植物以及链霉菌属中[9]。Cao等[10]在番茄中鉴定了43个SlCTL(Solanum lycopersicum chitinase-like)成员,有11个属于GH18亚家族,有32个属于GH19亚家族,发现胁迫处理以及外源激素处理会引起多数成员的响应。GH19亚族成员具有Chitin-bind domain(CBD)结构。CBD可以与几丁质结合,加速或加剧植株对侵入病虫菌的识别与反应,增强植物体对环境胁迫的抵抗能力[11-12]。Ali等[13]从辣椒中鉴定了16个具有CBD结构的几丁质酶类基因(Capsicum annuum chitinase-like,CaCTL),包括CM334数据库中的8个和Zunla-1数据库中的8个,发现这些CaCTL成员参与逆境防御反应和信号转导,在辣椒的生长调节以及胁迫响应中发挥至关重要的作用。
辣椒是一种重要的经济作物,具有极高的生产价值。在生长过程中极易遭受炭疽病、灰霉病、软腐病等各类生物病害和异常温度、水量、pH、环境等非生物因素的伤害,影响其产量与品质,导致经济价值下降。本研究通过序列检索和比对,在辣椒CM334数据库中检索到了31个CaCTL成员(包括Ali等[13]从辣椒CM334数据库中检索到的8个含有CBD结构的CaCTL成员),分析了CaCTL的进化关系、基因结构、组织特异表达以及响应环境胁迫的表达特征等。
1 材料与方法
1.1 CaCTL基因家族成员的序列鉴定
根据已发表文献[10, 14],在拟南芥(Arabidopsis thaliana)基因组数据库(TAIR,http://arabidopsis. org/)和茄科基因组数据库(Sol genomics network,https://solgenomics.net/)中分别下载到25条拟南芥和43条番茄的CTL成员的氨基酸序列。将上述序列在茄科基因组网站的Capsicum annuum L. v CM344数据库中进行蛋白BLAST比对,收集比对结果中有“Chitinase”或者“Chitinase-like”注释的氨基酸序列。为了防止遗漏,同时在Capsicum annuum L. v CM344蛋白注释数据库中以“Chitinase”为关键词直接检索,收集检索结果中的氨基酸序列。将上述2次获得的序列结果进行整合,去除冗余序列。使用NCBI数据库中的“CD-Search”功能分析非冗余蛋白序列中的功能域。根據上述分析结果,确定最终的CaCTL基因家族成员。
1.2 CaCTL基因家族成员的序列比对、进化树构建和理化性质预测
在NCBI中搜索获得拟南芥(A. thaliana)、人类(Homo sapiens)、欧洲云杉(Picea abies)、玉米(Zea mays)、罗晃子(Tamarindus indica)和酿酒酵母(Saccharomyces cerevisiae)6个物种中鉴定的CTL的氨基酸序列。利用ClustalW软件进行CaCTL成员与上述蛋白的氨基酸多重序列比对,使用MEGA 7软件的NJ(Neighbor Joining)法构建系统发育树,并使用EvolView(https://www. evolgenius.info)在线美化。通过ExPASY网站(https: //web.expasy.org/protparam/)中的检索计算功能获得CaCTL成员的分子量、等电点信息。利用CELLO在线工具(CELLO v.2.5,http://cello.life. nctu.edu.tw/)预测蛋白的亚细胞定位。
1.3 基因结构、保守基序、顺式作用元件和同源性分析
利用MEME 5.0.5在线工具(http://meme-suite. org/tools/meme)分析CaCTL基因家族成员的保守基序,最大检索参数设置为16,其他数值默认。为了增加可信度,运用保守域数据库(CDD,http://www.ncbi.nlm.nih.gov/cdd/)进一步检查基因家族成员序列的保守结构域。进而利用TBtools工具绘制CaCTL家族成员的基因结构(外显子-内含子)图。
利用TBtools软件在茄科基因组网站(Sol genomics network,https://solgenomics.net/)提取辣椒基因组文件中各家族成员起始密码子上游2 kb的序列。将获得的序列提交到PlantCare网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺势作用元件预测。对预测的顺势元件信息进行整理筛选后,使用TBtools进行可视化作图。
为分析CTL基因家族在茄科植物中的分布及同源关系,从茄科基因组数据库中下载矮牵牛(ftp://ftp.solgenomics.net/genomes/Petunia_axillaris)、辣椒(ftp://ftp.solgenomics.net/genomes/Capsi-cum_annuum/C.annuum_cvCM334)和番茄(ftp:// ftp.solgenomics.net/tomato_genome/Fla.8924)的基因组序列文件和注释文件(矮牵牛未组装到染色体水平),使用TBtools软件进行基因同源性分析并对结果进行可视化。
1.4 植物材料与胁迫处理
植物材料辣椒种植于福建农林大学园艺学院人工气候室。培养光周期为14 h光照/10 h黑暗,温度为(25±1)℃,湿度为70%。在生殖生长期取辣椒的根、茎、叶、花蕾、开放花和浆果,保存于–80 ℃冰箱。
植物材料的胁迫处理试验:首先用75%的乙醇清洗辣椒种子30 s,进而用无菌水冲洗3次,然后用2%次氯酸钠溶液消毒5 min,再次用无菌水冲洗3次。将上述处理过的种子播种于MS液体培养基中,置于在14 h光照/10 h黑暗环境下震荡培养,生长温度设置25 ℃。待辣椒幼苗子叶展开后,将幼苗分为3个处理组,第1组置于(4±1)℃条件下3 h进行低温胁迫处理,第2组置于(42±1)℃下3 h进行高温胁迫处理,第3组置于无尘滤纸上24 h进行干旱胁迫处理。以置于正常生长条件下培养的幼苗作为对照。收集上述处理后的植物材料,保存于–80 ℃冰箱。
1.5 qRT-PCR分析
取辣椒根、茎、叶、花蕾、开放花、浆果和受胁迫处理的幼苗材料各100 mg,使用Trizol试剂盒(全式金生物,北京)提取总RNA。分别取上述组织的1 μg总RNA,使用PrimeScript RT试剂盒(全式金生物,北京)反转录成一链cDNA。
利用NCBI网站的引物设计工具(http:// www.ncbi.nlm.nih.gov/tools/primer-blast/)设计辣椒CaCTL基因家族成员的qRT-PCR引物。根据文献[15],选择CaUBI为内参基因(F:5-TGTCC ATCTGCTCTCTGTTG-3,R:5-CACCCCAAGCA CAATAAGAC-3)。用TransStart Top Green qPCR SuperMix试剂盒(全式金生物,北京),在CFX96实时系统(Bio-Rad,美国)实时荧光定量PCR仪上进行各基因表达水平的检测。每一反应总体积为15 μL。qRT-PCR反应条件如下:94 ℃反应30 s后,进行42个循环。每个循环为94 ℃反应5 s,60 ℃反应15 s和72 ℃反应10 s。试验设置3次生物学重复,每次生物学重复开展3次技术重复,采用2-CT方法计算相对表达水平。随后利用TBtools软件生成热图,利用GraphPad Prism 8软件生成柱状图。
2 结果与分析
2.1 CaCTL基因家族成员的鉴定与系统发育分析
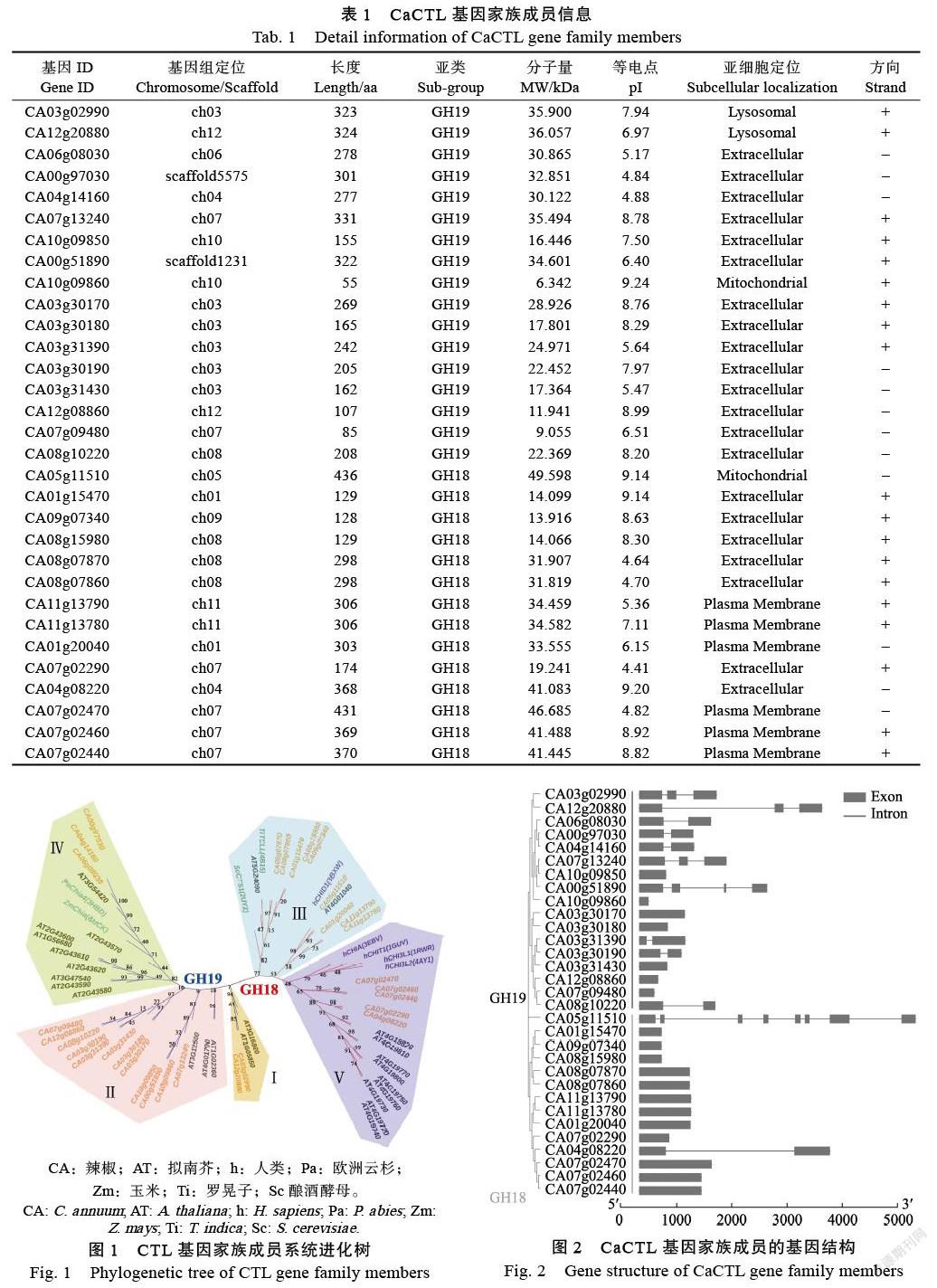
通过序列比对和功能域分析,发现辣椒基因组中存在31个被注释的有水解几丁质功能或具有几丁质酶类功能的CaCTL成员(表1)。序列分析表明,CaCTL成员氨基酸的长度范围为55 AA(CA10g09860)~436 AA(CA05g11510),蛋白质分子量为6.342~49.598 kDa,等电点(pI)为4.64~9.24。通过亚细胞定位分析,发现CaCTL成员大多定位于胞外基质中,少数定位在溶酶体、线粒体或质膜上。
系统发育分析结果表明(图1),CaCTL基因家族成员分别有14个(45.1%)和17个(54.9%)属于GH18和GH19亚家族。本研究将CaCTL家族成员进一步分为5类。其中Ⅲ类和Ⅴ类属于GH18亚家族,分别包含9个和5个CaCTL成员,都包含有GH18结构域;Ⅰ类、Ⅱ类和Ⅳ类属于GH19亚家族,分别包含2个、12个和3个CaCTL成员,都包含有GH19结构域。
2.2 CaCTL基因家族成员的基因结构、保守结构域以及顺式元件分析
外显子-内含子结构分析结果显示(图2),GH18和GH19亚家族间基因的结构和内含子的数目存在明显差异。GH18亚家族成员多数(85.7%)不含有內含子,而GH19亚家族成员多数(58.9%)含有内含子。在31个CaCTL成员中有5个具有较长的内含子结构,包括CA12g20880、CA00g51890、CA08g10220、CA5g11510、CA04g08220;有19个成员(61.2%)不具备内含子,有3个成员(9.7%)具有2个内含子,1个成员(3.2%)具有3个内含子,1个成员CA05g11510(3.2%)具有7个内含子。
通过NCBI网站中的Pfam工具,检索分析16个预测可能与GH18或者GH19相关的氨基酸保守基序。分析结果表明(图3),同一亚家族的CaCTL成员间存在功能的相关性。在GH19亚家族中,Ⅰ类和Ⅳ类成员都含有Glyco_hydro_19 motif,Ⅱ类中只有3个成员含有Glyco_hydro_19 motif,其余成员均含有Chitin_bind motif (除CA08g10220),并且Chitin_bind motif仅分布于GH19亚家族中。在包含Ⅲ类和Ⅴ类的GH18亚家族中,除了CA05g11510没有被检索到motif外,其他的CaCTL成员广泛分布有Glyco_hydro_18 motif。但是利用NCBI的CD-Search工具进行检索时,发现CA05g11510具有GH18结构域。
启动子区域往往存在许多防御相关的响应元件。对起始密码子上游2 kb区域的序列进行预测,发现CaCTL成员启动子区域含有的顺式元件涉及响应植物激素和非生物胁迫等多个方面(图4)。主要包括5种激素类响应元件,分别为茉莉酸响应元件(CGTCA/TGACG-motif)、赤霉素响应元件(TATC/P/GARE-motif)、脱落酸响应元件(ABRE)、水杨酸响应元件(TC A-element)和生长素响应元件(TGA-element/AuxRR-core)。CGTCA/TGACG-motif存在于22个CaCTL成员的启动子区域,其中CA07g02470的启动子区域中最多,含有12个;TATC/P/GARE-motif存在于15个CaCTL成员的启动子区域,其中CA01g20040的启动子区域中最多,含有4个;ABRE存在于23个CaCTL成员的启动子区域,CA04g08220和CA07g02460的启动子区域中最多,分别含有5个;TCA-element存在于10个CaCTL成员的启动子区域,除了CA08g07860和CA11g13780的启动子区域分别含有3个,其余基因分别含有1个;TGA-element/AuxRR-core存在于14个CaCTL成员的启动子区域,CA08g10220的启动子区域中最多,含有3个。干旱诱导响应元件(MBS)、低温响应元件(LTR)、防御与胁迫响应元件(TC-rich repeats)以及昼夜节律响应元件(circadian)也分布在该家族的许多成员的启动子区域。MBS存在于15个CaCTL成员的启动子区域,CA03g30180的启动子区域中存在5个;LTR存在于9个CaCTL成员的启动子区域,除了CA11g13780的启动子区域中有2个以外,其他8个基因中都只含有1个该元件;TC-rich repeats存在于12个CaCTL成员的启动子区域,CA03g02990、CA03g30180、CA12g08860的启动子区域中数量最多,各含有3个。其他顺式元件,比如创伤响应元件(WUN- motif)仅存在与CA00g97030的启动子区域,参与玉米蛋白代谢调控的元件(O2-site)在CA08g15980的启动子区域中最多,含有3个。MYBHv1结合位点(CCAAT-box)以及AT-rich DNA结合蛋白(ATBP-1)的结合位点(AT-rich element)分别存在于9个和5个CaCTL成员的启动子区域中。
2.3 CaCTL基因家族成员染色体定位以及基因复制和进化分析
染色体定位分析结果表明(图5),在辣椒的12条染色体中,除第2号染色体外,其他染色体上均有CaCTL基因的分布。有29个CaCTL基因定位在11条染色体上,2个CaCTL基因分别定位在2条scaffold上(CA00g51890定位在scaffold5575上,CA00g97030定位在scaffold1231上)。第3号和第7号染色体上分布最多,各含有6个CaCTL成员,其次是第8号染色体,含有4个CaCTL成员。在第7号、第8号和第11号染色体上分别含有1个串联重复基因对(CA07g02440和CA07g02460、CA08g07860和CA08g07870、CA11g13780和CA11g13790)。
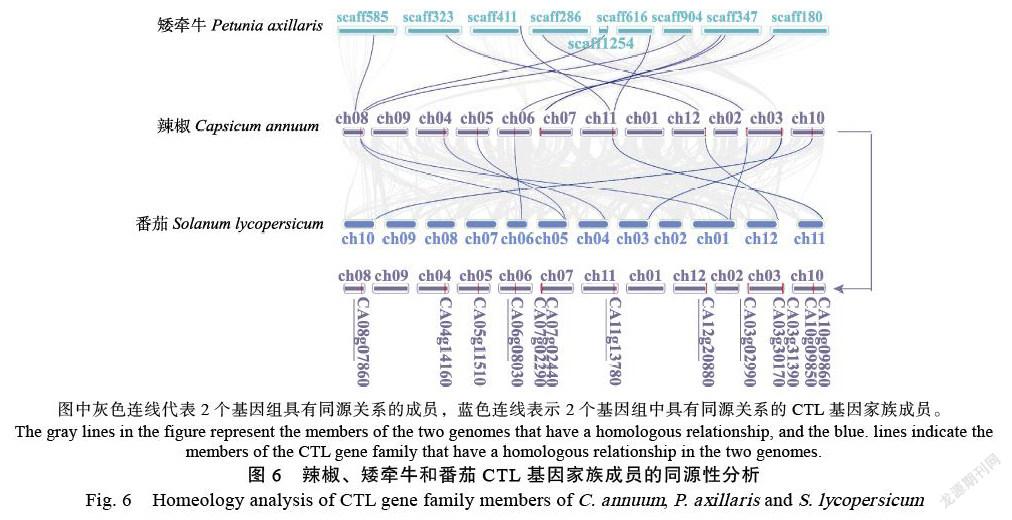
为了分析不同物種中CTL的进化关系,本研究对茄科植物辣椒、矮牵牛和番茄的CTL基因家族成员的同源性进行了分析。结果表明(图6),矮牵牛和番茄基因组中有多个CTLs与辣椒的CaCTL成员存在同源性。辣椒基因组中分别有7个CaCTLs(CA08g07860、CA06g08030、CA07g 02290、CA07g02440、CA11g13780、CA12g02880、CA03g02990)和矮牵牛CTL成员存在同源性;有11个CaCTLs(CA08g07860、CA04g14160、CA05g11 510、CA06g08030、CA11g13780、CA12g20880、CA03g02990、CA03g31390、CA03g30170、CA10g09 860和CA10g09850)和番茄CTL成员存在同源性。
图中灰色连线代表2个基因组具有同源关系的成员,蓝色连线表示2个基因组中具有同源关系的CTL基因家族成员。
The gray lines in the figure represent the members of the two genomes that have a homologous relationship, and the blue. lines indicate the members of the CTL gene family that have a homologous relationship in the two genomes.
2.4 CaCTL基因家族成员的表达特征
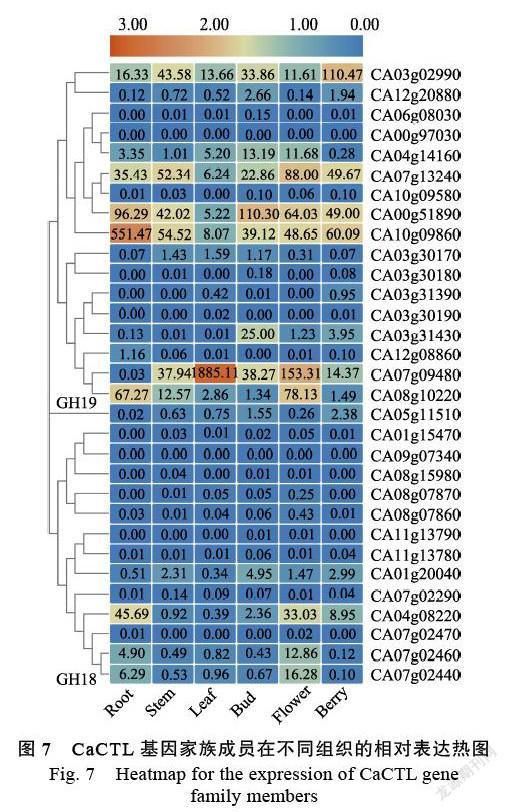
通过qRT-PCR试验检测CaCTL成员在辣椒6个组织(根、茎、叶、花蕾、开放花和浆果)中的表达特征。结果表明,GH18和GH19两个亚家族CaCTL成员之间的表达差异非常明显(图7)。在GH19亚家族的17个CaCTL成员中,有6个基因(CA06g08030、CA00g97030、CA10g09850、CA03g30180、CA03g31390和CA03g30190)在所有组织中低表达或者不表达,而其他11个基因(64.7%)在不同组织中呈现差异表达。CA10g 09860、CA07g09480、CA00g51890和CA03g02990分别在根、叶片、浆果和花苞优势表达。在GH18亚家族的CaCTL成员中,有9个成员(64.2%)呈现低表达态势,优势表达基因主要集中在根和花组织中。综上所述,有超过半数的CaCTL成员在正常生长的植株中显示出较低的表达水平。
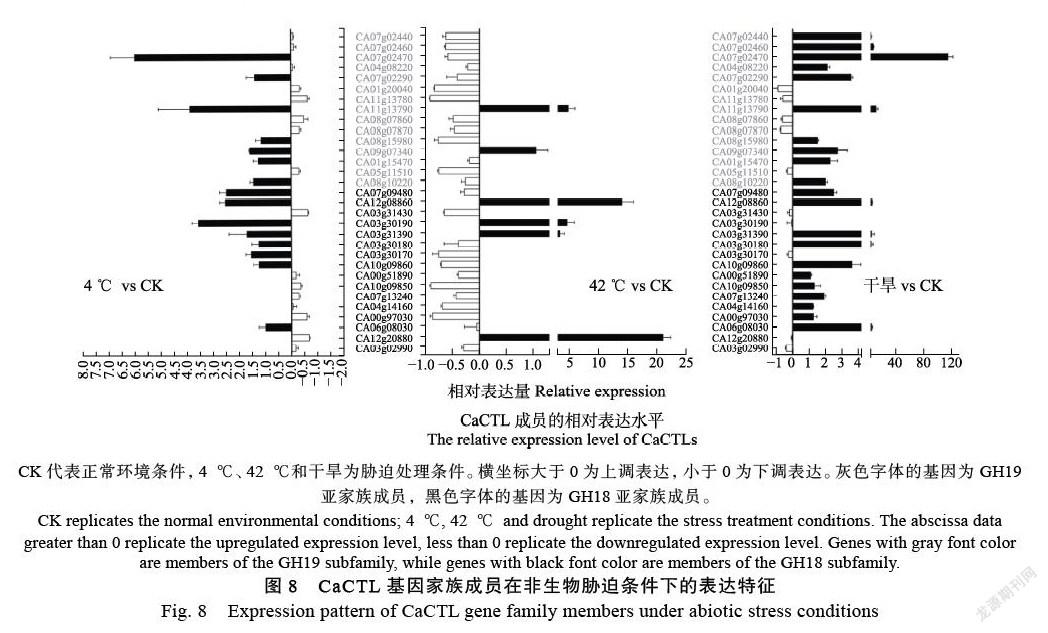
通过qRT-PCR分析,检测CaCTL基因家族成员在受低温(4 ℃)、高温(42 ℃)以及干旱环境胁迫处理的幼苗中的表达特征。结果表明,与正常生长的幼苗相比,在受低温胁迫的幼苗中,CA03g30190、CA03g30170、CA07g09480、CA07g02470、CA12g08860等5个成员相对表达量显著提高,而CA12g20880、CA00g97030、CA03g31430、CA08g07860、CA11g13780和CA01g 20040等6个成员的表达明显受到抑制(图8)。其中CA07g02470的相对表达水平最多,被上调6倍;CA12g20880的相对表达水平最少,被下调3.3倍。在受42 ℃高温胁迫的幼苗中,相对表达水平被上调成员数量少但幅度大,被下调的成员数量多但幅度小。其中CA12g20880、CA11g13790、CA03g 31390、CA03g30190和CA12g08860等5个成员的相对表达量显著升高,与对照中的表达水平存在极显著差异,并以CA12g20880的相对表达水平最高,被上调21.1倍,而CA00g97030、CA10g 09850、CA10g09860、CA03g31430、CA05g 11510、CA08g15980、CA01g20040、CA07g02470、CA04g 14160、CA11g13780、CA03g30170和CA07g02460共计12个成员的表达水平明显下调。在受干旱胁迫的幼苗中,绝大多数的CaCTL成员呈现相对表达量被上调,CA06g08030、CA10g09860、CA03g 30180、CA03g31390、CA07g 09480、CA08g10220、CA01g15470、CA11g13790、CA07g02290、CA04g 08220、CA07g02470、CA12g 08860、CA07g02440、CA09g07340和CA07g02460共计15个成员响应强烈,尤其是CA07g02470的相对表达水平比对照幼苗植株高出114.7倍。仅有CA03g02990、CA05g11510、CA08g07870、CA08g07860、CA01g 20040和CA11g137806等6个成员显示出明显的下调。综合来看,多数CaCTL成员的相对表达量在2个或者2个以上的逆境环境中都有上调。其中CA03g31390、CA11g13790和CA12g08860在3个胁迫处理中响应强烈,CA03g30190在低温和高温胁迫条件下均显著上调,CA08g10220、CA07g 09480和CA07g02470在低温以及干旱两种环境中上调。CA03g31430、CA05g11510、CA08g07870、CA08g07860、CA01g20040和CA11g13780在3种处理中相对表达量都显著低于对照中的表达水平。
CK代表正常环境条件,4 ℃、42 ℃和干旱为胁迫处理条件。横坐标大于0为上调表达,小于0为下调表达。灰色字体的基因为GH19亚家族成员,黑色字体的基因为GH18亚家族成员。
CK replicates the normal environmental conditions; 4 ℃, 42 ℃ and drought replicate the stress treatment conditions. The abscissa data greater than 0 replicate the upregulated expression level, less than 0 replicate the downregulated expression level. Genes with gray font color are members of the GH19 subfamily, while genes with black font color are members of the GH18 subfamily.
3 讨论
几丁质酶在植物的生长发育中扮演重要角色。在水稻中,几丁质酶类基因OsCLP的T-DNA插入突变体(osclp)表现出根和茎生长的显著阻滞[16]。在拟南芥中,几丁质酶类基因AtCTL1和AtCTL2被敲除时,ctl1单突变体和ctl1ctl2双突变体均表现出植株变矮,开花推迟和角果变小的表型[17]。在矮牵牛中,几乎所有的花发育相关几丁质酶活性都位于柱头上,并且在花药开裂后活性增加约5倍[18],说明植物几丁质酶在高等植物的有性生殖特别是授粉授精过程中也发挥功能。在本研究中,CaCTL成员在辣椒的根、茎、叶、花、浆果中的表达特征存在明显差异,31个被鉴定的CaCTL成員可以区分为优势表达、微量表达和不表达3种模式。优势表达的成员在不同的组织中的表达水平存在差异,在同一器官的不同阶段也呈现显著变化。在花器官中,CA03g02990、CA12g20880、CA04g14160、CA00g51890、CA03g 31430、CA05g11510和CA01g20040在花苞到开放花的发育阶段相对表达均呈下调模式,而CA07g13240、CA10g09860、CA07g09480、CA08g 10220、CA04g08220、CA07g02460和CA07g02440表现出上调表达,推测它们可能在花器官的发育中发挥作用。另外,CA03g02990、CA07g13240、CA00g51890、CA10g09860、CA07g09480、CA08g 10220和CA04g08220在营养器官(根、茎、叶)中优势表达,推测这些CaCTL成员或许在辣椒植株营养生长时期发挥作用。这些推测还需要进一步的试验验证。
植物作为一种固着生物,其生长发育过程深受立地环境的影响,严重时甚至导致死亡,比如异温[19-21]、干旱[22]、水淹、盐碱危害[23-24]等非生物胁迫,以及由灰霉菌[25]、甜菜夜蛾[26]等造成的生物胁迫。为了应对胁迫伤害,植物会合成一系列“病程相关蛋白”(pathogenesis-related proteins,PRs)度过危机。几丁质酶也属于一类PRs,在增强植物抗性胁迫方面的作用被日渐关注。本研究发现,CaCTL基因家族成员对非生物胁迫环境也产生了广泛的响应。比如CA07g02470在低温和干旱胁迫环境中的上调倍数显著,CA12g20880对高温胁迫响应强烈,可能在相应胁迫环境的应对中发挥重要作用。部分成员与多种胁迫响应相关,如CA03g31390、CA11g13790、CA12g08860、CA03g30190、CA08g10220、CA07g09480和CA07g 02470。这种现象在杨树[27]和大豆[28]的CTL家族成员研究中也有出现,即同一个家族成员可以参与到不同的逆境响应机制中。本研究发现胁迫环境中响应较为敏感的CaCTL成员都具备有相应的顺式元件,比如CA03g31390含有1个低温响应元件、CA11g13790含有1个干旱响应元件、CA12g08860含有1个低温响应元件以及3个防御应激元件、CA03g30190还有1个防御应激元件、CA08g10220含有1个干旱响应元件、CA07g09480含有1个干旱响应元件以及1个防御应激元件。或许还有一些胁迫响应元件不在检索的2 kb长度之内,但这些元件基本都与CaCTL成员在非胁迫环境中的响应规律相一致。已有研究报道表明,茉莉酸(JA)、水杨酸(SA)和脱落酸(ABA)等植物激素和植物信号物质都参与了植物体内各种应激信号通路的运行[29-32]。辣椒中含有CBD结构的几丁质酶对外源激素会产生响应[13],番茄CTL基因家族成员也已经被证实积极参与到植物激素和植物信号的反应过程[10]。本研究中顺式元件预测发现,许多CaCTL成员的启动子区域也包含有多个激素响应元件,说明这些成员可能在植物激素响应过程中发挥作用。但具体的触发过程以及响应模式还有待进一步的研究探讨。该研究结果丰富了CaCTL基因家族进化的研究,为后期CaCTL基因家族成员的功能鉴定和辣椒的抗性育种提供数据基础。
参考文献
[1] Ding X, Gopalakrishnan B, Johnson L B, et al. Insect resis-tance of transgenic tobacco expressing an insect chitinase gene[J]. Transgenic Research, 1998, 7(2): 77-84.
[2] Li H, Greene L H. Sequence and structural analysis of the chitinase insertion domain reveals two conserved motifs in-volved in chitin-binding[J]. PLoS One, 2010, 5(1): e8654.
[3] Singh H R, Deka M, Das S. Enhanced resistance to blister blight in transgenic tea (Camellia sinensis [L.] O. Kuntze) by overexpression of class I chitinase gene from potato (Solanum tuberosum)[J]. Functional & Integrative Genomics, 2015, 15(4): 461-480.
[4] Robinson S P, Jacobs A K, Dry I B. A class IV chitinase is highly expressed in grape berries during ripening[J]. Plant Physiology, 1997, 114(3): 771-778.
[5] Hong J K, Hwang B K. Induction by pathogen, salt and drought of a basic class II chitinase mRNA and its in situ localization in pepper (Capsicum annuum)[J]. Physiologia Plantarum, 2002, 114(4): 549-558.
[6] Yeh S, Moffatt B A, Griffith M, et al. Chitinase genes res-ponsive to cold encode antifreeze proteins in winter ce-reals[J]. Plant Physiology, 2000, 124(3): 1251-1264.
[7] Hermans C, Porco S, Verbruggen N, et al. Chitinase-like protein CTL1 plays a role in altering root system architecture in response to multiple environmental conditions[J]. Plant Physiology, 2010, 152(2): 904-917.
[8] Wu J N, Wang Y M, Kim S T, et al. Characterization of a newly identified rice chitinase-like protein (OsCLP) homo-logous to xylanase inhibitor[J]. BMC Biotechnology, 2013, 13(1): 1-8.
[9] Cletus J, Balasubramanian V, Vashisht D, et al. Transgenic expression of plant chitinases to enhance disease resis-tance[J]. Biotechnology Letters, 2013, 35(11): 1719-1732.
[10] Cao J, Tan X N. comprehensive analysis of the chitinase family genes in tomato (Solanum lycopersicum)[J]. Plants, 2019, 8(3): 52.
[11] Yamagami T, Funatsu G. Identification of the aspartic acid residue located at or near substrate-binding site of rye seed chitinase-C[J]. Bioscience, Biotechnology, and Biochemistry, 1998, 62(2): 383-385.
[12] Taira T, Toma N, Ishihara M. Purification, characterization, and antifungal activity of chitinases from pineapple (Ananas comosus) leaf[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(1): 189-196.
[13] Ali M, Luo D X, Khan A, et al. Classification and genome-wide analysis of chitin-binding proteins gene family in pepper (Capsicum annuum L.) and transcriptional regulation to Phytophthora capsici, abiotic stresses and hormonal applications[J]. International Journal of Molecular Sciences, 2018, 19(8): 2216.
[14] Passarinho P A, De Vries S C. Arabidopsis chitinases: a genomic survey[J]. The Arabidopsis Book, 2002, 1: e0023.
[15] Wan H J, Yuan W, Ruan M Y, et al. Identification of reference genes for reverse transcription quantitative real- time PCR normalization in pepper (Capsicum annuum L.)[J]. Biochemical and Biophysical Research Communications, 2011, 416(1-2): 24-30.
[16] Wu J N, Wang Y M, Kim S G, et al. A secreted chitinase-like protein (OsCLP) supports root growth through calcium signaling in Oryza sativa[J]. Physiologia Plantarum, 2017, 161(2): 273-284.
[17] Aktar Hossain M, Noh H N, Kim K I, et al. Mutation of the chitinase-like protein-encoding AtCTL2 gene enhances lignin accumulation in dark-grown Arabidopsis seedlings[J]. Journal of Plant Physiology, 2010, 167(8): 650-658.
[18] Leung D W M. Involvement of plant chitinase in sexual reproduction of higher plants[J]. Phytochemistry, 1992, 31(6): 1899-1900.
[19] Orvar B L, Sangwan V, Omann F, et al. Early steps in cold sensing by plant cells: the role of actin cytoskeleton and membrane fluidity[J]. Plant Journal, 2000, 23(6): 785-794.
[20] Pearce R. Plant freezing and damage[J]. 2001, 87(4): 417-424.
[21] Haak D C, Fukao T, Grene R, et al. Multilevel regulation of abiotic stress responses in plants[J]. Frontiers in Plant Science, 2017, 8: 1564.
[22] Jaleel C A, Gopi R, Sankar B, et al. Differential responses in water use efficiency in two varieties of Catharanthus roseus under drought stress[J]. Comptes Rendus Biologies, 2008, 331(1): 42-47.
[23] Chen W C, Cui P J, Sun H Y, et al. Comparative effects of salt and alkali stresses on organic acid accumulation and io-nic balance of seabuckthorn (Hippophae rhamnoides L.)[J]. Industrial Crops and Products, 2009, 30(3): 351-358.
[24] Ismail A, Takeda S, Nick P. Life and death under salt stress: same players, different timing[J]. Journal of Experimental Botany, 2014, 65(12): 2963-2979.
[25] El Oirdi M, El Rahman T A, Rigano L, et al. Botrytis cinerea manipulates the antagonistic effects between immune pathways to promote disease development in tomato[J]. Plant Cell, 2011, 23(6): 2405-2421.
[26] Musser R O, Hum-Musser S M, Eichenseer H, et al. Cater-pillar saliva beats plant defences[J]. Nature, 2002, 416(6881): 599-600.
[27] Jiang C, Song J L, Huang R F, et al. Molecular cloning and expression analysis of a class V chitinase gene from popu-lus[J]. Molecular Plant Breeding, 2013, 11(2): 225-231.
[28] Mészáros P, Rybanský Ľ, Spieb N, et al. Plant chitinase responses to different metal-type stresses reveal specificity[J]. Plant Cell Reports, 2014, 33(11): 1789-1799.
[29] Fujita M, Fujita Y, Noutoshi Y, et al. Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks[J]. Current Opinion in Plant Biology, 2006, 9(4): 436-442.
[30] Ma X W, Ma F W, Mi Y F, et al. Morphological and physi-ological responses of two contrasting Malus species to ex-ogenous abscisic acid application[J]. Plant Growth Regula-tion, 2008, 56(1): 77-87.
[31] Liu Y J, Jiang H F, Zhao Z G, et al. Abscisic acid is involved in brassinosteroids-induced chilling tolerance in the suspension cultured cells from Chorispora bungeana[J]. Journal of Plant Physiology, 2011, 168(9): 853-862.
[32] Guo M, Zhai Y F, Lu J P, et al. Characterization of CaHsp70-1, a pepper heat-shock protein gene in response to heat stress and some regulation exogenous substances in Capsicum annuum L.[J]. International Journal of Molecular Sciences, 2014, 15(11): 19741-19759.
責任编辑:黄东杰

