海南万宁槟榔黄叶病毒病发生情况和症状分析
牛晓庆 林兆威 杨德洁 孟秀利 唐庆华 宋薇薇




摘 要:为查明海南省万宁市由槟榔隐症病毒1(Areca palm velarivirus 1, APV1)引起的槟榔黄叶病毒病发生情况,2020年9—11月,对该市13个乡镇(区)的黄化槟榔园进行调查、采样,共采集槟榔叶片1454份。利用RT-PCR技术对所采集样品进行了APV1检测,并对携带病毒的槟榔叶片症状进行归类整理。结果显示,由APV1引起的槟榔病毒病发生普遍,最低检出率为75%,最高检出率最达100%;进一步研究发现,感染APV1的槟榔叶片症状主要有6种类型。本研究结果可为万宁市槟榔病毒病的识别与防控提供依据。
关键词:槟榔;槟榔长线形病毒;调查;症状识别
中图分类号:S435.671 文献标识码:A
Abstract: The objectives of this study is to investigate the occurrence of areca plan leaf yellowing virus disease caused by Areca palm velarivirus 1 (APV1) in Wangning, Hannan, China. During September to November 2020, all betel palm planting areas from 13 towns of Wanning were investigated and a total of 1454 leaf samples were collected and further detected by the RT-PCR method. The results showed that APV1 seemed to be the dominating pathogens affecting betel palm, with a detection rate from 75% to 100%. Meanwhile, the symptoms in betel palm infected by APV1 could be grouped into six different types. The results reported in this study would provide useful insights in the identification, prevention and control of the viral disease of betel palm.
Keywords: Areca catechu L.; Areca palm velarivirus 1; investigation; symptom identification
DOI: 10.3969/j.issn.1000-2561.2021.11.004
槟榔(Areca catechu L.),是多年生常绿乔木,属棕榈科中的槟榔亚科,主要分布于中国、柬埔寨、东非、埃及、印度、马来西亚、阿拉伯半岛等热带和亚热带地区。在中国,槟榔位列“四大南药”之首,具有抗炎症、治疗水肿、脾胃疼痛、驱寄生虫、抗真菌、抑制流行性感冒等效果[1-5],其药用价值在我国已有1000多年的历史。其中,海南槟榔种植面积占全国的95%以上,目前是海南省仅此于橡胶的第二大热带经济作物[6],也是海南省政府重点发展的“三棵树”(橡胶、槟榔、椰子)之一。
海南省万宁市是著名的“中国槟榔之乡”“国家槟榔示范基地”,素有“海南槟榔半万宁”之称,种植面积约占海南省的四分之一。但近些年来,槟榔病虫害问题日趋严重,黄化现象对万宁槟榔产业造成了严重威胁,让广大种植户恐惧、甚至“谈黄色变”。其中槟榔黄化病(yellow leaf disease, YLD)是目前严重影响槟榔生长和产量的一种传染性病害[7-8],病害症状主要表现为初期时中间和下层的叶片开始逐渐变为与绿色部分具有明显界限的黄色,然后开始往上蔓延,最终使得整个植株的叶片变黄、叶片变得硬而短又脆,心叶变小,并且部分出现畸形,最终导致果实和叶片的脱落而死亡[9]。我国海南槟榔黄化病最早发现于1981年海南省的屯昌县境内的槟榔种植园,面积仅6.67 hm2[10],之后随着槟榔种植面积的扩大,槟榔黄化病也随着种植地区而开始蔓延,逐渐引起了人们的重视,罗大全等[11-13]通过巢式PCR和电镜技术鉴定出槟榔黄化病由植原体引起。2015年Yu等[14-15]等在槟榔黄化叶片中通过RNAseq发现了槟榔长线形病毒(Areca palm velarisvirus 1, APV1),并报道了其全长基因组。2020年,Wang等[16]通过对海南省部分市(县)槟榔黄化叶片进行病原检测,确定APV1是槟榔黄化现象的病害因子之一,并在槟榔园中发生流行。为进一步摸清APV1在万宁市槟榔黄化病园的发生情况,本研究团队以万宁为切入点,首次对万宁13个乡镇(区)的槟榔黄化病园的APV1进行检测鉴定,同时对感染APV1的槟榔叶片症状进行了分类统计,摸清由APV1引起的槟榔黄叶病毒病的发生情况,可为该病害的田间诊断和科学防控奠定基础。
1 材料和方法
1.1 材料
1.1.1 采样材料 15 m勾刀、采样袋、大塑料袋、枝剪、记号笔、中性笔、纸巾、写字板、草帽、酒精、蚊香。
1.1.2 主要试剂与仪器 主要试剂:RNAprep Pure多酚多糖植物总RNA提取试剂盒(DP441)、反转录cDNA第一鏈合成试剂盒(MR05101M)、2×Taq PCR mix购于天根生化科技(北京)有限公司。主要仪器:Bio-Rad T100 PCR仪器、干式恒温器(DTH-100)、凝胶电泳仪,高速低温组织研磨仪(KZ-III-F),全球定位系统(GPS)。
1.2 方法
1.2.1 采样方法 采用随机法[17],对万宁市兴隆区、南桥镇、三更罗镇、万城镇、后安镇、和乐镇、龙滚镇、长丰镇、北大镇等13个乡镇(区),共计149个村委会(农场)的黄化病园疑似样品进行采样。使用酒精擦拭后的勾刀取发病园槟榔叶片1~2个裂叶,放于自封袋内,标记时间、地点、编号,并做GPS记录,当天采样当天送回,用于室内病毒病检测。
1.2.2 样品处理 剪取槟榔黄化叶片样品,称取0.1 g,大小为2 mm×5 mm的若干小块,于无酶无菌处理的1.5 mL离心管中,每管放3粒直径3 mm的无酶无菌钢珠,做好标记,按顺序置于24孔或48孔研磨钢槽中,迅速置于–80 ℃冰箱冻存备用。
1.2.3 RNA提取及反转录cDNA合成 利用RNAprep Pure多酚多糖植物总RNA提取试剂盒,参照说明书,提取样品总RNA,并利用反转录cDNA第一链合成试剂盒,将提取的总RNA进行反转录,获得cDNA,–20 ℃保存备用。
1.2.4 RT-PCR检测 利用Wang等[16]设计的5对APV1的鉴定引物(表1),对所采集槟榔疑似样品进行PCR检测。本实验先对5对引物进行扩增效率测定,然后用测定的最佳引物先进行疑似样品扩增。反应扩增体系:cDNA模板2.0 μL、Taq PCR mix预混液17 μL、上下游引物各0.5 μL。扩增条件:95 ℃预变性4 min;95 ℃变性15 s;退火时间30 s;72 ℃延伸1 min。反应结束后,取5 μL反应产物,用于琼脂糖凝胶电泳,检测扩增片段的大小。对扩增产物凝胶电泳,随机选取阳性扩增PCR产物,送往生工生物工程(上海)股份有限公司进行测序。
1.2.5 APV1检出率统计及黄化症状归类 将1.2.1和1.2.2采集和处理的槟榔叶片样品,进行APV1检测。按下列公式计算病毒检出率:R= n/N×100%。式中,R为病毒检出率,n为阳性样品数,N为检测样品总数。
对采集的样品,在剪取之前,根据采样时间、地点和编号进行拍照留底,再将检出阳性的样品对照编号进行症状区分和归类整理,总结出检测到APV1的槟榔叶片症状类型。
2 结果与分析
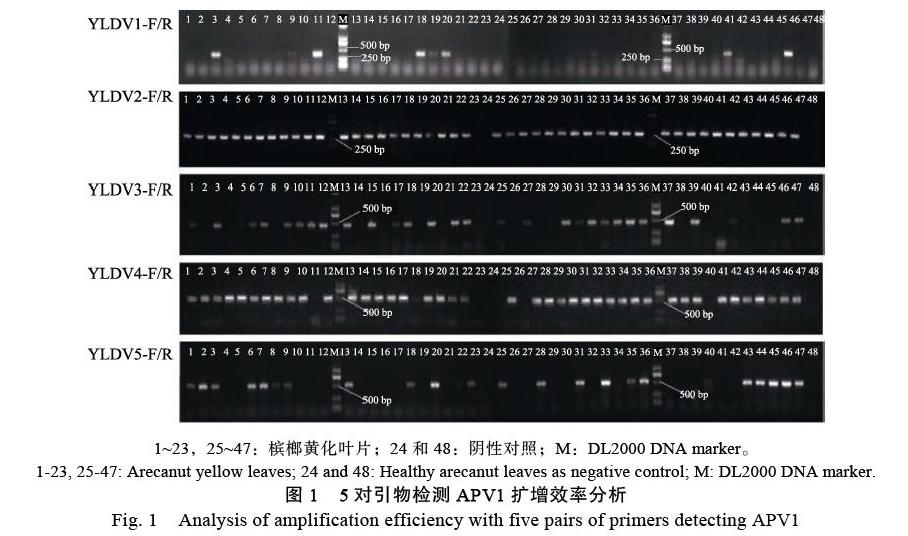
2.1 对引物进行扩增效率分析
如图1所示,泳道“24”“48”阴性对照无污染,比较各引物对的扩增效率,其中较好的为YLDV2-F/YLDV2-R和YLDV4-F/YLDV4-R,扩增效率最差的为YLDV1-F/YLDV1-R和YLDV5- F/YLDV5-R,其次是YLDV3-F/YLDV3-R。由图中显示,泳道“23”中,仅YLDV5-F/YLDV5-R扩出,说明5对引物扩增效率表现出一定的差异。对YLDV5-F/YLDV5-R扩出的泳道“23”中样品和5对引物中随机选择4个带有目的条带的样品送测序,将测序结果在NCBI中BLASTn比对,比对结果显示,检测样品均为APV1。由于YLDV4-F/YLDV4-R长度为500 bp,扩增片段比YLDV2-F/YLDV2-R长,表现更多的遗传信息和扩增效率,因此优先使用YLDV4-F/YLDV4-R作为应用引物,对未扩增出的样品使用YLDV2- F/YLDV2-R和YLDV5-F/YLDV5-R检测。
2.2 病毒檢出率统计
本次调查共采集成龄槟榔叶片样品1454份(每株树采集1份样品)、槟榔苗圃叶片140份。样品的检测结果统计见表2,其中兴隆区、长丰镇、东奥镇共264份样品,APV1检出率为100.00%;南桥镇、礼纪镇、三更罗镇共351份槟榔叶片,APV1平均检出率为96.04%;其余镇的病毒检出率均在80%以上,和乐镇最低,60份样品的检出率为75%,其次是山根镇,检出率为78.79%;1454份槟榔叶片样品中,共检出病毒样品1297份,检出率为89.20%(表2)。通过对万宁各乡镇APV1检出率的统计,更直观展现APV1在万宁槟榔上的发生危害情况(图2)。此次调研中,也对万宁部分槟榔苗圃进行了病毒检测,共检测了1龄苗、2龄苗共28份,有17份带毒,检出率达60%。
2.3 APV1的槟榔叶片症状
对采集的1454份疑似样品进行APV1检测,通过检测结果并对比采集的照片,将感染APV1的黄化症状进行归类。与健康槟榔叶片对比发现,槟榔黄化叶片类型主要有以下几种:不均匀黄化、黄绿相间、叶肉与叶脉黄化或叶脉黄化、叶尖表现黄化、斑驳黄化(图3),均为田间黄化常见症状,槟榔黄化病园里的这些症状均可检测到APV1。
3 讨论
槟榔黄化病是严重威胁槟榔产业健康发展的一种传染性病害[18]。槟榔黄化病逐年加重,轻者减产10%~20%,重者减产50%~60%,局部地区造成毁种失收,给海南槟榔种植户带来了巨大的经济损失,严重影响海南农村经济的发展。一些学者[9-13]通过巢式PCR、电镜技术检测鉴定认为槟榔黄化病主要由植原体引起。虽然相对于植原体引起的黄化而言,APV1是新发现的病原,但也有学者发现该病毒与槟榔黄化病的发生与流行密切相关[16],本调查研究结果与其观点一致;本调研结果同时表明万宁市槟榔黄叶病毒病危害严重,发生率高、发生面积广,遍及万宁各乡镇(区),在所有的病原采集点都能检测到APV1。本文在黄化病园采集的13个乡镇(区)共1454份黄化类型叶片中,APV1检出率最高达100%,最低也有75%,平均检出率为89.2%,这些数据表明,APV1可能是引起槟榔黄化的主要病毒之一。但依然需要完成柯赫氏法则来进一步证实这一论断,因病毒很难体外活体培养,难以进行遗传操作,且APV1传播媒介饲养条件不完善,可通过构建侵染性克隆的方法进行验证和开展相关功能基因的研究[19-21]。
至于该病毒何时开始在海南省槟榔上发生,发生之后如何传播扩散,发生扩散期间是否发生适应性进化?这些重要科学问题目前均未得到解析。本文在槟榔苗圃中也检测到带有该病毒,可见槟榔苗期就可以携带APV1,很可能在生长至一定结果年限,才影响了槟榔长势和产量及外在表现,也可能在结果期染病,从小苗带毒到影响结果需要多长时间,还需要进一步研究验证。总之,APV1的研究仍处于初始阶段,其传播媒介不清楚,传播机理尚不明确,发生规律也无相关报道。众所周知,大约80%的植物病毒依赖昆虫介体进行传播[22-23]。虫媒病害的发生与流行和介体昆虫的活动密不可分,“病毒-昆虫-植物”三者互作决定了病虫害的流行发生和严重程度[24]。由昆虫传播的植物病毒病每年造成的作物损失达几十亿美元,其中飞虱、蚜虫、木虱、粉虱、叶蝉、蜡禅和蓟马等昆虫是植物病毒病的主要传播介体[25],因此,切断昆虫介体传播途径,是控制植物病毒病最行之有效的方法;其次是种植健康槟榔苗,检测到长线形病毒的槟榔苗圃,应谨慎销售,随着科技的蓬勃发展,槟榔脱毒苗有望占领市场;槟榔种果是否带毒,目前尚无报道,还处于研究阶段,但是仍应该选择健康槟榔园制种,并建立隔离苗圃,以绝后患。
因为APV1是新发现的引起槟榔黄化的病原,有必要摸清其危害症状。本文检测观察发现,该病毒病的症状并不单一,即出现了同一病毒引起不同症状的现象,除与报道的植原体病害症状[11, 15]有相似之处外,也有其他症状,比如槟榔叶尖黄化、主脉及叶肉黄化、叶脉黄化、水渍状暗绿点黄化、叶脉两侧不规则褪绿似橡皮擦过状等。说明病毒病症状的复杂性,病毒与症状之间的相互关联并不是绝对的,症状可以改变,而且很大程度上取决于寄主植物及感病时间的长短、病毒种类和环境条件等[26]。而且病毒症状的发展有个过程,有些植物病毒侵染植物后,前期症状和后期症状可能完全相同,也可能完全不同,且整个发展过程没有明显的界限。例如烟草花叶病毒(TMV)感染的普通烟,最初叶片出现明脉症,一两天后很快发展成斑驳症,再过几天就发展成典型的花叶症,花叶症又可从轻花叶发展成重花叶[27]。6种检测到APV1的叶片症状中,在健康的2龄槟榔园发现有斑驳似西瓜皮样症状,但没有检测到APV1,说明这种症状叶片本身不携带该病毒,此种症状可能是缺素或者其他病因引起;而在成龄发病槟榔园里的斑驳黄化能检测到APV1,说明斑驳是在APV1侵染之前就存在,只是因APV1侵染,叶片变得发黄。而且在槟榔黄化园里,有些健康叶片中也检测到了APV1,说明该病毒具有隐症属性。然而由APV1引起的槟榔叶片症状是如何发展变化的,还需要进一步深入研究。
本文首次报道了海南万宁由APV1引起的槟榔黄叶病毒病的发生情况和症状识别,明确了万宁APV1的发生危害现状。后续将从时间和空间尺度上对APV1的发生和流行等重要进程进行量化分析,推断APV1的最近共祖时间及起源点,并探明非生物的地理因素对该病毒适应性进化的影响,进一步阐明APV1的分子流行规律,为制定其防控策略、阻断该病毒的流行提供理论依据,也可为其他病毒病原的相关研究提供重要的参考。
参考文献
[1] Peng W, Liu Y J, Wu N, et a1. Areca catechu L. (Arecaceae): A review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. Journal of Ethnopharmacology, 2015, 164: 340-356.
[2] Dar A, Khatoon S. Behavioral and biochemical studies of dichloromethane fraction from the Areca catechu nut[J]. Pharmacology Biochemistry and Behavior, 2000, 65(1): 1-6.
[3] Khan S, Mehmood M H, Ali A, et a1. Studies on anti- in-flammatory and analgesic activities of betel nut in rodents[J]. Journal of Ethnopharmacology, 2011, 135(3): 654-661.
[4] Si E L, Hwang H J, Ha J S, et a1. Screening of medicinal plant extracts for antioxidant activity[J]. Life sciences, 2003, 73(2): 167-179.
[5] Pithayanukul P, Nithitanakool S, Ba vovada R. Hepatopro-tective potential of extracts from seeds of Areca catechu and nutgalls of quercus infectoria[J]. Molecules, 2009, 14(12): 4987-5000.
[6] 傅琪彥, 符秀娟, 林丽珍, 等. 海南省槟榔产业发展现状及对策[J]. 乡村科技,2021(3): 27-32.
[7] Norton S A. Betel: Consumption and consequences[J]. Journal of the American academy of dermatology, 1998, 38(1): 81-88.
[8] Rawther T S. Yellow leaf disease of arecanut: Symptoma-tology, bacterial and pathological studies[J]. Arecanut and Spices Bull, 1976, 8: 22-24.
[9] Ding X, Tang Q, Jing Y, et al. Current pest status and key problems in areca nut palm industry in China[J]. Chinese agricultural science bull, 2014, 30(7): 246-253.
[10] 罗大全. 槟榔黄化病的发生现状[J]. 世界热带农业信息, 2007(6): 24-26.
[11] 罗大全, 陈慕容, 叶沙冰, 等. 海南槟榔黄化病的病原鉴定研究[J]. 热带作物学报, 2001, 22(2): 43-46.
[12] 车海彦, 吴翠婷, 符瑞益, 等. 海南槟榔黄化病病原物的分子鉴定[J]. 热带作物学报, 2010, 31(1): 83-87.
[13] 周亚奎, 甘炳春, 张 争, 等. 利用巢式PCR 对海南槟榔(Areca catechu L.)黄化病的初步检测[J]. 中国农学通报, 2010, 26(22): 381-384.
[14] Yu H, Qi S, Chang Z, et al. Complete genome sequence of a novel velarivirus infecting areca palm in China[J]. Archives of virology, 2015, 160(9): 2367-2370.
[15] 于红美. 基于病毒宏基因组学的病原体鉴定及分析[D]. 合肥: 中国科学技术大学, 2015.
[16] Wang H, Zhao R, Zhang H, et al. Prevalence of yellow disease (YLD) and its associated Areca palm velarivirus 1 (APV1) in betel palm (Areca catechu) plantations in Hainan, China[J]. Plant Disease, 2020, 104: 2556-2562.
[17] 张孝羲, 张跃进. 农作物有害生物预测学[M]. 北京: 中国农业出版社, 2006: 11-26.
[18] 郑世玲. 中国小麦花叶病毒侵染性克隆构建及运动蛋白的功能分析[D]. 杭州: 浙江大学, 2012.
[19] Rawther T S S. Yellow leaf disease of arecanut: Symptoma-tology, bacterial and pathological studies[J]. Arecanut and Spices Bull, 1976, 8: 22-24.
[20] Agüero, Ruiz-Ruiz S, Vives M, et al. Development of viral vectors based on Citrus leaf blotch virus to express foreign proteins or analyze gene function in citrus plants[J]. Mole-cular Plant Microbe Interactiond,2012, 25(10): 1326-1337.
[21] 张 洁. 福建省两种双生病毒的致病机制研究[D]. 福州: 福建农林大学, 2009.
[22] Hohn T. Plant virus transmission from the insect point of view[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(46): 17905- 17906.
[23] 施 艷, 王英志, 汤清波, 等. 昆虫介体行为与植物病毒的传播[J]. 应用昆虫学报, 2013, 50(6): 1719-1725.
[24] 马永焕. 新型双生病毒-烟粉虱-植物三者互作关系的鉴定与机制研究[D]. 北京: 中国科学院大学, 2017.
[25] 何海芳, 李静静, 张泽龙, 等. 我国植物病毒病及其昆虫介体研究概况[J]. 华中昆虫研究, 2020, 16: 3-21.
[26] 谢联辉. 植物病原病毒学[M]. 北京: 中国农业出版社, 2007: 244-246.
[27] 谢联辉, 林奇英. 植物病毒学[M]. 2版. 北京: 中国农业出版社, 2004: 106-117.
责任编辑:谢龙莲

