miR-802靶向STAT6对卵巢癌细胞增殖、凋亡、侵袭及迁移的影响
刘佳淑 范 波 黄 锦
川北医学院附属医院(南充,637000)
卵巢癌因发病隐匿、易于转移等特点是其发现晚、死亡率高的原因之一[1]。筛选卵巢癌诊断和治疗靶点为临床关注。miR-802能够调控不同的靶基因在卵巢癌细胞[2]、宫颈癌细胞[3]及胃癌细胞[4]等发挥抑癌因子作用。信号转导与转录激活因子6(STAT6)属STAT家族,在多种肿瘤中发挥促癌因子作用[5-6]。目前miR-802可否调控STAT6参与卵巢癌发生发展有待探究。因此,本研究初步探讨miR-802靶向STAT6对卵巢癌增殖、凋亡、侵袭及迁移的影响。
1 材料与方法
1.1 临床资料
收集2016年7月-2019年7月在本院行手术治疗并经病理证实的卵巢癌患者63例癌组织标本及其癌旁组织(距肿瘤边缘>5 cm)标本。患者年龄(57.4±9.3)岁(39~75岁)。根据相关分期标准[7],I期、Ⅱ期35例,Ⅲ期、Ⅳ期28例。所有患者均知情同意,本研究经本院伦理委员会批准。
1.2主要试剂
人卵巢表面上皮细胞HOSE以及卵巢癌细胞SKOV-3、A2780、HO8910购买自通派(上海)生物科技有限公司。胎牛血清、RPMI-1640基础培养基购于Gibco公司。miR-802 mimic、mimic NC购于广州市锐博生物科技有限公司。Transwell试剂盒购买自北京索莱宝科技有限公司,CCK8试剂盒购买自北京英格恩生物有限公司。Trizol、TransScript II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal)购自北京全式金公司;兔抗人STAT6单克隆抗体、兔抗人Ki-67单克隆抗体、兔抗人MMP-2单克隆抗体和兔抗人Bax单克隆抗体及HRP标记的兔二抗购于艾博抗(上海)贸易有限公司。荧光素酶报告基因检测试剂盒购于美国普洛麦格公司。LipofectamineTM2000购自美国Thermo Fisher公司。引物购买于赛默飞世尔科技公司。
1.3 RT-qPCR检测
按照Trizol说明书提取miR-802和STAT6 mRNA,按照TransScript II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)说明书检测miR-802和STAT6 mRNA表达,以内参基因U6和β-actin,2-△△Ct方法进行相对定量分析,重复实验3次。引物序列见表1。

表1 RT-qPCR所用引物序列
1.4 细胞转染
将细胞接种于6孔培养板中转染,分为miR-802 mimic组、mimic NC组、对照组。其中miR-802 mimic组、②mimic NC组细胞中加入LipofiectamineTM2000转染试剂及对应质粒,对照组不做任何处理。转染12 h后收集各组细胞进行转染效率测定,3组重复。
1.5 CCK8实验
检测3组细胞增殖。根据CCK8试剂盒制作标注曲线。96孔接种细胞悬浮液,100 ml/孔,每组3孔, 37℃ 5% CO2培养箱培养,培养时间为12 h、24 h、48 h、72 h,分别加入CCK8测定OD值。每孔加入10 ml CCK8溶液,培养箱中孵育2 h后用酶标仪在450 nm处测定吸光度,3组平行重复。
1.6 Transwell
检测3组细胞迁移和侵袭。Matrigel胶 4℃融化过夜,用预冷的无血清培养基按1:3体积稀释,往Transwell小室中加入稀释后的Matrigel 40 ml,37℃培养箱孵育2 h。调整细胞悬液浓度1×104个/ml,上室加200 ml细胞悬液,下室加含300ml含10% FBS的完全培养基,每组共计3个重复。37℃ 5% CO2培养24 h后取出小室,磷酸盐缓冲液(PBS)清洗小室2次。固定液(甲醇:冰乙酸=3:1)固定30 min后PBS再清洗2次。结晶紫染色30 min,清水洗涤,风干,拍照,计数下室细胞数。
1.7 流式细胞仪
检测3组细胞凋亡。细胞接种于6孔板,分组同上,每组3孔。每组孔细胞中加入等量无水乙醇,继续于CO2培养中培养24 h。消化、固定细胞后,PBS缓冲液冲洗2遍后用预冷的75%乙醇固定过夜。1000 r/min离心5 min后,弃上清液,PBS缓冲液冲洗2遍,加入50ml的RNAse后室温避光30 min以除去细胞内RNA。1000 r/min离心5 min,去上清,PBS缓冲液清洗2遍,加入60 ml PI,室温避光30 min后用50 目无菌过滤网过滤,上机检测。
1.8 双荧光素酶实验
构建野生型(WT-STAT6)和突变型(MUT-STAT6)的STAT6 3'-UTR双荧光报告质粒。将对数生长期的SKOV-3细胞以每孔105个接种至12孔细胞板上(重复3组),将WT-STAT6、MUT-STAT6与miR-802 mimic和mimic NC阴性对照共按照LipofectamineTM2000说明书步骤转染至miR-802 mimic和mimic NC阴性对照组,每组实验设置3个重复。培养箱内培养48 h后,参照双荧光素酶报告基因检测试剂盒步骤检测荧光素酶活性。
1.9 Western blot检测
各组细胞STAT6、Ki-67、MMP-2和Bax蛋白水平。取对数期增长的3组细胞(平行重复3组),预冷PBS清洗2次后加入细胞裂解液,冰上裂解30 min,4℃ 10000 r/min离心20 min,取上清采用BCA试剂盒测定蛋白含量。取35 ml蛋白液进行SDS-PAGE垂直电泳,电转PVDF膜,2%BSA封闭过夜。用缓冲液清洗封闭液后,加入一抗4℃过夜(STAT6、Ki-67、Bax稀释度为1:1000,MMP-2稀释度为1:500,GAPDH稀释度为1:10000)。洗涤后,加入二抗(HRP标记的兔二抗的稀释度为1:10000),室温孵育1 h。ECL曝光成像,最后采用Alpha Imager HP 凝胶成像系统分析结果。
1.10 统计学方法
2 结果
2.1 miR-802表达水平
卵巢癌组织中miR-802表达水平(0.51±0.18)低于癌旁组织(1.49±0.22)(t=27.669,P=0.000);与人卵巢上皮细胞HOSE相比(1.00±0.06),miR-802表达水平在SKOV-3(0.22±0.04)、A2780(0.45±0.07)、HO8910(0.56±0.10)中均下降(F=68.693,P<0.05),SKOV-3表达量最低选取用于后续实验。
2.2 miR-802低表达与卵巢癌患者临床参数关系
以miR-802表达水平≥0.51为高表达组,<0.51为低表达组。miR-802低表达与患者的年龄、分化程度因素无关,而与FIGO分期和淋巴结转移有关(P<0.05)。FIGO分期为Ⅲ期+Ⅳ期、有淋巴结转移患者miR-802的表达水平低于FIGO分期为Ⅰ期+Ⅱ期、无淋巴结转移患者(P<0.05)。见表2。

表2 卵巢癌患者miR-802不同表达水平与临床参数关系[例(%)]
2.3 SKOV-3细胞miR-802转染效率
在SKOV-3细胞中分别转染miR-802 mimic、mimic NC,转染后miR-802表达水平miR-802 mimic组(9.12±0.44)高于mimic NC组(1.09±0.12)(F=939.060,P=0.000),且高于对照组(1.00±0.07)(P<0.05)。
2.4 miR-802对细胞增殖能力的影响
与对照组和mimic NC组比,miR-802 mimic组细胞增殖能力受到抑制(P<0.05),ki-67蛋白表达水平下降(P<0.05),见表3、图1(1777页)。

表3 各组不同时点细胞增殖和ki-67蛋白表达水平
2.5 miR-802对细胞迁移和侵袭的影响
与对照组和mimic NC组相比,miR-802 mimic组细胞迁移和侵袭能力减弱(P<0.05)(图2,1777页)、(表4)MMP-2蛋白表达水平下降(均P<0.05)(图3,1777页)。

表4 各组细胞迁移、侵袭和MMP-2蛋白表达水平
2.6 miR-802对卵巢癌细胞凋亡的影响与对照组和mimic NC组比,miR-802 mimic组细胞凋亡率增加(P<0.05)(图4,1778页)(表5),Bax蛋白表达水平升高(P<0.05)(图5,1778页)。

表5 各组细胞凋亡率和Bax蛋白表达
2.7 STAT6为miR-802靶基因
通过软件预测可知miR-802与STAT6存在结合位点(图6,1778页)。双荧光素酶实验证实miR-802能够显著降低野生型STAT6 3’UTR荧光素酶活性,对突变型STAT6 3’UTR荧光素酶活性无影响(表6)。RT-qPCR和western-blot结果显示:与对照组和mimic NC组比,miR-802 mimic组STAT6 mRNA和蛋白表达下降(P<0.05)(图7,1778页)(表7)。

表6 两组双荧光素酶活性比较
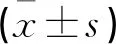
表7 各组STAT6 mRNA和蛋白表达比较
3 讨论
卵巢癌为妇科恶性肿瘤的第二位[8]。卵巢癌细胞的增殖能力强,凋亡率低且迁移能力强,易转移,是卵巢癌病情恶化、病情易复发的原因之一[1]。miRNA可通过与靶基因结合改变mRNA的稳定性,进而调控下游靶基因表达。研究发现,恶性肿瘤中存有多种miRNA异常表达现象,且与肿瘤细胞的增殖、分化、迁移和侵袭及凋亡等关系密切[9]。miR-802与多种肿瘤的发生有关,如Yuan等[10]研究发现miR-802通过下调叉头框-Ml(FoxMl)抑制乳腺癌增殖;李海朋等[11]研究表明miR-802通过介导其靶基因c-ros癌基因1(ROS1)抑制口腔鳞状癌的发生发展;Wu等[12]研究发现miR-802通过调节通用转录因子3(BTF3)抑制宫颈癌上皮-间质转化、迁移和侵袭。
为了解miR-802是否参与卵巢癌的发生发展,本研究检测了卵巢癌组织及癌旁组织miR-802表达水平,结果发现与癌旁组织比,卵巢癌组织中miR-802表达水平下降,且miR-802低表达与患者FIGO分期和淋巴结转移有关。体外细胞实验结果发现,相较于人卵巢上皮细胞HOSE细胞,人卵巢癌细胞系中miR-802的表达降低,其中SKOV-3表达量最低。因此,本研究以SKOV-3卵巢癌细胞为研究对象,建立了miR-802过表达细胞模型,结果发现卵巢癌细胞中过表达miR-802抑制细胞增殖、迁移和侵袭并促进细胞凋亡。与Yang等[2]研究结果相似,提示miR-802在卵巢癌中发挥抑癌作用。
STAT6是STAT家族中的重要一员,因其对孤立性纤维性肿瘤/血管周细胞瘤有特异性诊断价值而被认识。近年发现,在结肠癌、乳腺癌、胰腺癌中均可见STAT6表达升高,高表达STAT在细胞核中与特定的DNA结合相互作用,从而调节增殖(ki-67),侵袭增殖(MMP-2)以及凋亡(Bax)相关基因的转录,从而促进肿瘤细胞发生发展[13-15]。在卵巢癌中,三螺旋重复胶原蛋白1(CTHRC1)可通过激活调控STAT6信号通路促进肿瘤相关巨噬细胞发生M2极化[16]。过表达八聚体结合转录因子4(OCT4)可上调JAK1和STAT6的磷酸化水平,从而促进卵巢癌发生[17]。提示STAT6在卵巢癌中发挥促癌作用。本研究通过生物信息学网站预测到miR-802可以与STAT6的3’UTR区互补结合,且发现与对照组和mimic NC组比,miR-802 mimic组miR-802表达增高,STAT6 mRNA和蛋白表达水平下降,推测在卵巢癌中miR-802对STAT6具有靶向调控作用。本研究应用双荧光素酶实验验证了STAT6是miR-802的靶点,提示miR-802靶向调控STAT6参与卵巢癌发生发展。该结论与Ma等[18]和Wang等[19]研究结果相一致,提示特异性miRNA沉默STAT6可显著抑制肿瘤的增殖、生长并诱导凋亡。
综上所述,miR-802可通过靶向STAT6起到抑制卵巢癌细胞增殖、迁移、侵袭及促凋亡的作用,miR-802有望成为卵巢癌诊断和治疗的新靶点。

