百会、足三里穴电针预处理对脑缺血/再灌注大鼠脑、肠炎性因子的影响
张继瑶,唐 强,朱路文*
1 黑龙江中医药大学,黑龙江哈尔滨 150040;
2 黑龙江中医药大学附属第二医院,黑龙江哈尔滨150001
随着社会的不断进步,生活节奏的不断加快,我国脑卒中发病率呈上升态势。研究显示,2017 年我国脑血管病在农村人群疾病死亡比例中占23.18%,在城市人群疾病死亡比例中占20.52%[1]。其中,缺血性脑卒中(ischemic stroke,IS)具有高发病率、高致死率、高致残率、高复发率及并发症多的“四高一多”特点,严重威胁人类健康,给家庭和社会带来巨大负担。目前针对IS 最有效的治疗手段是恢复缺血脑组织的血氧供应,但其引发的脑缺血再灌注损伤可导致更加严重的脑功能障碍发生,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[2]。CIRI 不可逆且病理机制复杂,涉及炎症反应、钙超载、神经元兴奋性氨基酸毒性增强、细胞凋亡、氧自由基损伤等多种途径,目前临床上无特效药物治疗[3-4]。因此,如何预防CIRI 的发生至关重要。“圣人不治已病治未病,不治已乱治未乱”的“治未病”理念对脑卒中预防及治疗具有重要指导意义[5]。针灸可激发人体经络之气,增强其抗邪与应变能力,通过调节体质,促进健康,减轻相关疾病损害的程度,甚至预防疾病的发生[6]。研究表明,针刺治疗IS可扩张脑血管,有效增加脑卒中患者缺血区脑部血流量,改善患者脑组织氧和能量代谢,促进其病后脑功能重塑[7]。电针(electroacupuncture,EA)具有针灸和电疗的双重优点。研究显示,在脑缺血前给予多次重复的电针预处理,诱导脑缺血耐受,可减轻缺血、缺氧所引发的脑组织损伤[8]。但电针治疗脑缺血再灌注损伤机制复杂,目前尚未形成统一共识。研究指出电针预处理防治CIRI 可能涉及多通路、多靶点,如改善脑细胞能量代谢、抑制兴奋性氨基酸分泌、降低Ca2+超载损伤、调控氧化应激反应、缓解炎性反应、调控血脑屏障及脑水肿、调控细胞自噬等[9-10]。根据中医脑肠同治的理论,脑为髓海,元神之府,缺血性中风发生后,神机失用,大肠失司,百会穴为头部各经脉之气汇聚处,针刺可醒脑安神、平肝熄风,足三里穴为足阳明胃经合穴,针刺可合治六腑、健脾和胃、扶正培元。临床防治脑缺血及脑缺血再灌注损伤常选择百会穴、足三里穴[11-13]。本研究选择百会穴、足三里穴电针预处理干预CIRI 大鼠,探讨EA 预处理对脑缺血/再灌注大鼠前肢抓握力量和脑、肠、外周血中白细胞介素(in⁃terleukin,IL)-17A、IL-10 表达的影响,探讨电针预处理的脑-肠保护作用机制,以期为EA 预处理防治脑缺血/再灌注损伤提供理论依据。
1 材料和方法
1.1 实验动物
选择SPF级雄性Sprague-Dawley大鼠36只,8~10周龄,体质量220~240 g,采购自辽宁长生生物技术有限公司,合格证号SCXK(辽)2015-0001。SPF级饲养条件:动物自由食水,温度23~25 ℃,湿度60%~70%,人工光照12 h∶12 h 明暗交替(7∶00~19∶00照明),通风良好,噪音<60 dB,每2~3 d 更换一次垫料,定期清洁鼠笼和饮水器。本实验的操作流程遵循2006年科技部发布的《关于善待实验动物的指导性意见》以及小动物伦理与保护的相关规定。
1.2 主要实验试剂与设备
4%多聚甲醛溶液(安徽雷根生物技术有限公司);二甲苯(天津市富宇精细化工有限公司);苏木素(Biosharp)、1%盐酸乙醇分化液(安徽雷根生物技术有限公司);Rabbit Anti-IL-17 Polyclonal Anti⁃body(北京博奥森生物技术有限公司);IL-10 Poly⁃clonal antibody(武汉三鹰生物技术有限公司);RIPA裂解液、Bradford 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);大鼠IL-17A ELI⁃SA试剂盒、大鼠IL-10 ELISA试剂盒(江苏酶免实业有限公司);一次性使用无菌针灸针(苏州医疗用品厂有限公司);G6805-2A 型低频电子脉冲治疗仪(上海华谊医用仪器有限公司);YP5002型电子天平(常州市衡正电子仪器有限公司);D1008E型掌上离心机(SCILOGEX)、Multiskan FC 型酶标仪(Thermo Fisher Scientific)、ChemiDocTMMP Imaging System、小型垂直电泳转印系统(Bio-Rad)、Excelsior AS 组织处理机(Thermo Fisher Scientific)、YDS-35 型液氮容器(乐山市东亚机电工贸有限公司);Eppendorf移液器(德国Eppendorf公司)。
1.3 实验方法
1.3.1实验分组 将36 只大鼠编号,采用Excel 生成随机数字表(1~12),任意选择随机数字表中1个数为起始点对应大鼠编号1,从左至右,自上而下分别对应1~36 号大鼠。用随机数字除以3 所得余数确定每只大鼠的分组,余数0、1、2 分别对应假手术组(S-con 组)、模型组(M-con 组)和电针组(EP 组),每组12只。
1.3.2模型制备 模型制备前12 h 大鼠禁食不禁水。模型制备过程中所涉及的手术器材及用作线拴的鱼线(直径0.26 mm)均进行高压灭菌处理或75%酒精浸泡消毒,头端1 mm 做过蜡处理,从过蜡端算起,在鱼线18~22 mm 处用防褪色marker 笔做好标记。除S-con 组外,M-con 组、EP 组参照KOI⁃ZUMI 等[14]线拴法加以改良,制备大鼠右侧大脑中动脉阻塞(middle cerebral artery occlusion/reperfu⁃sion,MCAO/R)模型,在颈总动脉中插入头端过蜡的鱼线至大脑中动脉起始端,缺血120 min 后拉出栓线尾端恢复灌注。模型制备过程中若出现制备不成功或者大鼠死亡随即剔除,另选大鼠补充,确保每组12只。
1.3.3干预方法
1.3.3.1S-con组S-con组按类似MCAO/R模型制备方法操作,但不结扎颈总动脉和颈内动脉,不插入线拴,即不阻断脑血流和再灌注。
1.3.3.2M-con组M-con组按MCAO/R模型制备方法操作,120 min后拔线恢复脑血流灌注。
1.3.3.3EP组参考《实验动物图谱》[15]穴位定位,选取大鼠百会穴、患侧足三里穴,采用针灸针(苏州医疗用品厂有限公司,规格:0.25 mm×13 mm)进行电针预处理。于百会穴由前向后平刺约3 mm,足三里穴直刺6 mm,连接低频电子脉冲治疗仪(上海华谊医用仪器有限公司,G6805-2A 型),正极接百会穴,负极接足三里穴,选取疏密波,2/15 Hz,1 mA,以大鼠下肢轻微震颤为度,连续刺激30 min,1 次/d,每周连续干预6 d后休息1 d,共干预2周。最后1次电针干预24 h后大鼠接受MCAO/R模型制作,120 min后拔线恢复脑血流灌注。
1.4 观察指标
1.4.1前肢抓握力量 于术前1 d,再灌注12 h,再灌注1、3、7 d 采用大小鼠抓力测定仪(济南益延科技发展有限公司,YLS-13A 型)对各组大鼠的前肢抓握力量进行测定。测试者1只手提起待测定大鼠的尾部,将其置于抓力仪测定区域,当测试者向后拉大鼠尾部时,大鼠试图抓紧抓力测定仪横杆以免从横杆脱落,这时测试者继续向后拖拽大鼠,直至其滑脱,同时测定仪显示出大鼠此次的前肢抓握力量,每只大鼠测试2次,取最大值作为最后数据。
1.4.2IL-17A、IL-10 含量 再灌注7 d 后,各组随机选取6 只大鼠麻醉后,用一次性采血针和采血管快速抽取1.5 mL腹主动脉血,室温下静置30 min,于离心机上离心(4 000 r/min,10 min,-4 ℃),取上层血清,用于测定IL-17A、IL-10 的含量。将ELISA 试剂盒从冷藏环境中拿到室温平衡15~30 min;将原倍标准品用稀释液配置成5 个不同浓度的标准品;加样后将酶标板置于37 ℃培养箱中温育30 min;手工洗板完成后每孔加酶标试剂50 μL;再次温育和手工洗板;每孔加入显色试剂A、B,各50 μL,显色10 min;终止后在酶标仪450 nm下测定各孔的吸光度。
1.4.3IL-17A、IL-10 蛋白表达 再灌注7 d 后,各组随机选取6 只大鼠抽取腹主动脉血后,取缺血侧脑组织和结肠组织,采用Western blot检测缺血侧皮层和结肠组织中IL-17A、IL-10蛋白的表达。在每个样本(约0.05 g)内加入相应体积的裂解液(约500 μL),冰上充分研磨(5 min);离心,取上清液,进行蛋白定量;制备聚丙烯酰胺凝胶及蛋白上样液,组装电泳装置开始电泳;经转膜、封闭、洗膜,孵育一抗、二抗、ECL 底物发光后用ChemiDocTMMP Imaging Sys⁃tem将聚偏氟乙烯(Poly vinylidene fluoride,PVDF)膜进行暗室曝光及扫描胶片,分析目标条带光密度值。
1.4.4IL-17A、IL-10 平均光密度值 再灌注7 d后,将各组剩余的6只大鼠麻醉后,从心尖快速灌注20 mL 生理盐水,然后继续灌注10 mL 的4%多聚甲醛磷酸盐缓冲液。大鼠躯干发硬后,断头取缺血侧脑组织,并剪取一定长度的结肠组织,放入4%多聚甲醛溶液中4 ℃冰箱过夜。次日将脑组织和结肠组织取出,以视交叉处为切开点将脑组织行冠状切开,向后取约6 mm,另取回盲瓣以上的肠段2 cm,进行常规石蜡包埋。采用免疫组化法检测IL-17A、IL-10 的表达。将组织修块、脱水、透明、透蜡处理和常规石蜡包埋;切片后烤片,脱蜡至水;将切片放入柠檬酸钠抗原修复液中修复;在组织表面滴加内源性过氧化物酶阻断剂,室温条件下孵育(10 min);在组织表面滴加山羊血清,CO2培养箱中孵育(30 min,37 ℃);一抗孵育,湿盒内过夜(4 ℃);次日取出切片,CO2培养箱中复温(40 min,37 ℃);在组织表面滴加酶标山羊抗兔IgG聚合物,CO2培养箱中孵育(20 min,37 ℃);在组织表面滴加DAB 工作液(100 μL),待组织颜色刚刚变深时迅速终止反应;苏木素复染、脱水、透明、封片后显微镜(×100)下观察切片,定位,显微镜(×400)下拍照,计算IL-17A、IL-10 免疫阳性反应的平均光密度(average optical density,AOD)值。
1.4.5缺血侧皮层病理改变 将各组用于免疫组化的缺血侧脑组织修块、脱水、包埋、切片、烤片,依次在二甲苯溶液Ⅰ中浸泡(10 min),二甲苯溶液Ⅱ中浸泡(10 min),无水乙醇溶液Ⅰ中浸泡(2 min),无水乙醇溶液Ⅱ中浸泡(2 min),95%乙醇溶液(2 min)、85%乙醇溶液(2 min)中浸泡,蒸馏水中浸泡(2 min),苏木素染液中浸泡(15 min),蒸馏水中浸泡(5 min),1%盐酸乙醇分化液中浸泡(1 s),自来水流水冲(20 min),蒸馏水中反蓝(2 min),95%乙醇溶液中浸泡(2 min),伊红染液中浸泡(15 s),脱水、透明、封片,显微镜(×400)下拍照。
1.5 统计学方法
应用SPSS 22.0 软件进行统计学分析。计量资料符合正态分布以()表示,若方差齐,组间比较采用ANOVA 单因素方差分析,两两比较采用LSD-t检验;若方差不齐则采用Tamhane's T2 进行检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 3组前肢抓握力量比较
与S-con 组比较,M-con 组再灌注12 h,再灌注1、3、7 d 前肢抓握力量均明显降低(P<0.05);与Mcon 组比较,EP 组再灌注12 h,再灌注1、3、7 d 前肢抓握力量均明显升高(P<0.05)。见表1。
表1 3组前肢抓握力量比较() gTable 1 Comparison of forelimb grasping strength in three groups() g
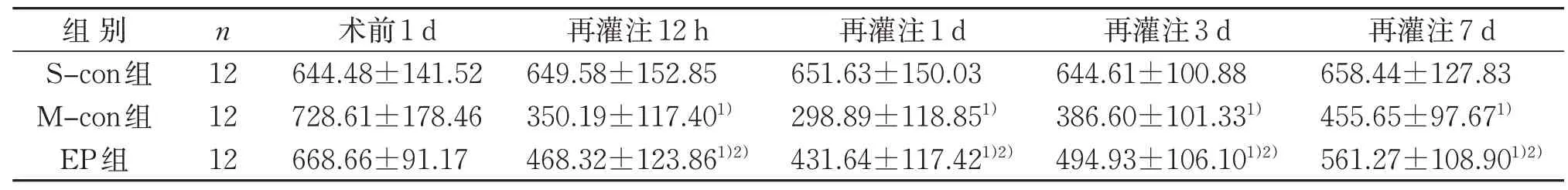
表1 3组前肢抓握力量比较() gTable 1 Comparison of forelimb grasping strength in three groups() g
注:与S-con组同时间点比较,1)P<0.05;与M-con组同时间点比较,2)P<0.05。Notes:Compared with the S-con group at the same time,1)P<0.05;compared with the M-con group at the same time,2)P<0.05.
2.2 3组腹主动脉血清IL-17A、IL-10含量比较
与S-con 组比较,M-con 组再灌注7 d 后腹主动脉血清IL-17A、IL-10的含量均明显增加(P<0.05);与M-con 组比较,EP 组再灌注7 d 后腹主动脉血清IL-17A的含量明显减少,IL-10的含量明显增加(P<0.05)。见表2。
表2 3组血清IL-17A、IL-10含量比较()ng/LTable 2 Comparison of content of IL-17A,IL-10 of serum in three groups() ng/L

表2 3组血清IL-17A、IL-10含量比较()ng/LTable 2 Comparison of content of IL-17A,IL-10 of serum in three groups() ng/L
注:与S-con 组比较,1)P<0.05,与M-con 组比较,2)P<0.05。Notes:Compared with the S-con group,1) P<0.05;compared with the M-con group,2)P<0.05.
2.3 3 组缺血侧皮层、结肠组织IL-17A、IL-10 蛋白表达比较
与S-con 组比较,M-con 组再灌注7 d 后缺血侧皮层内、结肠组织中IL-17A、IL-10蛋白表达量均明显增加(P<0.05);与M-con 组比较,EP 组再灌注7 d 后缺血侧皮层、结肠组织中IL-17A 蛋白表达量明显减少,IL-10 蛋白表达量明显增加(P<0.05)。见表3、图1。
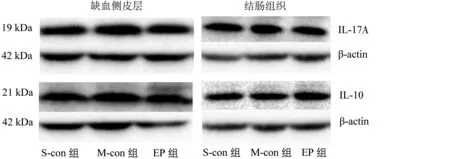
图1 3组缺血侧皮层、结肠组织IL-17A、IL-10蛋白电泳图Figure 1 Electrophoretogram of IL-17A,IL-10 protein of ischemic cortex and colon tissue in three groups
表3 3组缺血侧皮层、结肠组织IL-17A、IL-10蛋白表达比较()Table 3 Comparison of expression of IL-17A,IL-10 protein of ischemic cortex and colon tissue in three groups()
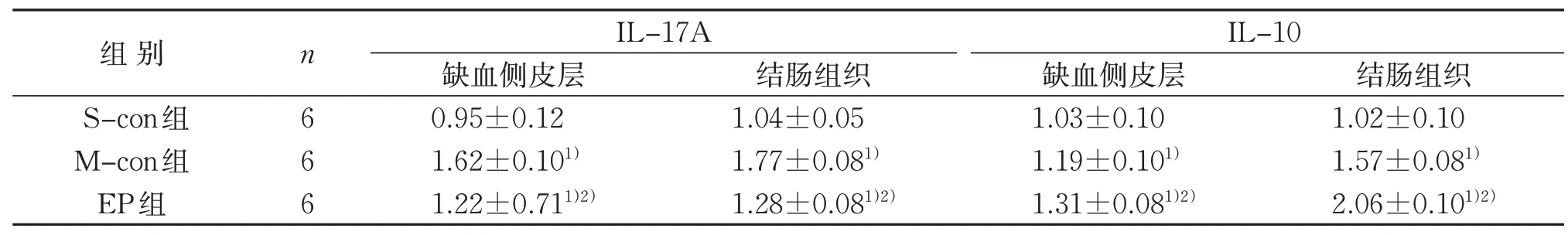
表3 3组缺血侧皮层、结肠组织IL-17A、IL-10蛋白表达比较()Table 3 Comparison of expression of IL-17A,IL-10 protein of ischemic cortex and colon tissue in three groups()
注:与S-con组比较,1)P<0.05;与M-con组比较,2)P<0.05。Notes:Compared with the S-con group,1)P<0.05;compared with the M-con group,2)P<0.05.
2.4 3 组缺血侧皮层、结肠组织IL-17A、IL-10 的AOD值比较
与S-con 组比较,M-con 组再灌注7 d 后缺血侧皮层、结肠组织IL-17A、IL-10 蛋白的AOD 值均明显升高(P<0.05);与M-con组比较,EP组再灌注7 d后缺血侧皮层、结肠组织IL-17A 的AOD 值显著降低,IL-10 的AOD 值明显升高(P<0.05)。见表4、图2。
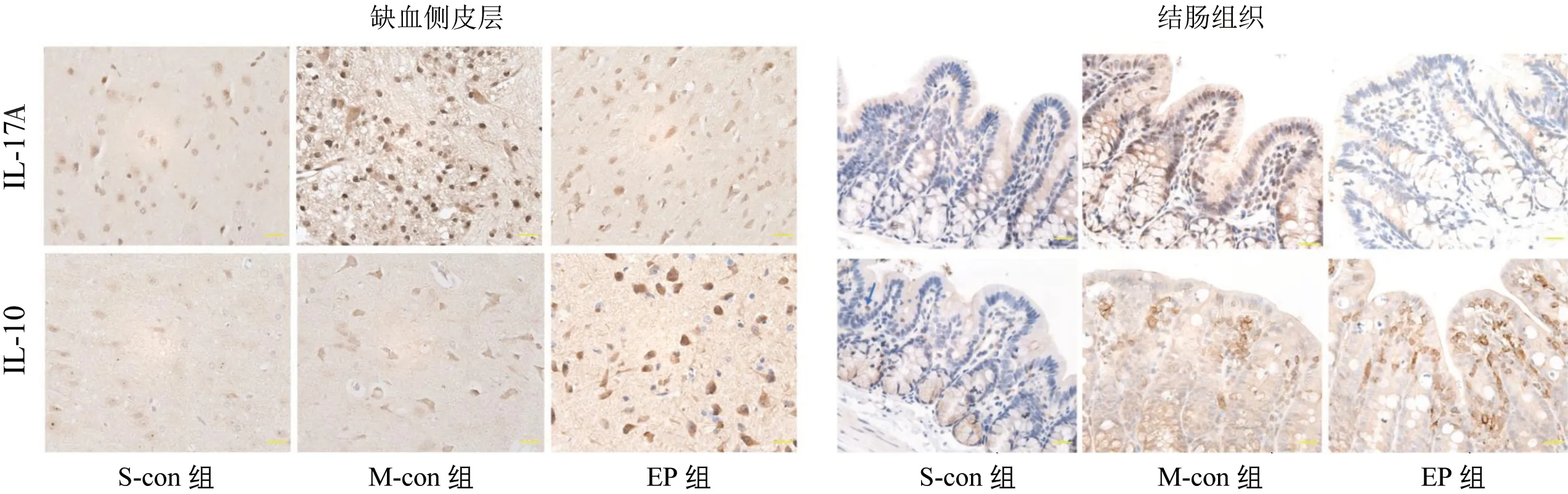
图2 3组缺血侧皮层、结肠组织IL-17A、IL-10阳性表达(×400)Figure 2 Positive expression of IL-17A,IL-10 of ischemic cortex and colon tissue in three groups(×400)
表4 3组缺血侧皮层、结肠组织IL-17A、IL-10的AOD值比较()Table 4 Comparison of AOD value of IL-17A,IL-10 protein of ischemic cortex and colon tissue in three groups()

表4 3组缺血侧皮层、结肠组织IL-17A、IL-10的AOD值比较()Table 4 Comparison of AOD value of IL-17A,IL-10 protein of ischemic cortex and colon tissue in three groups()
注:与S-con组比较,1)P<0.05;与M-con组比较,2)P<0.05。Notes:Compared with the S-con group,1)P<0.05;compared with the M-con group,2)P<0.05.
2.5 3组缺血侧皮层病理变化
S-con 组再灌注7 d 后右侧脑组织未见病理改变;M-con组再灌注7 d后缺血侧皮层脑细胞排列紊乱、皱缩,片状坏死,核固缩、边移、深染,形态不规则,神经纤维空泡化。与M-con 组比较,EP 组再灌注7 d 后缺血侧皮层细胞坏死的数量明显减少,神经纤维空泡化等病理改变明显减轻。见图3。
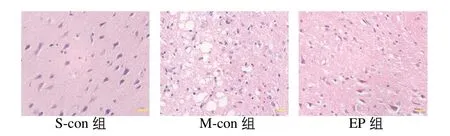
图3 3组缺血侧皮层病理变化图(×400)Figure 3 Pathology figure of ischemic cortex in three groups(×400)
3 讨论
MURRY 等[16]于1986 年提出缺血预适应(isch⁃emic preconditioning,IPC)的概念,预先给予短暂性且非致死性的轻度缺血或再灌注刺激可增强机体对随后发生的长时间致死性缺血的耐受。KITAGAWA等[17]证实1次或多次短暂的亚致死性IPC,可在一定时间内增强脑组织对严重缺血刺激的耐受。此外,越来越多的临床证据表明,很多预适应方式(如局部或远程缺血、缺氧、内毒素、细胞因子和麻醉药等)都能够诱导脑保护机制和心脏保护机制,对抗缺血/再灌注损伤[18-19]。但从临床实际应用情况来看,上述预处理方法仍有一定的局限性,特别是对于危重症患者仍存在尚未解决的矛盾。为此,本研究采用电针预处理干预CIRI 大鼠模型,以期为IPC在临床的应用提供参考。
3.1 电针预处理能够减轻脑缺血/再灌注大鼠的运动功能障碍
本研究结果显示,M-con 组、EP 组术后各时间点前肢抓握力量均低于S-con 组,EP 组术后各时间点前肢抓握力量均明显高于M-con 组,这提示脑缺血能够造成大鼠的运动功能障碍,而电针预处理能够减轻脑缺血/再灌注大鼠的运动功能障碍。这可能与以下因素有关:①EA预处理能产生类IPC的作用,能够在哺乳动物的大脑中产生快速型和延迟型神经保护作用。研究显示,电针百会、足三里等穴位可通过促进缺血侧运动皮层M2 型小胶质细胞外泌体的分泌,改善大鼠脑缺血后的神经功能缺损症状及运动功能障碍[20]。脑缺血再灌注后,神经细胞大量死亡,大鼠有神经功能的异常以及运动行为学改变,针刺足三里等穴位能够保护脑神经细胞再生,促进其肢体运动功能的恢复[21]。②中风的病机多本虚标实,针刺应通经络、行气血、开脑窍,百会穴位于颠顶,多条经脉交汇于此,针刺百会可醒脑开窍、通达阴阳脉络;足三里穴为足阳明胃经的要穴,足阳明胃经多气多血,主润宗筋,针刺足三里穴可治疗中风后肢体不利[12,22-23]。电针刺激百会穴、足三里等穴位可提高CA3 区神经生长相关蛋白43和突触素在海马区的表达,保护缺血性脑损伤,促进CIRI 后损伤区域突触的重建和功能的重塑[24]。电针足三里等穴位的神经保护作用有明显促进局灶性CIRI大鼠缺血周围皮质纹状体区vimentin的增殖,促进缺血周围区皮质以及缺血侧室管膜下区内源性神经干细胞的增殖,减少脑梗死体积,改善动物整体行为学、神经功能缺损及运动功能[25-26]。这与WANG 等[27]研究显示,电针能够对局灶性脑缺血刺激诱导产生双相的耐受,快速型保护效应发生在EA 预处理后2 h,而延迟型保护效应发生在EA 预处理后24 h 的结果相似,也和WANG 等[28]对轻症患者或健康人预先实施针刺疗法可激发人体正气,增强其抗病能力,预防和减少后续疾病发生发展的观点吻合。
3.2 电针预处理可减轻脑缺血后肠道-中枢炎症反应和免疫损伤
本研究结果显示,与S-con 组比较,M-con 组再灌注7 d后腹主动脉血清IL-17A、IL-10的含量均明显升高,缺血侧皮层、结肠组织中IL-17A、IL-10 蛋白表达量和AOD 值均明显升高;与M-con 组比较,EP 组再灌注7 d 后腹主动脉血清IL-17A 的含量明显减少,IL-10 的含量显著增加,缺血侧皮层、结肠组织中IL-17A 蛋白表达量和AOD 值均明显减少,IL-10 蛋白表达量和AOD 值均明显增加。这提示,脑缺血/再灌注后外周炎症反应增强,电针预处理可下调脑组织、肠道组织及外周IL-17A 的表达,上调IL-10 的表达,减轻脑缺血后肠道-中枢炎症损伤。这可能与以下因素有关:①炎症反应是CIRI的关键病理过程。CIRI 发生后,IL-6、IL-1β 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等大量促炎因子分泌并促进中性粒细胞和巨噬细胞向受损组织浸润,引起炎症反应恶性循环[29]。Janus 激酶-信号转导与转录激活子信号通路以及核因子κB(nucle⁃ar factor-kappa B,NF-κB)这2 种信号通路可通过多种细胞因子参与炎症反应,加重脑损伤[30]。EA 预处理可下调大鼠炎症因子IL-1β、IL-6、Toll样受体4(Toll-like receptor 4,TLR4)、NF-κB 表达,调节脑缺血/再灌注后炎症反应,诱导脑缺血耐受[31-33]。EA预处理可通过减轻缺血侧脑组织的神经炎症反应有效改善脑缺血再灌注损伤,如上调大脑皮层半暗带Yes 相关蛋白表达,下调神经元NOD 样受体热蛋白结构域相关蛋白3 的表达等[34-35]。②Th17 细胞分泌的炎性因子IL-17A可增加多种促炎症因子、趋化因子、黏附分子的表达,促进免疫炎症反应,破坏血脑屏障,加重脑组织损伤[36-38]。当大鼠脑缺血发生后,肠道内的IL-17+γδT 可增多并迁移至脑组织沉积,EA 预处理可抑制TNF-α、IL-6 等促炎因子的合成和分泌,促使肠道内IL-17A 含量下降,调节T淋巴和B 淋巴细胞的增殖,抑制炎症反应和免疫损伤,促进脑梗死面积明显缩小[39-40]。此外,EA 预处理还可以激活大鼠体内多种免疫细胞分泌抗炎因子IL-10,有效减轻炎症反应,这与徐磊等[41-42]研究结果相似。
4 小 结
百会穴、足三里穴电针预处理可减轻缺血侧皮层的病理损伤程度、肠道-中枢炎症损伤,改善神经行为学功能。但是目前电针预处理干预脑缺血/再灌注大鼠是如何发挥脑-肠保护作用的具体机制尚未完全阐明,未来可基于以上研究进一步深入探讨电针预处理的作用机制,为脑缺血/再灌注损伤的预防和治疗提供新思路。

