移植菌液pH值对粪便菌群移植治疗小鼠溃疡性结肠炎肠道黏膜免疫影响及机制研究
潘张磊,王瑞珩,刘跟莉
(黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
溃疡性结肠炎(UC)是一种慢性、复发性、特发性的结肠和直肠炎性疾病,其发病机制复杂,宿主免疫应答异常、肠道屏障功能障碍、肠道菌群失调、环境和其他因素均与该病的发生有关[1-2]。粪便菌群移植是将健康供体粪便转移至肠道微生物稳态失衡的患者体内以恢复肠道稳态的治疗方法,该疗法在艰难梭菌感染的治疗中得到认可[3-4],且诸多研究表明粪便菌群移植具有治疗UC的潜力[5-6]。但有关影响粪便菌群移植疗效的因素和深入的作用机制研究甚少。芳香烃受体(aryl hydrocarbon receptor, AHR)信号通路是连接肠道菌群与黏膜免疫的关键信号通路,其在肠道菌群代谢物激活下发挥对调节性T细胞(Tregs)和辅助性T 细胞17(Th17)的调节作用[7],但在粪便菌群移植治疗UC中的作用鲜有报道。本研究旨在通过探究移植菌液pH值对粪便菌群移植治疗UC小鼠肠道黏膜免疫的影响和AHR信号通路在其中的可能作用,为粪便菌群移植的规范化提供参考和为粪便菌群移植机制研究提供新思路。
1 实验材料与方法
1.1主要仪器和试剂 葡聚糖硫酸钠(DSS)购于MP Biomedicals公司;尿粪隐血试剂盒购于中国南京建成生物工程研究所;白细胞介素-10(IL-10)、转化生长因子β1(TGF-β1)、白细胞介素-17A(IL-17A) ELISA试剂盒购于abcam公司。EasySepTMMouse Naïve CD4+T Cell isolation试剂盒购于stemcell公司。CellXVivo Mouse Treg Cell Differentiation试剂盒和CellXVivoTMMouse Th17 Cell Differentiation试剂盒购于R&D公司。PrimeScriptTMRT reagent试剂盒、TB Green®PremixEx TaqTM试剂盒购于TAKARA公司。PCR仪为Bio-Rad公司iQ5。
1.2供体粪便质量控制和菌液制备 招募6名男性健康志愿者提供粪便滤液,要求年龄20~30岁,排便规律,依从性良,无与肠道菌群变化有关的疾病,1个月之内未服用过抗生素或益生菌,均进行粪便检测,自愿签署书面知情同意书。6名志愿者从实验开始前1周严格按照食谱要求进行饮食控制,其中随机选取2名志愿者为酸性粪便供体,饮食以糖脂类食物为主;随机选取2名志愿者为碱性粪便供体,饮食以瘦肉类食物为主;其余2名志愿者为中性粪便供体,饮食以素食为主。取志愿者6 h内的新鲜粪便称重,按照粪便重量与生理盐水体积比1∶2的比例将两者充分混匀;双层无菌纱布过滤粪便混悬液,收集滤液,离心后弃上清,加入二倍粪便体积的生理盐水,混匀后即为500 mg/mL菌液。酸性菌液控制pH<6.9,碱性菌液控制pH>7.2,中性菌液控制pH 6.9~7.2。
1.3实验动物 清洁级雄性7周龄C57BL/6小鼠50只,购买并饲养于黑龙江中医药大学动物实验中心,许可证号:SYXK(黑)2016-004。饲养在黑龙江中医药大学动物实验室,温度(23±3)℃,湿度40%~70%,每天12 h/12 h光照/黑暗交替,自由取食饲料和实验动物饮用水,饲养条件符合《黑龙江省实验动物管理条例》。
1.4实验方法
1.4.1分组、造模及干预 小鼠适应性喂养1周后,随机分为对照组、模型组、粪便菌群低pH值组、粪便菌群中pH值组和粪便菌群高pH值组,每组10只。除对照组小鼠外,其余组小鼠自由饮用2% DSS溶液进行造模,连续7 d。造模成功后,粪便菌群低pH值组、中pH值组和高pH值组分别给予对应的酸性、中性、碱性粪便菌液灌肠,参照人体粪便菌群移植标准[8],每只小鼠每次移植的粪菌量为小鼠自身体重的0.2%,对照组与模型组给予等量生理盐水灌肠,均2次/d,连续7 d。
1.4.2检测指标及方法
1.4.2.1血浆中Tregs和Th17细胞因子含量 处死小鼠,采用ELISA法检测血浆中IL-10、TGF-β1、IL-17A含量。
1.4.2.2结肠组织中Tregs和Th17细胞因子及AHR、CYP1A1 mRNA表达量 采用PCR法检测:取各组小鼠结肠组织,液氮研磨后用Trizol试剂提取总RNA,氯仿和异丙醇抽提。紫外分光光度仪和琼脂糖电泳鉴定RNA的浓度和纯度,根据逆转录试剂盒说明逆转录合成cDNA。以逆转录产物进行PCR扩增反应,并以β-actin 为内参对照,IL-10、TGF-β1、IL-17A、AHR、CYP1A1引物由上海生工生物工程有限公司设计和合成,引物序列:IL-10上游为5’-TTCTTTCAAACAAAGGACCAGC-3’,下游为5’-GCAACCCAAGTAACCCTTAAAG-3’;TGF-β1上游为5’-CCAGATCCTGTCCAAACTAAGG-3’,下游为5’-CTCTTTAGCATAGTAGTCCGCT-3’;IL-17A 上游为5’-GAGCTTCATCTGTGTCTCTGAT-3’,下游为5’-GCCAAGGGAGTTAAAGACTTTG-3’;AHR上游为5’-CATCGACATAACGGACGAAATC-3’,下游为5’-CTGTTGCTGTTGCTCTAGTTG-3’;CYP1A1上游为5’-ACCCTTACAAGTATTTGGTCGT-3’,下游为5’-GTCATCATGGTCATAACGTTGG-3’;β-actin上游为5’-AGAGGGAAATCGTGCGTGAC-3’,下游为5’-CCAAGAAGGAAGGCTGGAAAA-3’。PCR反应条件为:55 ℃逆转录反应60 min,94 ℃变性2 min→94 ℃ 30 s→55 ℃ 30 s→72 ℃ 1 min,共30循环,72 ℃延伸7 min。胶回收试剂盒回收目的基因片段。PCR产物在琼脂糖凝胶中电泳,凝胶成像仪采集图像,PCR仪获得产物 Ct 值,采用 2-△△Ct相对定量计算公式计算分析。
1.4.2.3结肠组织中Tregs和Th17细胞因子原位蛋白表达情况 采用免疫组化法检测:结肠组织样本石蜡切片常规脱蜡水化后经3% H2O2灭活内源性过氧化物酶,置于0. 01 mol /L pH 6. 0的柠檬酸钠缓冲液中加热至96 ℃进行抗原修复,切片自然冷却至室温, 滴加胰酶修复液,37℃恒温箱中孵育8 min,冷却至室温后,PBS洗涤切片,滴加正常山羊非免疫血清,室温下保湿盒内孵育60 min,滴加单克隆抗体,4 ℃冰箱过夜,次日洗涤后滴加二抗生物素,室温孵化30 min,显微镜下DAB显色液显色,采用Olympus BH2正置显微镜拍摄,阳性反应为切片中出现黄褐色显影。
1.5细胞实验 无菌分离C57BL/6小鼠脾脏,制备脾细胞悬液,磁珠分选器分选Naïve CD4+T细胞,继而采用试剂盒分别诱导分化Tregs和Th17,继续培养5 d后分为2组:细胞以1×105个/mL铺于U型底96孔板,对照组常规培养,AHR激动剂组加入10 nmol/L的吲哚甲醇培养,隔天换液,培养5 d后收集各组培养上清液。采用ELISA法检测Tregs细胞上清液中IL-10、TGF-β1和Th17细胞上清液中IL-17A含量,按照“1.4.2.2”PCR法检测Tregs细胞上清液中IL-10、TGF-β1、CYP1A1 mRNA和Th17细胞上清液中IL-17A、CYP1A1 mRNA表达量。

2 结 果
2.1各组小鼠血浆中Tregs和Th17细胞因子含量模型组血浆IL-10、TGF-β1含量明显低于对照组(P均<0.05),IL-17A含量明显高于对照组(P均<0.05);粪便菌群各组血浆中IL-10、TGF-β1含量均明显高于模型组(P均<0.05),IL-17A含量均明显低于模型组(P均<0.05),粪便菌群中pH值组各指标改善最明显。见图1。
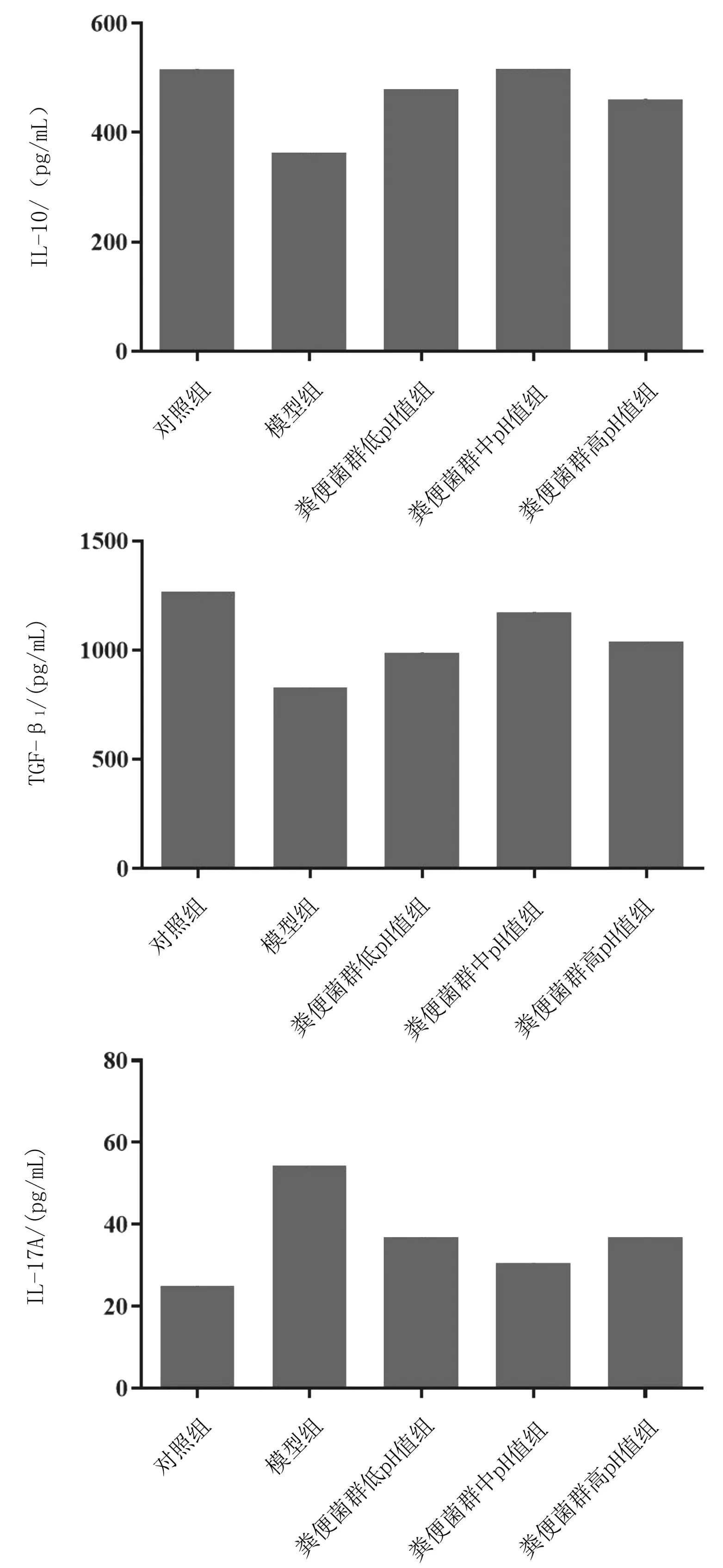
图1 对照组和溃疡性结肠炎各组小鼠血浆中IL-10、TGF-β1和IL-17A含量
2.2各组小鼠结肠组织中Tregs和Th17细胞因子、AHR及CYP1A1 mRNA表达情况 模型组结肠组织中IL-10、TGF-β1、AHR、CYP1A1 mRNA表达量均明显低于对照组(P均<0.05),IL-17A mRNA表达量明显高于对照组(P<0.05);粪便菌群各组结肠组织中IL-10、TGF-β1、AHR、CYP1A1 mRNA表达量均明显高于模型组(P均<0.05),IL-17A mRNA表达量均明显低于模型组(P均<0.05),粪便菌群中pH值组各指标改善最显著。见图2。
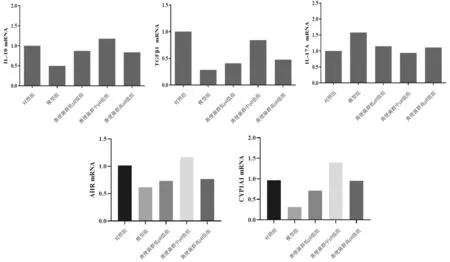
图2 对照组和溃疡性结肠炎各组小鼠结肠组织中IL-10、TGF-β1、IL-17A、AHR、CYP1A1 mRNA表达情况
2.3各组小鼠结肠组织中Tregs和Th17细胞因子原位蛋白表达情况 结肠组织中IL-10、TGF-β1、IL-17A蛋白原位表达情况与mRNA表达一致。见图3。
2.4Tregs、Th17细胞中细胞因子含量 AHR激动剂组Tregs细胞上清液中IL-10、TGF-β1含量均明显高于对照组(P均<0.05),Th17细胞上清液中IL-17A含量明显低于对照组(P<0.05)。见图4。
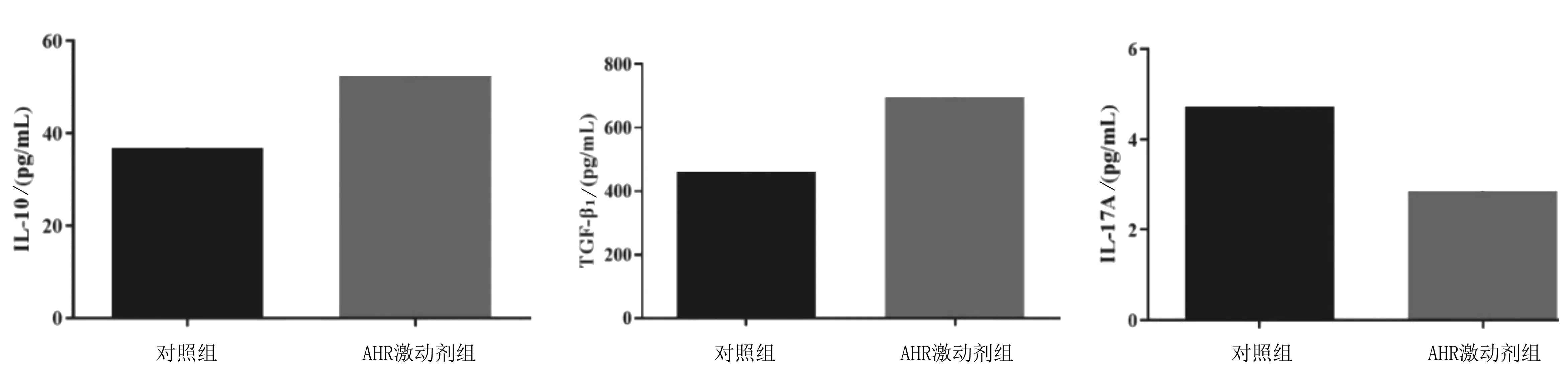
图4 Tregs上清液中IL-10、TGF-β1和Th17细胞上清液中IL-17A含量
2.5Tregs、Th17细胞中细胞因子及CYP1A1 mRNA表达情况 AHR激动剂组Tregs细胞上清液中IL-10、TGF-β1、CYP1A1 mRNA表达量均明显高于对照组(P均<0.05),见图5;AHR激动剂组Th17细胞上清液中IL-17A mRNA表达量明显低于对照组(P<0.05),CYP1A1 mRNA表达量明显高于对照组(P<0.05),见图6。
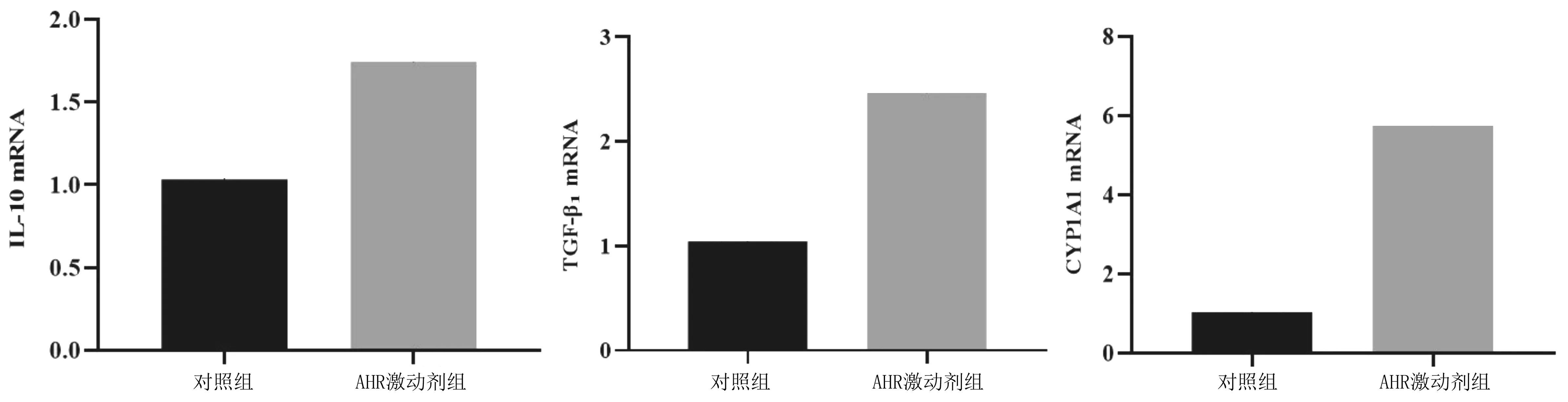
图5 Tregs细胞上清液中IL-10、TGF-β1及CYP1A1 mRNA表达情况
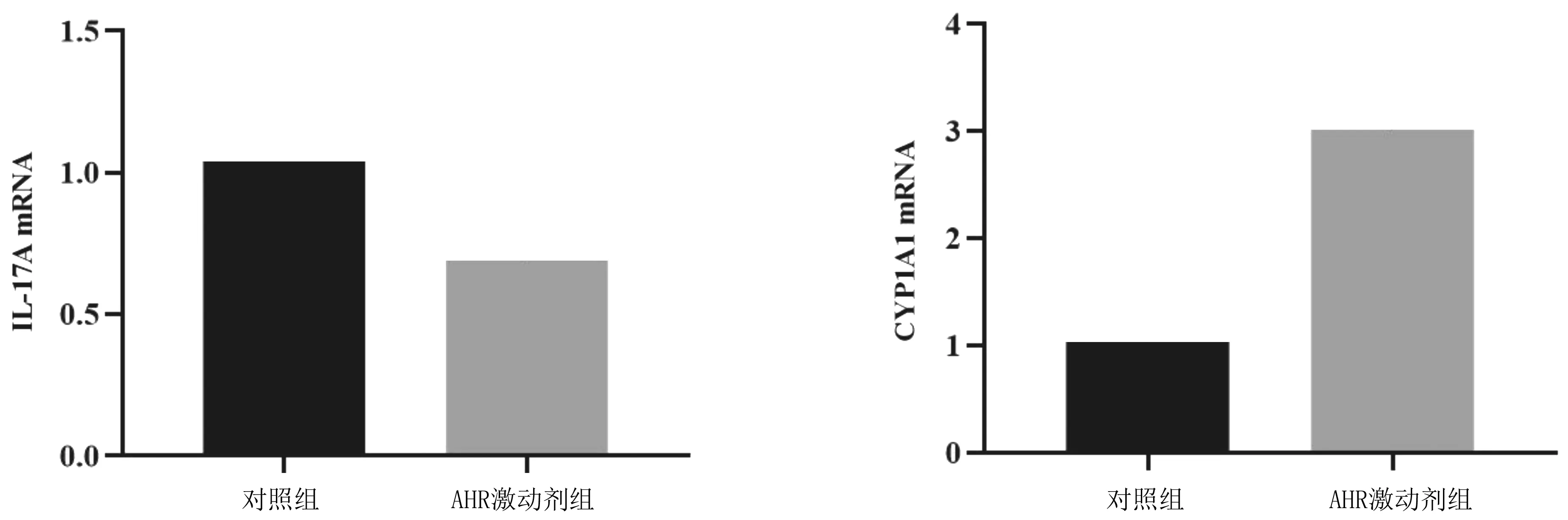
图6 Th17细胞上清液中IL-17A及CYP1A1 mRNA表达情况
3 讨 论
Tregs和Th17为功能上相互制衡的一对免疫细胞,二者在UC中存在比例失调。Tregs通过分泌免疫抑制因子IL-10和TGF-β1等实现免疫抑制功能,Tregs的过度消耗会加重UC。Th17细胞作为促炎细胞,其通过分泌IL-17促进肠道炎症,使UC恶化。研究发现,在DSS处理的BALB/c小鼠结肠和外周血中,Th17细胞数量显著增加而Tregs细胞数量显著降低[9-10];通过移植盐酸小檗碱处理的小鼠粪便可缓解UC,调节Tregs/Th17平衡[11]。但关于移植健康人的粪便菌液对UC中Tregs与Th17影响的研究少见。本实验结果显示,通过移植健康人粪便菌液至UC模型小鼠,结肠中Tregs发挥作用的主要细胞因子IL-10、TGF-β1mRNA和原位蛋白表达上调,而Th17发挥作用的主要细胞因子IL-17A mRNA和原位蛋白表达下调,证实移植健康人粪便菌液可调节Tregs/Th17平衡,与既往文献研究结果一致。
粪便菌群移植的治疗作用基于改变肠道菌群实现,其机制为改变的肠道菌群通过其代谢物影响宿主肠道黏膜免疫而发挥治疗作用。Tian等[12]研究发现,粪便菌群移植治疗后,UC患者肠道菌群多样性增加,肠道菌群结构改变,Bacteroides、Prevotella丰度回调。一些菌群能够代谢食物中的色氨酸产生吲哚及其衍生物如吲哚甲醇、吲哚乙酸、吲哚乳酸、吲哚乙醛等,其能被肠道黏膜吸收并作用于肠道黏膜免疫细胞如Tregs和Th17[13]。AHR是一种配体激活的转录因子,介导吲哚代谢物与肠道黏膜免疫,其与内源性或外源性配体结合后,转移至细胞核,激活CYP家族包括CYP1A1等基因的转录,进而激活Tregs的分化和抑制Th17的功能,发挥免疫调节作用[7]。Kawai等[14]报道,青黛可通过激活AHR及CYP1A1和诱导抗炎细胞因子如IL-10等的表达发挥治疗UC的作用。本实验结果表明,粪便菌群移植后小鼠结肠组织中AHR、CYP1A1 mRNA表达上调;且采用AHR激动剂吲哚甲醇干预体外培养的Tregs和Th17后,Tregs中IL-10、TGF-β1含量和IL-10、TGF-β1、CYP1A1 mRNA表达量均明显上调,Th17中IL-17A含量和IL-17A mRNA表达量均明显下调而CYP1A1 mRNA表达量明显上调。提示粪便菌群移植治疗UC的机制与AHR信号通路激活介导的Tregs与Th17功能回调有关,且此结果在体外Tregs和Th17细胞培养中得到进一步验证。
粪便pH值在生理情况下保持恒定,病理情况下则常出现酸碱平衡失调。不同菌群对环境pH的范围有相对选择性,菌液pH的差异实为菌群分布的差异。大部分细菌的最适pH为6.5~7.5,大肠杆菌能够在pH为4.5~8.0的环境下生存,但过酸会抑制双歧杆菌的生长和繁殖[15]。故在粪便菌群移植中,供体菌液pH值的选择或成为影响疗效的关键因素。本实验结果显示,相较于酸性和碱性,中性pH值粪便菌液移植对体内和体外Tregs和Th17的功能影响最显著,对AHR信号通路的激活也最明显。
综上所述,粪便菌群移植可通过激活AHR信号通路而改善DSS诱导的小鼠UC黏膜免疫异常,且中性pH值粪便菌液作用效果最显著。提示粪便菌群移植治疗UC时需将菌液pH值纳入规范,基于AHR通路激活能改善肠道黏膜免疫为UC的治疗提供了新的思路。
利益冲突:所有作者均声明不存在利益冲突。

