GC法比较不同企业脑立清制剂中3种挥发性成分含量
尹 雪,焦 阳,梅桂雪,徐兴燕,丁 勃,谭乐俊,林永强
(山东省食品药品检验研究院 国家药品监督管理局胶类产品质量评价重点实验室,山东 济南 250101)
脑立清制剂包括丸剂、胶囊剂和片剂3个制剂规格,处方组成一致,仅在制剂工艺上有所区别,脑立清丸和脑立清胶囊收载于《中国药典》2020年版一部,脑立清片收载于《中国人民共和国卫生部药品标准》(中药成方制剂第十九册)[1-2]。现行标准中,脑立清丸对龙脑进行了定量控制,脑立清胶囊对龙脑及薄荷脑进行了定量控制,而脑立清片中无含量测定项目。为全面评价脑立清制剂(丸剂、胶囊剂、片剂)的质量状况,为质量监管提供科学依据,本文参考相关文献[3-7],在《中国药典》2020年版一部脑立清胶囊及脑立清丸含量测定的基础上,建立了同时测定脑立清制剂(丸、胶囊、片)中薄荷脑、龙脑、冰片(以龙脑和异龙脑总和计)3种指标性成分含量的方法。
1 仪器与材料
1.1 仪器
METTLER AE240电子天平[梅特勒-托利多国际贸易(上海)有限公司];Agilent 7890气相色谱仪(安捷伦科技有限公司);KQ-500DE数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
薄荷脑对照品(批号:110728-200506),龙脑对照品(批号:110881-201709,含量以99.6 %计),异龙脑对照品(批号:111512-201603,含量以96.7 %计),水杨酸甲酯对照品(批号:110707-201815,含量以100.0 %计,中国食品药品检定研究院);脑立清系列制剂为2020年国家药品评价性抽验样品,涉及15家生产企业、88个生产批次(包括丸剂52批,胶囊剂34批,片剂2批)。按脑立清系列制剂的处方,从山东沃华医药科技股份有限公司购买正品药材,经检验合格后按规定的处方和工艺自制脑立清丸、胶囊、片3种剂型,作为标准参比制剂使用。同时分别自制一批缺冰片、薄荷脑药味的脑立清胶囊,作为脑立清阴性样品。无水乙醇、乙醇均为色谱纯。
2 方法与结果
2.1 GC条件
色谱柱:Agilent HP INNOWAX(柱长:30 m,内径:0.32 mm,膜厚:0.25 μm);采用恒流模式,流速:1 ml/min;分流进样,分流比:20:1;进样口温度:240 ℃;检测器温度:250 ℃;柱温:160 ℃;检测器:火焰离子化检测器(FID)。
2.2 溶液的制备
2.2.1 内标溶液和对照品溶液的制备
2.2.1.1 脑立清丸剂(片剂)内标溶液和对照品溶液的制备 取水杨酸甲酯适量,精密称定,加乙醇制成每1 ml含0.13 mg的溶液,作为脑立清丸剂(片剂)内标溶液。另取龙脑对照品8 mg,异龙脑对照品8 mg,薄荷脑对照品12 mg,精密称定,置100 ml量瓶中,加内标溶液使溶解,并稀释至刻度,摇匀,作为脑立清丸剂(片剂)对照品溶液。
2.2.1.2 脑立清胶囊剂内标溶液和对照品溶液的制备 取水杨酸甲酯适量,精密称定,加无水乙醇制成每1 ml含13 mg的溶液,作为脑立清胶囊剂内标溶液。另取龙脑对照品约5 mg、异龙脑对照品约5 mg、薄荷脑对照品约7 mg,精密称定,置10 ml量瓶中,加无水乙醇适量使溶解,精密加入内标溶液1 ml,用无水乙醇稀释至刻度,摇匀,作为脑立清胶囊剂对照品溶液。
2.2.2 供试品溶液的制备
2.2.2.1 丸剂供试品溶液制备 取脑立清丸30丸,精密称定,研细,取约1 g,精密称定,置锥形瓶中,精密加入脑立清丸剂(片剂)内标溶液25 ml,密塞,称定重量,超声处理(功率 250 W,频率50 kHz)30 min,放冷,再称定重量,用脑立清丸剂(片剂)内标溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2.2.2 胶囊剂供试品溶液制备 取脑立清胶囊内容物10粒,混匀,取约2 g,精密称定,置锥形瓶中,精密加入无水乙醇25 ml,密塞,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷,再称定重量,用无水乙醇补足减失的重量,摇匀,滤过,精密量取续滤液5 ml,置10 ml量瓶中,精密加入脑立清胶囊剂内标溶液1 ml,用无水乙醇稀释至刻度,摇匀,即得。
2.2.2.3 片剂供试品溶液制备 取脑立清片30片,精密称定,研细,取相当于5片的重量,精密称定,置锥形瓶中,精密加入脑立清丸剂(片剂)内标溶液25 ml,密塞,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷,再称定重量,用脑立清丸剂(片剂)内标溶液补足减失的重量,摇匀,即得。
2.2.3 阴性供试品溶液的制备
2.2.3.1 缺冰片阴性供试品溶液制备 取缺冰片的脑立清阴性样品,混匀,取约 2 g,精密称定,置锥形瓶中,精密加入无水乙醇25 ml,密塞,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷,再称定重量,用无水乙醇补足减失的重量,摇匀,滤过,精密量取续滤液5 ml,置10 ml量瓶中,精密加入脑立清胶囊剂内标溶液1 ml,用无水乙醇稀释至刻度,摇匀。
2.2.3.2 缺薄荷脑阴性供试品溶液制备 取缺薄荷脑的脑立清阴性样品,混匀,取约2 g,精密称定,置锥形瓶中,精密加入无水乙醇25 ml,密塞,称定重量,超声处理(功率250W,频率50 kHz)30 min,放冷,再称定重量,用无水乙醇补足减失的重量,摇匀,滤过,精密量取续滤液 5 ml,置10 ml量瓶中,精密加入脑立清胶囊剂内标内标溶液1 ml,用无水乙醇稀释至刻度,摇匀。
2.3 专属性试验
分别取上述对照品、缺冰片阴性供试品溶液、缺薄荷脑阴性供试品溶液及各剂型供试品溶液各1 μl,注入气相色谱仪,进行测定。结果发现缺冰片阴性供试品溶液、缺薄荷脑阴性供试品溶液未检出薄荷脑、龙脑、异龙脑,脑立清制剂供试品溶液检出薄荷脑、龙脑、异龙脑3种成分,说明脑立清制剂中其他药味对测定无干扰。气相色谱图见图1。
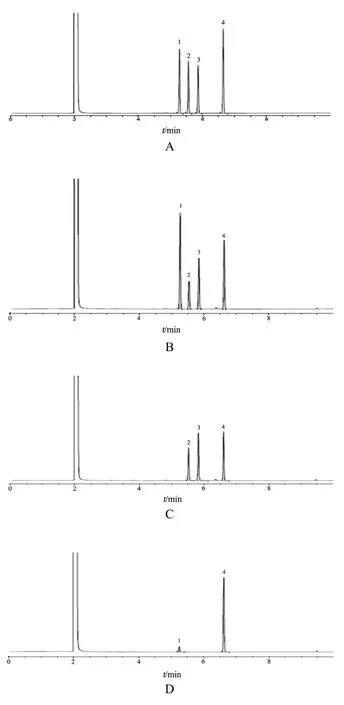
图1 专属性试验GC图谱
2.4 线性关系考察
分别精密称取薄荷脑、龙脑和异龙脑对照品适量,加无水乙醇制成浓度分别为3.5260,2.4245,2.5302 mg/ml的混合对照品储备溶液。分别精密吸取上述混合对照品储备液0.1,0.5,1.0,2.0,3.0,5.0 ml,置10 ml量瓶中,精密加入脑立清胶囊剂内标溶液1 ml,用无水乙醇稀释至刻度,摇匀,作为不同浓度的对照品溶液。分别精密吸取上述各不同浓度的混合对照品溶液1 μl,注入气相色谱仪,进行测定。以内标浓度与对照品浓度比值为横坐标(X),以内标峰面积与对照品峰面积比值为纵坐标(Y)进行线性回归。结果见表1。

表1 3种成分线性关系
2.5 精密度试验
精密吸取2.4项下混合对照品储备液2 ml,置10 ml量瓶中,精密加入脑立清胶囊剂项下的内标溶液1 ml,用无水乙醇稀释至刻度,摇匀,即得到薄荷脑、异龙脑和龙脑浓度分别为0.7052,0.4849,0.5060 mg/ml的混合对照品溶液。精密吸取上述混合对照品溶液1 μl,连续进样6次,计算薄荷脑、异龙脑和龙脑峰面积与内标峰面积比值,结果其RSD分别为0.02 %,0.06 %和0.05 %。表明仪器精密度良好。
2.6 稳定性试验
精密吸取同一脑立清胶囊剂供试品溶液,在0,4,8,12,24,48 h分别进样1 μl,计算薄荷脑、异龙脑和龙脑峰面积与内标峰面积比值,结果其RSD分别为0.21 %,0.26 %和0.23 %。表明供试品溶液中的3个待测成分在室温放置48 h内基本稳定。
2.7 重复性试验
2.7.1 胶囊剂 取脑立清胶囊参比制剂适量,按2.2.2.2项方法平行制备6份供试品溶液,分别进样1 μl,结果薄荷脑、异龙脑和龙脑含量平均值分别为30.33,12.40,17.16 mg/g,RSD分别为1.18 %,1.33 %,1.20 %。表明该方法重复性良好。
2.7.2 丸剂 取脑立清丸参比制剂适量,按2.2.2.1项方法平行制备6份供试品溶液,分别进样2 μl,结果薄荷脑、异龙脑和龙脑含量平均值分别为9.26,2.73、6.25 mg/g,RSD分别为1.65 %,1.58 %,1.79 %。表明该方法重复性良好。
2.7.3 片剂 取脑立清片参比制剂适量,按2.2.2.3项方法平行制备6份供试品溶液,分别进样2 μl,结果薄荷脑、异龙脑和龙脑含量平均值分别为1.05,1.55,2.17 mg/g,RSD分别为1.41 %,1.81 %,1.71 %。表明该方法重复性良好。
2.8 加样回收试验
2.8.1 丸剂 取已测知含量的脑立清丸参比制剂0.5 g,精密称定,置锥形瓶中,分别精密加入薄荷脑4.5 mg、异龙脑1.5 mg和龙脑3 mg,精密加入脑立清丸剂(片剂)内标溶液 25 ml,密塞,称定重量,超声处理(功率250 W,频率 50 kHz)30 min,放冷,再称定重量,用内标溶液补足减失的重量,摇匀,滤过,取续滤液,即得。平行制备6份供试品溶液,分别进样2 μl,计算回收率。结果薄荷脑、异龙脑和龙脑的平均回收率(n=6)分别为99.5 %,99.9 %和100.4 %;RSD分别为0.76 %,1.15 %和1.75 %。测定结果表明,该方法回收率良好。
2.8.2 胶囊剂 取已测知含量的脑立清胶囊参比制剂1 g,精密称定,置锥形瓶中,分别精密加入薄荷脑30 mg、异龙脑12 mg和龙脑17 mg,精密加入无水乙醇25 ml,密塞,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷,再称定重量,用无水乙醇补足减失的重量,摇匀,滤过,精密量取续滤液5 ml,置10 ml量瓶中,精密加入脑立清胶囊剂内标溶液1 ml,用无水乙醇稀释至刻度,摇匀,即得。平行制备6份供试品溶液,分别进样1 μl,计算回收率。结果薄荷脑、异龙脑和龙脑的平均回收率(n=6)分别为99.1 %,99.9 %和99.8 %;RSD分别为1.51 %,1.39 %和1.39 %。测定结果表明,该方法回收率良好。
2.8.3 片剂 取脑立清片30片,精密称定,研细,取相当于2.5片的重量,精密称定,置锥形瓶中,分别精密加入薄荷脑2 mg、异龙脑3 mg和龙脑4 mg,精密加入内标溶液 25 ml,密塞,称定重量,超声处理(功率 250 W,频率 50 kHz)30 min,放冷,再称定重量,用脑立清丸剂(片剂)内标溶液补足减失的重量,摇匀,即得。平行制备6份供试品溶液,分别进样2 μl,计算回收率。结果薄荷脑、异龙脑和龙脑的平均回收率(n=6)分别为100.2 %,99.9 %和99.6 %;RSD分别为1.57 %,1.73 %和1.42 %。测定结果表明,该方法回收率良好。
2.9 样品的测定
按本文建立方法测定15家生产企业、88个生产批次的脑立清样品。对测定结果进行频数分布和箱线图分析,由于脑立清片剂样本量少,仅2批,未做统计学分析。含量测定结果及统计学分析结果见表2和图2~13。
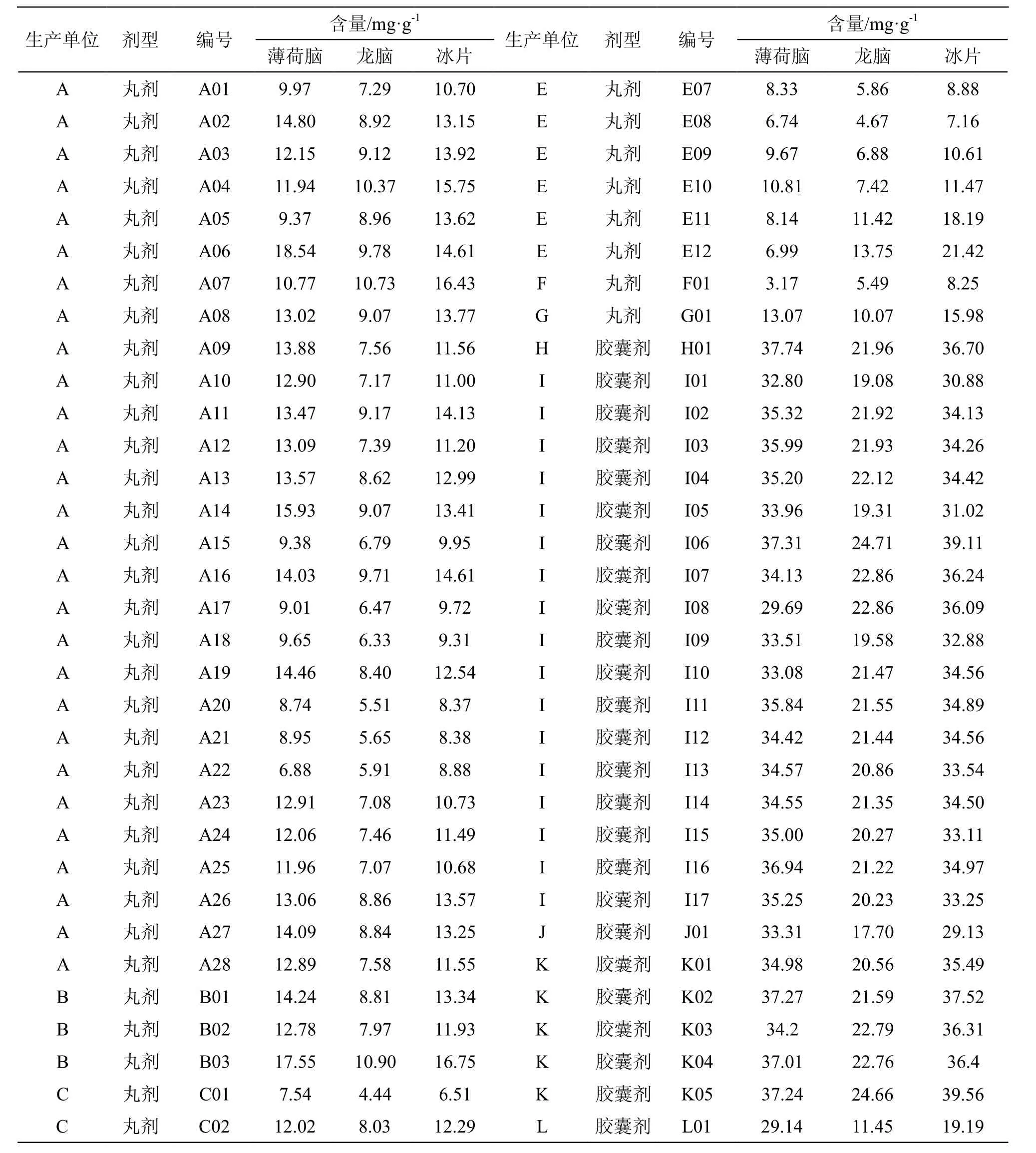
表2 脑立清制剂GC含量测定结果

表2(续)
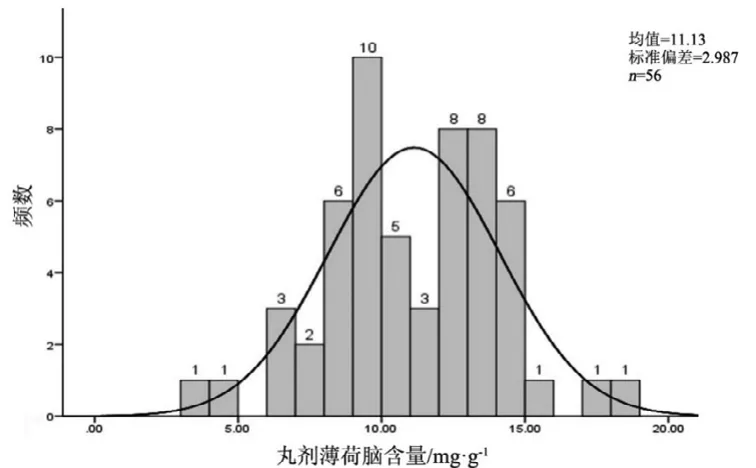
图2 丸剂薄荷脑测定结果频数分布图
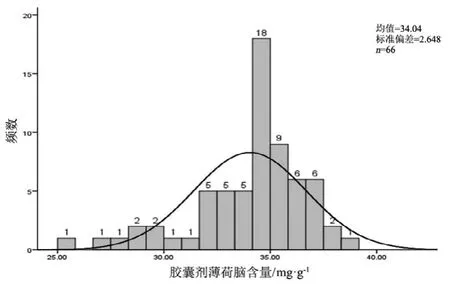
图3 胶囊剂薄荷脑测定结果频数分布图
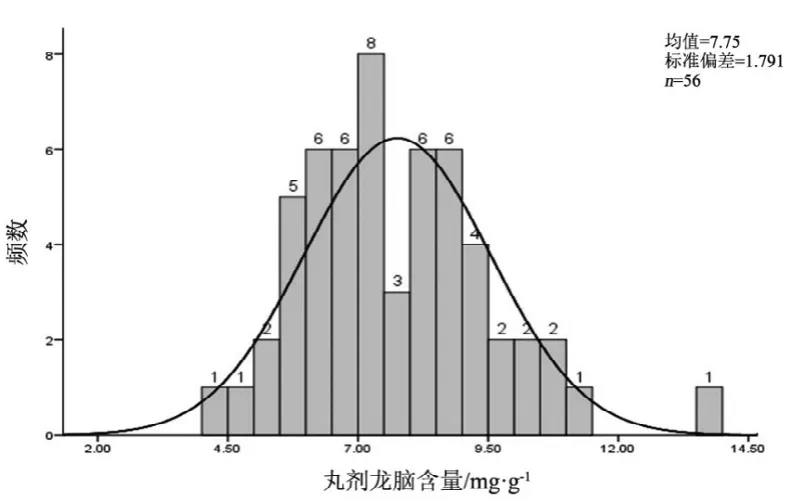
图4 丸剂龙脑测定结果频数分布图
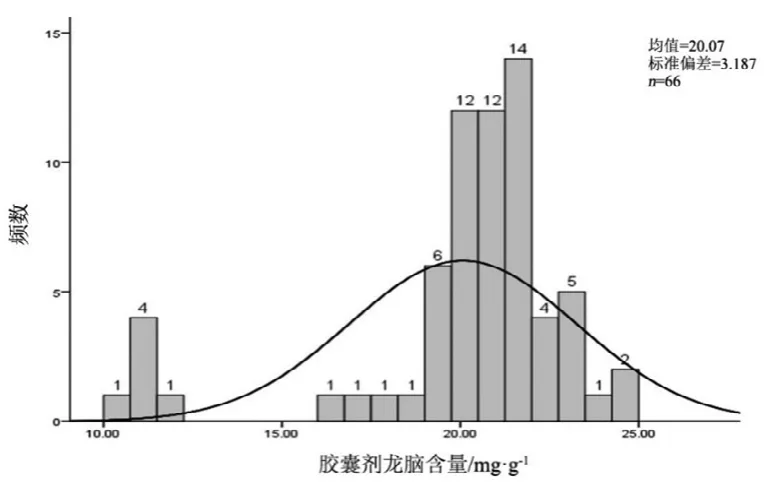
图5 胶囊剂龙脑测定结果频数分布图
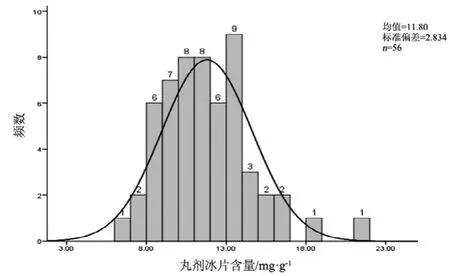
图6 丸剂冰片测定结果频数分布图
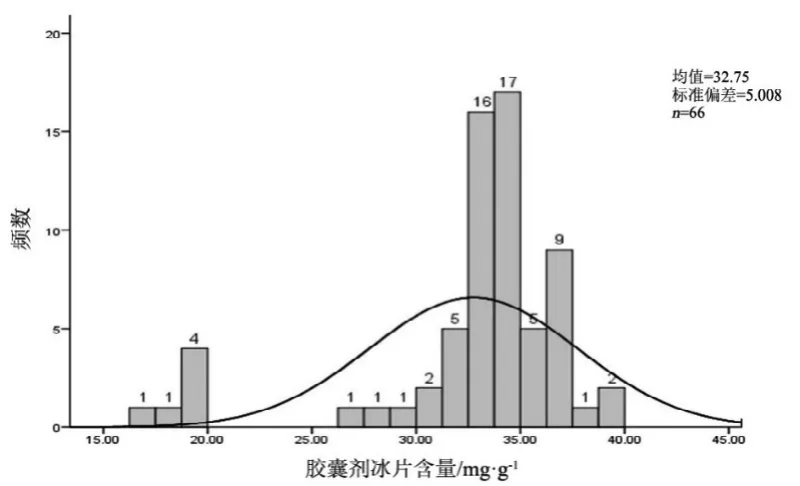
图7 胶囊剂冰片测定结果频数分布图
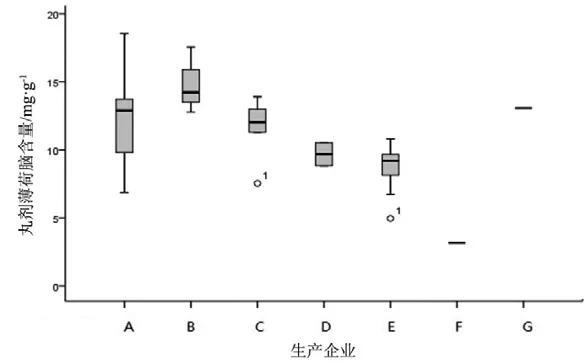
图8 丸剂薄荷脑测定结果箱线图
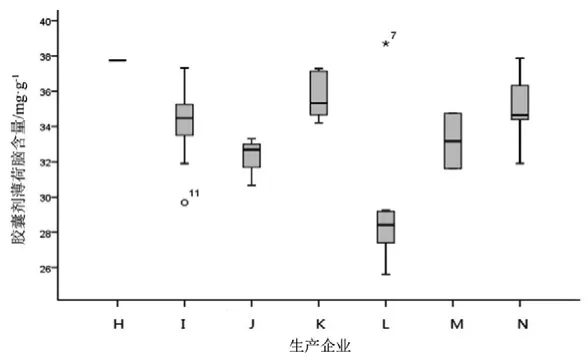
图9 胶囊剂薄荷脑测定结果箱线图
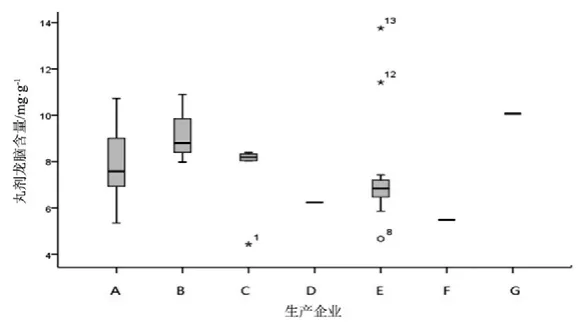
图10 丸剂龙脑测定结果箱线图
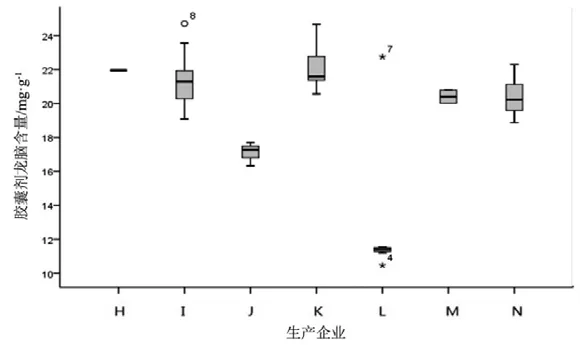
图11 胶囊剂龙脑测定结果箱线图
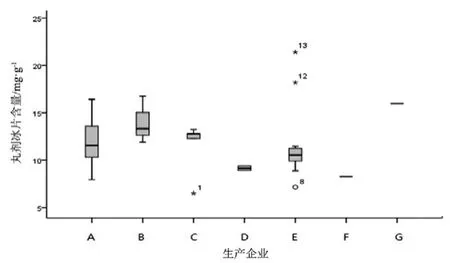
图12 丸剂冰片测定结果箱线图
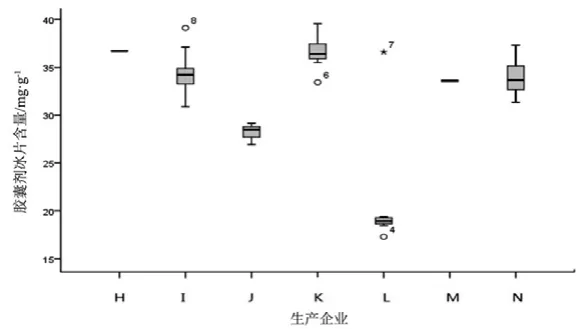
图13 胶囊剂冰片测定结果箱线图
2.10 结果分析
观察薄荷脑、龙脑和冰片3个指标成分的频数分布图(图2~7),均大致呈正态分布。观察3个指标成分的箱式分布图,分布状况基本一致,不同企业之间中位值差异较大,表明不同企业之间产品质量存在差异。部分企业不同批次之间测定结果的离散程度较高,说明该企业在生产工艺、原药材的质量控制以及贮存环境上存在一定的问题。
冰片、薄荷脑属挥发性药材,原料质量、制备过程、贮存等因素都会影响其含量。脑立清胶囊中冰片、薄荷脑为乙醇溶解后入药,未经受热,转移率高,结合药典中脑立清胶囊和冰片药材项下的既定限值,按薄荷脑转移率57 %、冰片转移率55 %计算限值。脑立清丸制备过程中经40 ℃干燥,对挥发性成分的转移率影响较大,结合药典中既定限值和标准制剂的实际转移率,按薄荷脑、冰片转移率12 %计算限值。脑立清片中冰片和薄荷脑受包合工艺、干燥等工艺的影响使转移率进一步降低,结合药典中既定限值和标准制剂的实际转移率,按薄荷脑、冰片转移率5 %计算限值。具体限值和脑立清各个剂型平均值见表3。
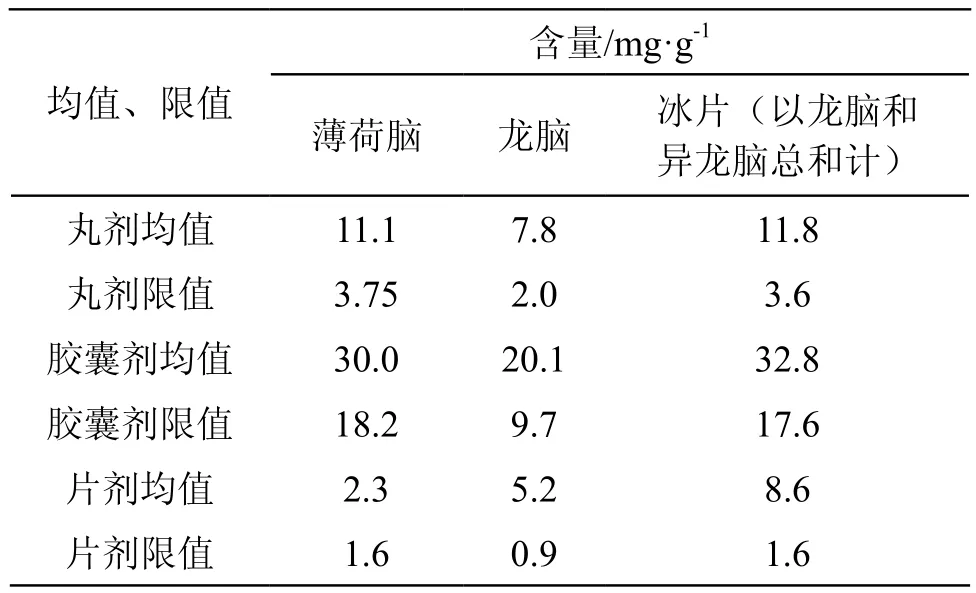
表3 脑立清制剂3种成分含量测定平均值统计表
比较均值与拟定的限度值,可看出3个指标成分结果较理想,含量限度值基本合理。各企业龙脑和冰片含量未出现不合格,有两家生产企业2批次样品(丸剂、片剂各1批)薄荷脑含量不合格,占总批次数的2.3 %。
3 讨论
目前,脑立清系列制剂标准不统一,脑立清丸对龙脑进行了定量控制,脑立清胶囊对龙脑及薄荷脑进行了定量控制,而脑立清片中无含量测定项目。且现行标准中脑立清丸和脑立清胶囊仅对冰片药材中龙脑进行了定量,单一龙脑无法客观反映冰片药材的整体质量,且部分企业为追求利润可能会存在用龙脑这一化合物代替冰片的风险,因此本文建立了GC法同时测定脑立清制剂中薄荷脑、龙脑、冰片(以龙脑和异龙脑总和计)这3种指标性成分含量,以全面客观的反映脑立清制剂中冰片、薄荷脑的质量。
冰片、薄荷脑属于挥发性药材,其原料质量、制备过程、贮存等因素都会影响其含量。脑立清制剂3种剂型因生产工艺存在较大差异,脑立清丸剂和片剂生产过程中都包括干燥环节,片剂还包括β-环糊精包合环节,工艺的差别影响了冰片、薄荷脑的含量,从而对药品的质量和疗效都会产生一定的影响。建议统一和完善脑立清3种剂型的质量标准,对处方中挥发性成分的含量进行全面评价,同时企业应加强对挥发性药材的原料管控,优化生产工艺,确保药品的质量,以保证广大人民群众用药安全。

