胰激肽原酶对他克莫司诱导肾损伤的保护作用*
张隆业 刘维萍 张彦芬 郭永力 管仁苹 邵雪 王兆宇 李灿
(1.秦皇岛市第一医院肾脏内科,河北 秦皇岛 066000;2.秦皇岛市第一医院药学部,河北 秦皇岛 066000;3.延边大学附属医院肾脏内科,吉林 延吉 133000)
他克莫司(tacrolimus, TAC)是一种广泛使用的维持性免疫抑制剂,但长期使用会引起相当大的肾毒性[1-4]。TAC造成不可逆的肾损伤与小动脉透明变性和增厚,血管收缩和缺血,间质纤维化,细胞凋亡和萎缩[5-6]。TAC诱导的肾毒性的发病机制仍不清楚,其分子机制可能与细胞凋亡、氧化应激、炎性介质等多种因素直接相关,往往各种机制间相互刺激相互协调,共同导致了肾毒性的发生[7-9]。胰激肽原酶(pancreatic kallikrein,PK)属于激肽释放酶-激肽系统类物质,在人体多个部位具有较强的表达能力,与血管中的活性物质相遇后会产生作用效应,对肾脏功能具有一定的调节作用。临床中使用的胰激肽原酶对慢性肾脏病具有良好的治疗效果,对糖尿病肾病、药物相关肾损伤以及肾病综合征均有保护作用。但对TAC诱导的肾损伤无明确作用,分子机制也无具体研究[10-11]。本课题通过对TAC诱导的肾小管上皮细胞来研究PK对其保护作用及相关机制。
1 材料与方法
1.1 HK-2细胞培养及分组 HK-2细胞使用培养基DMEM/F12加入10%胎牛血清(FBS)和1%双抗(P-S)青霉素100 U/mL+链霉素100 μg/mL,培养条件37℃、5%CO2。从液氮中取出HK-2的冻存细胞,迅速放置于37℃水浴箱中复苏细胞;离心管中准备适量培养液(8~10 mL),将HK-2细胞液移入离心管中;1000 rpm离心3 min,弃去上清,加入适量培养液制成细胞悬液,转移至培养皿中继续培养,在细胞呈单层生长达80%时则进行传代。收集对数生长期细胞制成细胞悬液,用细胞计数板对其进行计数,计算好铺板时每孔所需的细胞个数,用适当量的培养基液体加入,继续培养。将各组细胞按照1×104/孔的标准,在一致培养条件下,在96孔板上进行细胞接种。并在24小时内分别使用对应药物,然后将HK-2细胞划分为对照(CON)、TAC(50 μg/mL)、PK(6 pg/mL)、TAC+PK(6 pg/mL+50 μg/mL)组,第二天进行后续实验。
1.2 HK-2细胞活力检测 每个孔中加入的CCK-8溶液剂量为10 μL,相同条件孵育3 h,在450 nm吸光度条件测OD值。
1.3 HK-2活性氧检测 将各组细胞以2×105/孔接种于6孔板,在温湿度为37℃、5%CO2的环境下进行时长24 h的培养将10 μmol/L DCFH-DA染料滴注在6孔板细胞中,静待孵育30 min(温度为37℃);采用PBS对细胞进行清洁处理,滴注0.25%胰酶消化,在离心机上进行3次重悬;采用PBS再次清洗细胞,过滤废弃液体。采用流式细胞仪观察1 mL PBS稀释细胞颗粒团活力。
1.4 免疫印迹法检测 采用免疫印迹法检测4组细胞,LC3B、Bcline、Bcl-2、Bax蛋白表达水平。
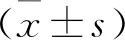
2 结果
2.1 四组HK-2细胞活力比较 与CON组比较,发现TAC组的细胞活力快速下降(P<0.05);TAC+PK组细胞活力较高,且显著大于TAC组(P<0.05),见图1。

图1 四组HK-2细胞活力测定
2.2 四组HK-2细胞的ROS比较 在细胞ROS表达能力的检测方面,将二氯二氢荧光素双醋酸盐(DCFH-DA)荧光检测法与流式细胞法进行组合使用。TAC组的细胞ROS表达能力要显著优于CON组、TAC+PK组 (P<0.05),见图2、3。

图2 四组的细胞ROS数量对比分析

图3 四组HK-2的ROS生成量
2.3 四组HK-2细胞蛋白水平比较 与CON组相比,TAC组LC3B-Ⅱ表达增加(P<0.05);与TAC相比,TAC+PK组LC3B-Ⅱ表达减少(P<0.05);与CON组相比,TAC组Beclin表达增加(P<0.05);与TAC相比,TAC+PK组Beclin表达减少(P<0.05),见图4。与CON组相比,TAC组肾小管细胞中Bcl-2/Bax比值降低(P<0.05);与TAC组相比,TAC+PK组Bcl-2/Bax比值升高(P<0.05),见图5。

图4 肾组织细胞的LC3B/Beclin蛋白ROS能力监测及蛋白表达对比分析

图5 四组细胞的Bcl-2、Bax蛋白表达及检测值分析
3 讨论
PK抗氧化功能与自噬的自我保护功能已经被多位学者提及[12-13]。Hisamura等[14]通过大量研究证实TAC对于细胞的ROS表达具有正向的促进作用,能够抑制细胞组织中的氧化磷酸化反应过程,提高氧化反应的抵抗能力和防御能力,使抗氧化应急反应水平下降,最终造成近端的小管细胞产生炎性反应或逐渐凋亡。Zhou等[15]研究发现TAC对细胞的死亡具有诱导作用,且细胞的ROS表达能力和TAC剂量存在显著的相关性,细胞中滴注氧化氢酶、N-乙酰半胱氨酸之后,实现了TAC介导过程的抑制,使细胞ROS下降,TAC对细胞死亡的诱导能力下降。本文通过研究证实了TAC组细胞ROS水平与细胞活力水平存在负相关性,即细胞活力较高时,细胞的ROS较低,反之则较高;通过对细胞的PK干预使细胞活性能力得到提高,ROS显著下降。上述结果表明TAC可通过促进细胞氧化应激反应,PK可以显著抑制TAC诱导的氧化应激反应进一步保护HK-2细胞。
肾小管上皮细胞的代谢效率会随着肾脏氧气消耗速度的加快而同步提高,细胞的自噬有对肾小管细胞环境稳定性、细胞活力水平、细胞生理功能等方面具有正向的激励作用。有研究证实细胞自噬现象对肾功能药物损伤、糖尿病肾病、梗阻性肾病均具有良好的保护作用[16]。同时,在开展体外组织细胞培养实验的过程中,采用免疫印迹法对HK-2细胞中的LC3B表达功能和Beclin表达功能进行检测,发现TAC组的LC3B-Ⅱ表达功能和Beclin表达功能均有所提高,PK组的LC3B-Ⅱ和Beclin表达功能有所下降。在电子显微镜的观察下,HK-2细胞免疫印迹结果和肾小管上皮细胞的自噬体形成过程具有较高的一致性。Lim等[17]在研究中发现TAC诱导引发的损伤主要是因为白蛋白运行阻力增大、细胞自噬空泡量增加,溶酶体出现损伤。在电子显微镜下的典型表现为近端小管中有大量自噬空泡,肾组织与肾小管的P62水平升高、Beclin蛋白表达能力升高、LC3BⅡ/Ⅰ比值显著增大,Klotho基因治疗可以通过提高溶酶体活力促进改善TAC诱导的的自噬体的清除障碍,减少超负荷蛋白及自噬空泡的聚集,进一步调节自噬发挥肾脏保护作用,与本研究结果具有较高的相似性。研究有发现非急性CsA肾损伤与自噬空泡数量增多,以及自噬清除功能衰退存在显著的相关性,典型特征为自噬空泡数量异常,LC3B-Ⅱ和Beclin的表达数量显著增多。自噬清除减少则表现为P62表达增加,使用肾脏保护药物干预后自噬功能障碍可明显改善[18]。Xu等[19]通过电子显微镜观察高糖培养液中的 HK-2 细胞变化,发现细胞数量增长速度较快,且Beclin表达能力下降,但LC3B-Ⅱ表达能力增强、P62水平显著下降。
细胞自噬现象对肾脏损伤造成的影响备受研究者们的重视,现有的研究结果尚不统一。研究报道指出,自噬在各种原因造成的肾功能损伤中,均能够发挥一定的肾组织功能保护作用[20],但是目前尚无关于直接提高自噬的方法来证明自噬的作用报道,通过进一步的研究,PK有望成为改善自噬的重要手段。对细胞凋亡或坏死具有影响作用的因素较多。有文献报道,TAC通过细胞凋亡诱导细胞死亡[21-22]。考虑到上述PK对细胞活力的保护作用,本课题组对PK与HK-2细胞凋亡的相关性进行了分析和探讨,并运用免疫印迹检测法对细胞凋亡的分子表达进行检测,发现TAC组的Bcl-2表达有所下降,Bax的表达有所增强,TAC+PK组Bcl-2表达显著高于TAC组,Bax表达较低。体外研究结果显示,肾组织细胞凋亡与ROS密切相关[23],TAC诱导的大鼠肾损伤模型在出现肾小管细胞凋亡的同时出现肾氧化应激水平增高,凋亡增加同时伴随着氧化应激水平的进一步增高,凋亡和氧化应激水平的此种同向变化提示TAC诱导的肾小管上皮细胞凋亡增加( Bcl-2蛋白表达的减少及Bax的增多)可能与其下调氧化应激反应增强有关。本次研究发现LC3B-Ⅱ体内实验与体外实验结果截然相反,目前考虑与肾组织细胞群体的不均一性,Beclin、P62等指标相互影响作用及细胞外因素(激素水平、离子浓度等)作用有关,尚有待进一步研究。但二者之间是否存在因果关系,其具体作用通路如何,尚有待进一步研究。
4 结论
胰激肽原酶对他克莫司诱导肾小管上皮细胞具有保护作用,其机制与胰激肽原酶抑制抗氧化应激及调节自噬有关。

