原发免疫性血小板减少症激素敏感与抵抗者血清蛋白质组学的研究
张扬 白菊 张王刚 何爱丽
(西安交通大学第二附属医院血液科,陕西 西安 710004)
原发免疫性血小板减少症(primary immune thrombocytopenia ,ITP)是一组获得性免疫介导的单独血小板过度破坏所致的出血性疾病[1]。ITP的一线治疗方案为糖皮质激素(泼尼松或地塞米松),有效率为70%~80%,长期有效率为30%~50%,治疗的预期效果很大程度上取决于糖皮质激素敏感与否,目前还缺乏统一的定义和评判标准;经验是足量治疗3~4周,如果泼尼松标准剂量治疗4周无效则定义为糖皮质激素抵抗[2]。目前实验室尚无特异性的指标及分子标志物来早期区分是否激素治疗有效,4周的激素治疗对激素抵抗患者并不能获益,延误治疗时机的同时还要承受着激素相关的副作用,如感染、高血压、高血糖、溃疡、股骨头坏死、肥胖等等。ITP患者糖皮质激素抵抗的机制复杂且与多种因素相关,但目前只是从某一角度着手进行的研究[3-5]。抵抗机制不仅是基因水平的改变,也涉及到蛋白质层次的,特别是蛋白质信号分子的改变,因此,从蛋白水平和整体角度研究寻找糖皮质激素抵抗与糖皮质激素敏感的差异蛋白是可能的[6-7]。不同功能表面的磁珠蛋白分离联合基质辅助激光解吸电离飞行时间质谱技术(Matrix assisted laser desorption/ionization time of flight laths spectrometer,MALDI-TOF-MS)及Cliprotools所组成的CLIPROT系统是集分离、纯化、检测和分析于一体的全新富有特色的蛋白组学技术,在实体瘤和耐药机制研究中广为应用[8-11]。本实验中我们通过该技术对ITP患者血清样本中不同蛋白质标志物分离纯化,进一步应用质谱技术分析获取血清蛋白质表达谱,以寻找差异表达的蛋白质,以期为临床早期判断ITP患者糖皮质激素治疗有效与否提供依据。
1 资料与方法
1.1 一般资料 收集 2016年3月~2017年3月西安交通大学第二附属医院住院患者共 60 例 ITP 血清样品,收集初入院未使用任何药物时的外周血血清。所有患者均符合国内 ITP 的诊断标准[12],随访4周,按临床诊疗效果分组:①糖皮质激素敏感组:完整激素治疗4周后(泼尼松1 mg/kg,疗效稳定后逐渐减量) PLT≥30×109/L且大于基线水平2倍,共32例,其中男性14例,女性18例,中位年龄44.5(18~75)岁。②糖皮质激素抵抗组:完整激素治疗4周后,PLT<30×109/L或不足基线2倍或者有活动性出血,共28例,其中男性10例,女性18例,中位年龄37.5(19~70)岁。
1.2 标本的采集和处理 采集患者空腹时外周血3 mL,置于无抗凝剂的干燥管中,室温静置1 h,离心机室温离心10 min(600g),离心结束后吸取血清部分,0.5 mL/管分装3管,-80℃冰箱冻存备用。
1.3 试剂与仪器 基质、无水乙醇、丙酮、弱阳离子交换磁珠试剂盒均购自美国布鲁克·道尔顿公司。200 μL的Orcugen样品管购自西安博精生物技术有限公司。CLINPROT系统为美国布鲁克·道尔顿公司产品,包括磁珠分离器、基质辅助激光解吸离子飞行时间质谱仪(MALDI-TOF-MS,Microflex)、Anchorchip靶、Clinprotools2.2、FlexControl2.2采集软件、分析软件Flexanalysis3.0。母液配置:基质α-氰基-4-羟基肉桂酸(a-Cyano-4-hydroxycinna- mic acid,HCCA)1.2~1.4 mg,加入1~1.2 mL丙酮稀释制成1.2 mg/μL的HCCA母液。母液可在-20℃保存2 d。无水乙醇(1∶2)混合均匀即得0.4 mg/mL HCCA的基质溶液,基质溶液当天配置当天使用。
1.4 样本的制备 室温下溶解冻存的外周血清标本。
1.4.1 运用弱阳离子交换磁珠结合血清蛋白 将磁珠试剂盒自4℃冰箱取出,手动上下摇动完全混匀其中的弱阳离子磁珠悬浮液1 min,取10 μL 磁珠结合缓冲液(BB)加入200 μL Orcugen样品管中,再加入10 μL 磁珠至样品管,用加样枪吸打混匀,避免起泡;然后向Orcugen样品管中加5 μL血清,用加样枪吸打至少5 次使其混匀,避免起泡;室温静置5 min;将Orcugen样品管放入磁珠分离器。完全混匀磁珠试剂盒中的弱阳离子磁珠悬浮液,在200 μL Orcugen管中加入10 μL磁珠结合缓冲液和10 μL磁珠,混匀后再加入5 μL血清标本,混匀,室温静置5 min后放入磁珠分离器,贴壁1 min,吸去悬浮的液体后加入100 μL磁珠清洗缓冲液,静置,磁珠与液体分离后吸去悬浮的液体,完全吸干净悬浮的液体后取下样品管,加入5 μL磁珠洗脱缓冲液,混匀磁珠,放入磁珠分离器,贴壁2 min,将上清移至已加入5 μL稳定缓冲液的0.5 mL样品管,混匀。
1.4.2 Microflex MALDI-TOF质谱分析 Anchorchip靶板上点1 μL洗脱样品,室温干后,点1 μL基质(已提前制备),室温干,靶板放入Microflex质谱仪中,标准品校正后检测样本,使用FlexControl 2.2软件采集数据,收集范围700~10000 Da,获得不同质荷比(mass charge ratio,m/z)的蛋白峰构成的质谱图。
1.5 统计学分析 使用ClinProTools软件分析数据,统计学分析采用软件自带的统计学算法,P<0.05为差异有统计学意义。
2 结果
2.1 应用Clinprot系统模拟分析激素敏感组和激素抵抗组激素治疗前的血清指纹图 将采集软件采集到的血清图谱经基线消减、校正和归一后导入分析软件,激素抵抗组和激素敏感组激素使用前血清的质谱结果分析结果,见图1。通过ClinProtools2.2软件对两组血清样品的质谱数据进行对比分析,在分子量700~10000 Da的范围内共得到41个差异蛋白质表达峰,但差异均无统计学意义(均P>0.05)。
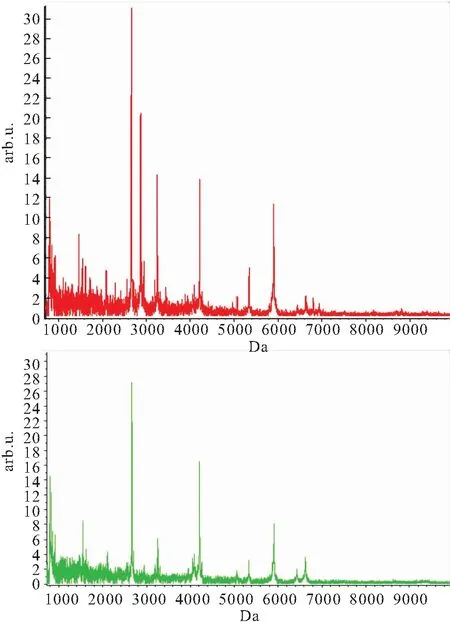
图1 应用Clinprotools 2.2软件模拟和分析激素抵抗组和激素敏感组激素使用前血清蛋白质指纹图谱
2.2 应用Clinprot系统模拟分析激素敏感组激素使用前后血清指纹图 将采集软件采集到的血清图谱经基线消减、校正和归一后导入分析软件,对激素敏感组激素使用后和激素敏感组激素使用前血清的质谱结果分析,见图2。通过ClinProtools 2.2软件对这两组血清样品的质谱数据进行对比分析,在分子量700~10000Da范围内共得到55个差异蛋白质表达峰,其中5个有统计学意义的差异蛋白质峰(P<0.05),激素使用后表达上调的蛋白质有4个,下调的有1个(表1)。

图2 应用Clinprotools 2.2软件模拟和分析激素敏感组激素使用前后血清蛋白质指纹图谱

表1 激素敏感组激素使用前后差异表达蛋白质
2.3 应用Clinprot系统模拟分析激素抵抗组激素使用前后血清指纹图 将采集软件采集到的血清图谱经基线消减、校正和归一后导入分析软件,对激素抵抗组激素使用前后血清的质谱结果(图3)。通过ClinProtools 2.2软件对这两组血清样品的质谱数据进行对比分析,在分子量700~10000 Da范围内共得到56个差异蛋白质表达峰,但差异均无统计学意义(均P>0.05)。

图3 应用Clinprotools 2.2软件模拟和分析激素抵抗组激素激素使用前后血清蛋白质指纹图谱
3 讨论
除了运用在肿瘤的早期诊断中外,蛋白组学方法也广泛地应用于耐药研究中;几乎所有的病理生理过程中,药物和环境因子的作用都依赖于蛋白质,并引起相应蛋白质的变化,同时蛋白质组的变化也能提供该过程变化的信息[13-15]。在疾病出现明显的症状前都会有一些蛋白质发生变化,寻找这些与疾病相关的蛋白,对发病机制的阐明,建立诊断模型,研究疾病的耐药机制具有重要意义。Feng等[16]通过蛋白组学的方法研究甲氨蝶呤的耐药发现二氢叶酸脱氢酶(DHFR) 在甲氨蝶呤的耐药中起很大作用。Woronieck等[17]通过蛋白组学方法发现,4144 Da的分子是区分儿童肾病综合征糖皮质激素抵抗与糖皮质激素敏感的最有意义的蛋白质分子。黄艳军等[18]通过2-D凝胶电泳联合MALDI-TOF-MS的方法发现了儿童微小病变型肾病综合征患者激素敏感与抵抗相关的12个差异蛋白,与激素敏感蛋白图谱比较,在激素耐药蛋白图谱上蛋白酶抑制剂、α1B糖蛋白、IRAK4 表达下调,其余9 种蛋白表达上调。潘艳艳等[13]在MALDI-TOF-MS方法及双向电泳发现,肾病综合征中的激素耐药组和激素敏感组的儿童尿液中具有12个差异表达的蛋白存在,其中包括尿液中α1-抗胰蛋白酶和转铁蛋白。本研究治疗前激素抵抗和激素敏感患者血清蛋白指纹对比未得到具有统计学意义的差异蛋白,考虑可能与样本量不足相关,或者是差异蛋白的分子量不在700~10000 Da范围内。
激素敏感患者激素治疗前后的血清蛋白指纹图谱相比较,在激素敏感组激素使用后表达上调的蛋白质有4个,分子量分别为9289.84、4644.96、7764.95和4964.12 Da,下调的有1个,分子量为6666.94 Da。激素抵抗患者激素治疗前后的血清蛋白指纹图谱相比较,未得到具有统计学差异的蛋白。由此可以推测,激素的效应最终可能作用于血清中,引起了血清中蛋白的变化,使得血小板数值最终升高。
将激素敏感前后比较得到的差异蛋白峰与我们前期实验中ITP和健康对照比较得到的差异蛋白峰相比较,发现其存在极为相似的分子量,激素敏感组前后比较得到的蛋白相对分子量4644.96 Da,峰均值在激素使用前后分别为1.05和2.4,使用后较前上调,ITP标志蛋白中也存在分子量为4644.92 Da的蛋白,峰均值在ITP组和健康对照中分别为1.17和2.18[19],若推测这2个蛋白为同一蛋白,则此蛋白在ITP患者中较正常者下调,但经过激素治疗后上调至接近正常者水平,则可认为其与ITP的发病和激素的作用密切相关。同理,还有相对分子量7764.95和7764.78 Da,4964.12和4964.36 Da,均在ITP患者中表达较正常下调,经过激素治疗后上调至接近正常者水平。其中7764.95 Da,与血小板第4因子(PF4)7800 Da极为接近,因一个氨基酸的相对分子量为75~220 Da之间,推测此蛋白是PF4因子,PF4由激活的血小板分泌,在巨核细胞中合成的贮存于a-颗粒中的大分子蛋白聚糖,具有中和肝素,炎症趋化,抑制血管形成和巨核细胞生长的功能[20-21]。细胞因子是参与骨髓造血的重要的调控因子,有研究认为PF4是巨核细胞和血小板生成的调控因子,与巨核细胞的增殖、成熟和分化密切相关,但具体的调控机制还不清楚[22-25]。这3个蛋白与ITP的发病和糖皮质激素的作用可能相关,有待加大样本量,对其进行验证以及纯化,进一步鉴定并分析其功能,对ITP的发病机制和糖皮质激素的作用机制有着重要意义。
4 结论
激素敏感者治疗前后存在5个差异表达的蛋白,可能与ITP的激素治疗效果密切相关。

