EphrinB2对TNF-α作用下的脐静脉内皮细胞与牙髓干细胞血管生成的影响
黄雨亭 沈帅 蒋鹏飞 潘爽
中图分类号:R329.2 文献标志码:A doi:10.3969/j.issn.1001-3733.2021.06.009
龋病、外伤、磨损等所引起的牙髓炎和根尖周炎是口腔常见疾病,目前临床上主要的治疗方法为根管治疗。但是,这种治疗无法恢复牙齿活力,牙齿因缺少牙髓组织的营养供应而变脆,从而增加劈裂的风险[1-2]。近年来,随着组织工程技术的发展,利用组织工程原理再生牙髓组织是治疗牙髓病及根尖周病理想的方法之一,其中血管再生是维持牙髓样组织长期稳定的关键,对维护牙齿的生理机能具有重要意义[3-4]。有文献报道血管内皮生长因子(vascular endothelial growth factor,VEGF)家族和eph家族都在血管形成过程中发挥较大作用。eph-ephrin信号通路包括ephs及其相应的配体ephrins,其中膜结合蛋白EphrinB2配体和ephb4受体被特异性地认为是血管发生中的关键调节剂[5],EphrinB2可以稳定小管样结构的形成[6]。有研究表明hDPSCs与HUVECs直接共培养时,hDPSCs中EphrinB2或者ephb4的敲除显著抑制内皮发芽,导致毛细血管发芽减少[7];另外有研究表明HUVECs与过表达EphrinB2的根尖乳头干细胞共同培养可加速血管生成,产生灌注量更大的血管[8]。
肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)是炎症发生的早期标志因子,可以激活并调控多种细胞内信号通路,低剂量的TNF-α可诱导体内和体外血管生成[9]。本课题组前期研究表明TNF-α可促进共培养体系体外血管生成能力,Western blot证明实验组较对照组VEGF表达显著较高[10],但EphrinB2是否在这一过程中发挥作用尚不明确。因此,本实验目的是探究EphrinB2对TNF-α作用下的HUVECs与hDPSCs体外共培养系统中血管生成的影响。
1 材料与方法
1.1 主要仪器与试剂
DMEM高糖培养基(Hyclone,USA);胎牛血清、青霉素/链霉素(双抗)、0.25%胰酶/EDTA(Gibco,USA);ECM培养基(Scien Cell,USA);BCA试剂盒(武汉博士德);EphrinB2、ephb4一抗(Abcam,USA);7500 荧光定量PCR仪(ABI,USA);凝胶图像分析仪(UVP,USA);PMC-860低速离心机(TOMY,日本)等。
1.2 hDPSCs的分离和培养、HUVECs的培养
经哈尔滨医科大学附属第一医院伦理委员会审核通过[批号:2019JS16(研201935)]并经患者知情同意,在临床上收集16~25 岁成人因正畸拔除的健康前磨牙或第三恒磨牙。无菌条件下取出牙髓,采用酶消化法分离培养hDPSCs[11-12],传代培养至第2代。本实验所用HUVECs(CRL-1730)购自美国ATCC细胞库。2~4代的hDPSCs 、HUVECs用于后续实验。
1.3 Western blot检测不同浓度TNF-α对共培养细胞EphrinB2表达的影响
胰酶分别消化hDPSCs和HUVECs,用混合培养液(ECM∶DPSCM=1∶1)重悬细胞,将其调整为3×105个/孔的单细胞悬液,将各组细胞混匀后轻轻接种在6 孔板中,待细胞完全贴壁后,随机分别用TNF-α(0~80 ng/mL)处理9 h,加入裂解液(RIPA∶PMSF=100∶1),冰上裂解30 min,提取细胞总蛋白。BCA 法进行蛋白浓度测定。用10%Tris-甘氨酸SDS聚丙烯氨酸凝胶电泳后,采用湿转法转至PVDF膜上,5%脱脂奶粉室温下封闭1 h,孵育一抗EphrinB2(1∶500),β-actin(1∶1 000),置于4 ℃冰箱过夜后加入辣根过氧化物酶标记的山羊抗兔多克隆二抗体,室温孵育1 h,使用ECL发光试剂盒显影,获得图像后采用Image J软件进行灰度值分析,β-actin为内参。
1.4 沉默实验
1.4.1 慢病毒感染hDPSCs细胞 胰酶消化hDPSCs以2×105个/孔接种于6 孔板中,常规条件下培养24 h,约30%~50%细胞融合时,采用特异性沉默EphrinB2的慢病毒(苏州赛业生物)转导hDPSCs,实验设置3 个靶点以及空白对照组(Blank)与空载体对照组(Control)5 组,分别以数字标记靶点,分别是靶点1192,靶点1193,靶点1194。转导hDPSCs 6~12 h,直至细胞出现毒性反应,除去慢病毒培养基并用新鲜的培养基代替终止转染。加入1 μg/mL嘌呤霉素用于选择稳定转导的hDPSCs,直到可见耐药菌落,使用荧光显微镜观察转导组荧光表达情况,培养至72 h提取蛋白,转导结束后,Western blot检测转导沉默效率,方法如前述。
1.4.2 体外小管形成实验 20 ng/mL的TNF-α被用于下述实验,实验分为:TNF-α+HUVECs +hDPSCs,HUVECs+EphrinB2-shRNA-hDPSCs,TNF-α+HUVECs+EphrinB2-shRNA-hDPSCs 3 组。实验前一天,将Matrigel胶(BD Biosciences,美国)置于4 ℃冰箱备用。于预冷的96 孔板中,每孔加入60 μL Matrigel胶(缓慢加入,避免气泡产生),37 ℃孵箱内放置1 h。胰酶分别消化hDPSCs/病毒转导的hDPSCs、HUVECs,用混合培养液(ECM∶DPSCM=1∶1)重悬将其调整为1.5×104个/mL的单细胞悬液,将各组细胞混匀后轻轻接种在预先涂有Matrigel胶的96孔板中,同时给予不同浓度(0,20 ng/mL)的TNF-α处理,37 ℃孵育,于第12小时镜下观察小管形成形成情况并拍照记录,使用Image J软件测量比较各组随机5 个视野中小管形成的相对长度和分支点数目。
1.4.3 Western blot检测各组EphrinB2的表达 实验分为:TNF-α+HUVECs+hDPSCs,HUVECs+EphrinB2-shRNA-hDPSCs,TNF-α+HUVECs+EphrinB2-shRNA-hDPSCs 3 组,胰酶消化细胞,用混合培养液(ECM∶DPSCM=1∶1)重悬将其调整为2×105个/孔的单细胞悬液接种于6孔板中,同时给予不同浓度(0、20 ng/mL)的TNF-α处理,37 ℃孵育,于第9小时提取细胞总蛋白,Western blot检测EphrinB2的表达,方法同前。
1.5 统计学分析
数据采用 GrapPad prism 7软件进行独立样本T检验和单因素方差分析。所有实验独立重复3 次,P<0.05认为差异有统计学意义。
2 结 果
2.1 不同浓度的TNF-α对EphrinB2表达的影响
共培养体系加入不同浓度(0~80 ng/mL)的TNF-α,Western blot检测EphrinB2的蛋白表达水平发现在加入20 ng/mL的TNF-α共培养组,EphrinB2蛋白表达水平较空白对照组显著上调(P<0.001)(图1)。
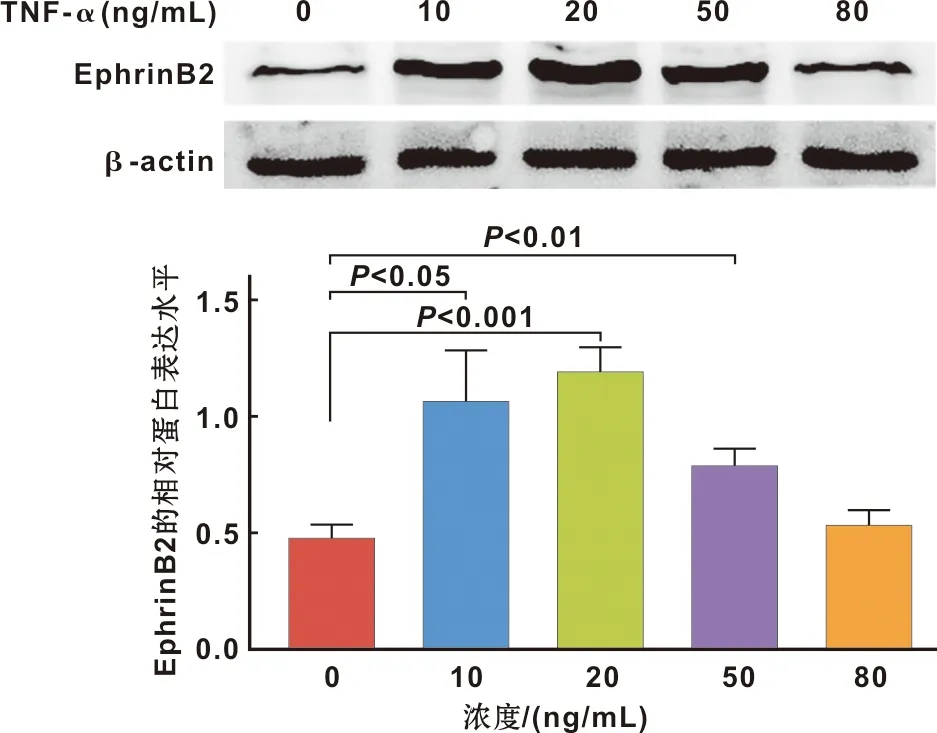
图1 不同浓度的TNF-α作用下EphrinB2表达水平
2.2 慢病毒转导hDPSCs及转导结果
2.2.1 hDPSCs转导沉默EphrinB2基因的慢病毒载体 荧光显微镜观察到增强绿色荧光标记的靶点1194转导后的hDPSCs;Western blot结果显示靶点1194组hDPSCs中EphrinB2的表达受到明显抑制(P<0.000 1)(图2)。
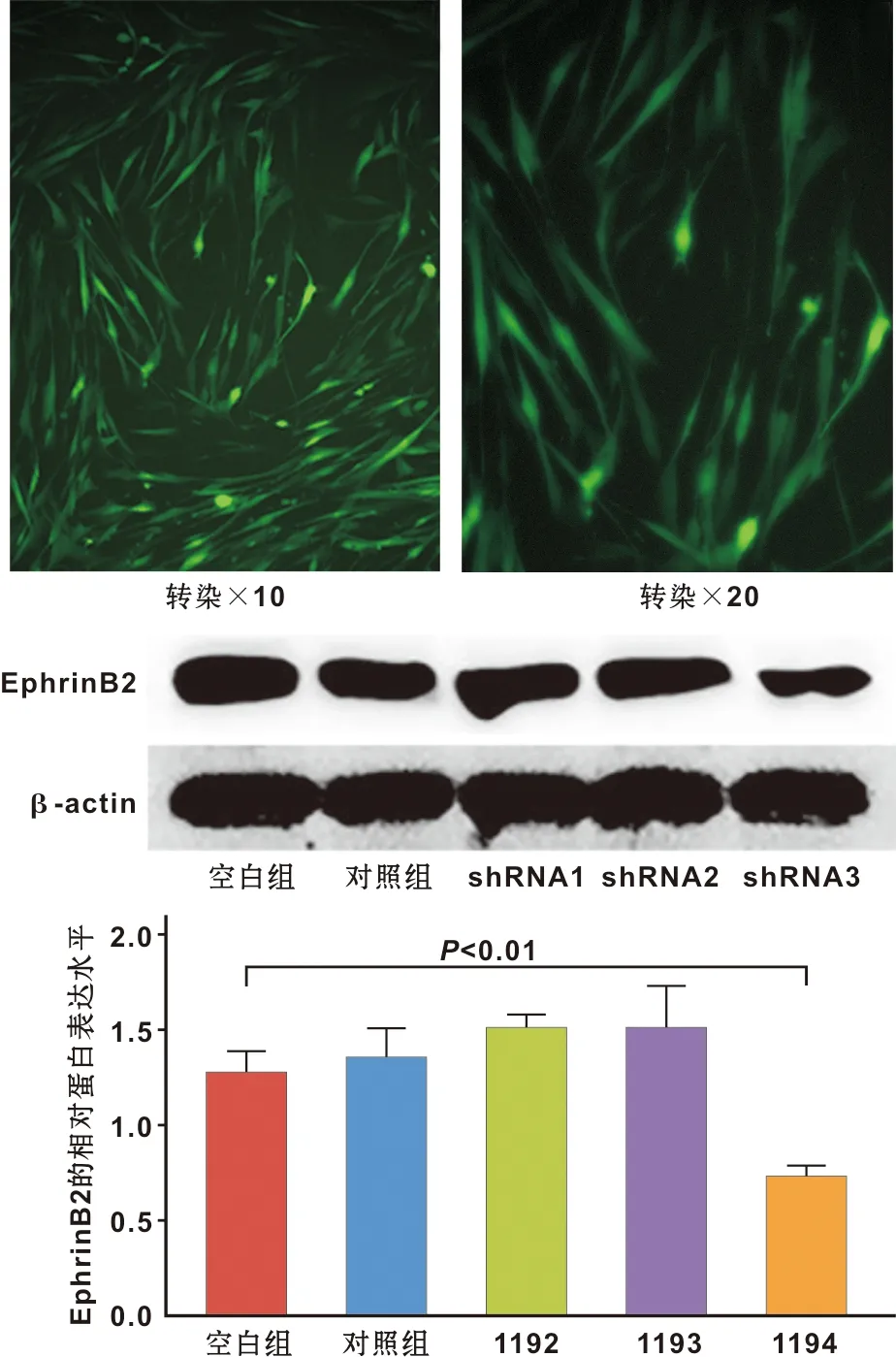
图2 慢病毒载体包裹的EphrinB2转导牙髓干细胞
2.2.2 体外小管形成实验 通过比较小管相对长度、分支点数进行实验分析。小管形成实验结果中灰色图像为普通图像,增强的绿色荧光图像代表shRNA转导后的hDPSCs,荧光未显影组代表未用shRNA处理hDPSCs组。结果显示,共培养第12小时,HUVECs+EphrinB2-shRNA-hDPSCs组小管已经塌陷裂解,与HUVECs+EphrinB2-shRNA-hDPSCs组相比,TNF-α+HUVECs+EphrinB2-shRNA-hDPSCs组小管的相对长度较长,相对分支点较多。与TNF-α+HUVECs+hDPSCs组相比,HUVECs+EphrinB2-shRNA-hDPSCs组和TNF-α+HUVECs+EphrinB2-shRNA-hDPSCs组小管的相对较短(图3)。
2.2.3 Western blot 检测各组EphrinB2的蛋白表达结果 与TNF-α+HUVECs+EphrinB2-shRNA-hDPSCs组和HUVECs+EphrinB2-shRNA-hDPSCs组相比,TNF-α+HUVECs+hDPSCs组 EphrinB2、ephb4的蛋白表达较高。与HUVECs+EphrinB2-shRNA-hDPSCs组相比,TNF-α+HUVECs+EphrinB2-shRNA- hDPSCs组的EphrinB2和ephb4蛋白的表达较高(图4)。
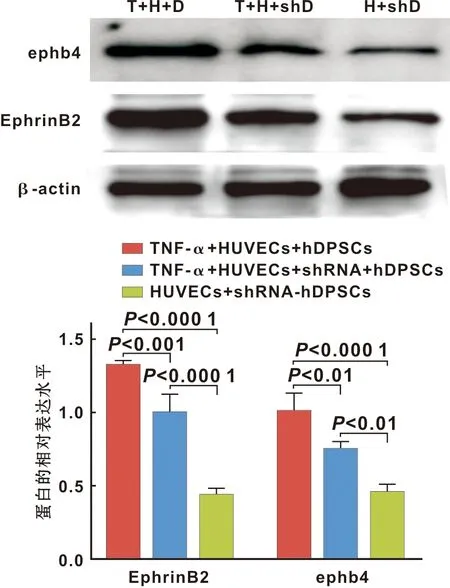
图4 Western blot分析EphrinB2、ephb4的蛋白表达结果
3 讨 论
组织工程技术是一种相对较新的多学科方法,旨在利用细胞、支架和生长因子的组合来再生受损、患病或丧失的组织,并恢复或改善其功能。牙髓含有血管、神经和结缔组织,对牙齿起到营养、修复等作用[13]。目前,利用组织工程的方法再生牙髓组织能够克服传统根管治疗带来的折裂的风险,有望降低牙齿缺失的发生率[13-14]。
有研究表明hDPSCs与HUVECs共培养可促进血管形成[15-16],hDPSCs具有较强的增殖能力、自我更新能力及多向分化潜能[17],hDPSCs释放的营养因子能够提高HUVECs的存活和分化,从而触发明显的血管生成[18]。而局部微血管网络的快速生成是牙髓组织再生成功的关键,可以给细胞提供足够的氧气和营养[16-17,19]。
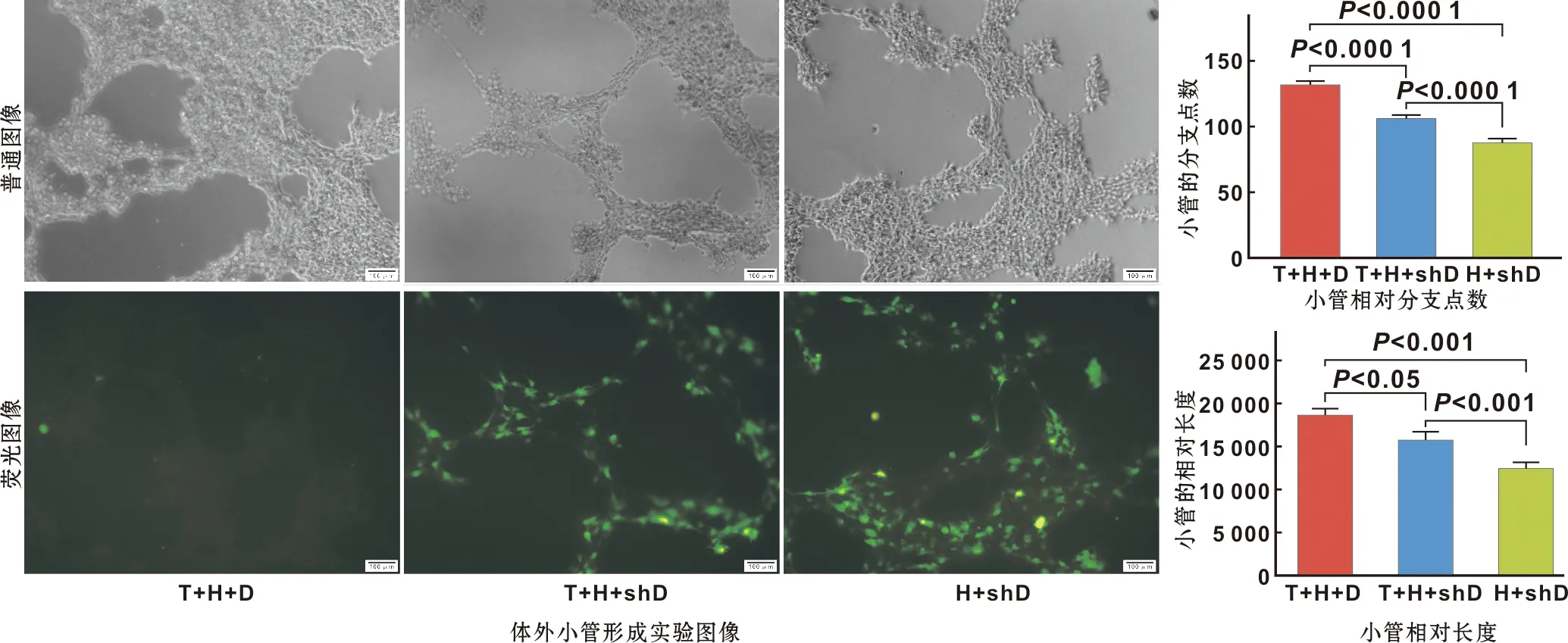
T: TNF-α 20 ng/mL; H: HUVECs; D: hDPSCs; shD: EphrinB2-shRNA-hDPSCs
低剂量的TNF-α可诱导体内、体外血管生成[9],该途径通过旁分泌和/或自分泌机制调控[20],并受到各种血管生成因子的影响。本课题组前期实验表明在HUVECs与hDPSCs共培养体系中加入TNF-α可促进 HUVECs和hDPSCs共培养系统形成更广泛、稳定的血管样网格结构,并且延长了这些小管结构的分解时间和VEGF蛋白的表达。
因本实验主要研究血管稳定性,通过Western blot灰度分析适宜EphrinB2的TNF-α的最佳浓度,发现20 ng/mL的TNF-α与空白对照组相比更能促进EphrinB2的表达(图1)。因此,20 ng/mL的TNF-α被用于后续实验,随后用特异性沉默EphrinB2基因的慢病毒小发夹RNA(shRNA)转导hDPSCs后,通过荧光显微镜观察增强的绿色荧光代表的沉默图像,通过Western blot检测转导效率,靶点1194与空白对照组相比EphrinB2表达显著降低,表明病毒转导成功(图2)。血管样网格结构的形成与稳定性实验和蛋白免疫印迹分析结果表明,加入TNF-α组的hDPSCs未沉默组较组加入TNF-α的hDPSCs沉默组小管更稳定且完整,加入TNF-α的hDPSCs沉默组又较不加TNF-α的hDPSCs沉默组小管稳定且完整,EphrinB2和ephb4表达也较高(图3)。
综合以上研究,显示低浓度的TNF-α(20 ng/mL)可以通过激活EphrinB2/ephb4通路逆转共培养体系沉默hDPSCs的EphrinB2引起的小管的裂解,从而促进小管的形成与稳定,但是如何在体内应用 TNF-α促进牙髓再生中的血运重建,仍需要进一步探索。

