穴位注射联合可待因片治疗中央型肺癌咳嗽的疗效评估
刘露 钱小军 李纪煌 袁明华 谢绍华
[摘要] 目的 通過比较穴位注射、可待因片以及穴位注射联合可待因片三种不同治疗方式对中央型肺癌引起咳嗽的治疗效果及安全性。 方法 收集2018年1月至2021年1月宜春市人民医院呼吸与危重医学科60例诊断为中央型肺癌患者,随机分为可待因组、穴位注射组、可待因+穴位注射组,每组各20例。经过三种治疗方式后,通过比较治疗前、治疗5 d后、治疗10 d后行咳嗽问卷评分,包括莱斯特咳嗽问卷、咳嗽特异性生活质量问卷、咳嗽视觉模拟量表、咳嗽症状评分;血清SP-D水平及PARC/CCL-18趋化因子。 结果 治疗5、10 d后,三组患者咳嗽问卷评分、咳嗽特异性生活质量问卷评分较治疗前有所升高,三组患者咳嗽视觉模拟量表评分及咳嗽症状评分较治疗前有所降低,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射组咳嗽问卷评分、咳嗽特异性生活质量问卷评分及咳嗽视觉模拟量表评分明显低于可待因组,可待因+穴位注射组咳嗽问卷评分、咳嗽特异性生活质量问卷评分及咳嗽视觉模拟量表评分明显高于穴位注射组和可待因组,差异有统计学意义(P<0.05)。治疗5、10 d后,穴位注射组咳嗽症状评分明显高于可待因组,可待因+穴位注射组咳嗽症状评分明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。治疗5、10 d后,三组血清肺表面活性蛋白D(SP-D)较治疗前明显下降,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射组血清肺表面活性蛋白D(SP-D)明显高于可待因组,可待因+穴位注射组血清肺表面活性蛋白D(SP-D)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。治疗5、10 d后,三组肺部活化调节趋化因子(CCL18)较治疗前明显下降,差异有统计学意义(P<0.05);治疗5 、10 d后,穴位注射组肺部活化调节趋化因子(CCL18)明显低于可待因组,差异有统计学意义(P<0.05);治疗5 d后,可待因+穴位注射组肺部活化调节趋化因子(CCL18)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05);治疗10 d后,可待因+穴位注射组肺部活化调节趋化因子(CCL18)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。 结论 中央型肺癌咳嗽与PARC/CCL-18趋化因子、血清SP-D有关,穴位注射联合可待因组治疗效果优于可待因组和穴位注射组。
[关键词] 穴位注射;可待因片;中央型肺癌;咳嗽
[中图分类号] R259.3 [文献标识码] B [文章编号] 1673-9701(2021)28-0054-05
Efficacy evaluation of acupoint injection combined with codeine tablets in the treatment of cough with central lung cancer
LIU Lu QIAN Xiaojun LI Jihuang YUAN Minghua XIE Shaohua
Department of Respiratory and Critical Care Medicine,Yichun People's Hospital in Jiangxi Province,Yichun 336000,China
[Abstract] Objective To compare and evaluate the therapeutic effect and safety of three different treatment methods of acupoint injection,codeine tablets,and acupoint injection combined with codeine tablets on cough caused by central type lung cancer. Methods A total of 60 patients with central lung cancer diagnosed in the Department of Respiratory and Critical Care Medicine of Yichun People's Hospital from January 2018 to January 2021 were collected and randomly divided into the codeine group,the acupoint injection group,and codeine combined with acupoint injection group,with 20 cases in each group. After three treatments,the scores of the cough questionnaire before treatment,5 days after treatment,and 10 days after treatment,including Leicester Cough Questionnaire,Cough Specific Quality of Life Questionnaire,Cough Visual Analog Scale,Cough Symptom Score,serum SP-D level and PARC/CCL-18 chemokine were compared. Results 5 d,10 d after treatment,the scores of Leicester Cough Questionnaire and Cough-Specific Quality of Life Questionnaire among the three groups were higher than those before the treatment,the scores of Cough Visual Analog Scale and Cough Symptom Score among the three groups were lower than those before the treatment,with significant differences (P<0.05). 5 d,10 d after treatment,the scores of Leicester Cough Questionnaire,Cough-Specific Quality of Life Questionnaire and Cough Visual Analog Scale in the acupoint injection group were lower than those in the codeine group,and the above scores in the acupoint injection combined with codeine group were higher than those in the acupoint injection group and the codeine group, with significant differences (P<0.05). 5 d,10 d after treatment,the scores of Cough Symptom Score in the acupoint injection group were higher than those in the codeine group,and the scores of Cough Symptom Score in the acupoint injection combined with codeine group were lower than those in the acupoint injection group and the codeine group, with significant differences (P<0.05). 5 d,10 d after treatment,the level of serum SP-D among the three groups were lower than those before the treatment, with significant differences (P<0.05). 5 d,10 d after treatment,the level of serum SP-D in the acupoint injection group were higher than those in the codeine group,and the level of serum SP-D in the acupoint injection combined with codeine group were lower than those in the acupoint injection group and the codeine group, with significant differences (P<0.05). 5 d,10 d after treatment,the level of serum PARC/CCL-18 chemokines among the three groups were lower than those before the treatment, with significant differences (P<0.05). 5 d,10 d after treatment,the level of serum PARC/CCL-18 chemokines in the acupoint injection group were lower than those in the codeine group,with significant differences (P<0.05). 5 d after treatment,the level of serum PARC/CCL-18 chemokines in the acupoint injection combined with codeine group were lower than those in the acupoint injection group and the codeine group, with significant differences (P<0.05). 10 d after treatment,the level of serum PARC/CCL-18 chemokines in the acupoint injection combined with codeine group were lower than those in the acupoint injection group and the codeine group, with significant differences (P<0.05). Conclusion Central lung cancer cough is related to PARC/CCL-18 chemokine and serum SP-D. The therapeutic effect of acupoint injection combined with codeine group is better than that of codeine group.
[Key words] Acupoint injection;Codeine tablets;Central lung cancer;Cough
原发性支气管癌(简称肺癌),是一种起源于支气管腺体或黏膜的恶性肿瘤,其主要包括小细胞肺癌和非小细胞肺癌[1]。肺癌是一种发病率高、死亡率高的恶性肿瘤,是中国常见的恶性肿瘤[2]。明确肺癌诊断需要细胞和组织病理学依据。通过影像学检查肺癌分为早期肺癌、细支气管-肺泡细胞癌、中央型肺癌和周围性肺癌[3]。肺癌常见的症状包括咳嗽、咯血、消瘦、乏力、短气、胸痛等,患者最早出现症状为咳嗽[4]。47%~86%肺癌患者伴随咳嗽症状[5]。肺癌咳嗽原因主要有两类:一类是原发肺癌引起的早期咳嗽,症状为少痰的咳嗽,或无痰的刺激性干咳,后期表现为刺激性咳嗽,听诊为金属音,是由于肿瘤阻塞气道造成气道狭窄。二类是肺癌经过手术后,或肿瘤经过放、化疗后出现的咳嗽,原因多为体质虚弱后感染引起。本研究目的通过比较穴位注射、可待因片以及穴位注射联合可待因片三种不同治疗方式对中央型肺癌后咳嗽的治疗效果及安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2021年1月宜春市人民医院呼吸科病理诊断为肺癌,通过影像学检查诊断为中央型肺癌患者60例。其中男36例,女24例,年龄32~75 岁,中位年龄58岁。将60例中央型肺癌患者按照随机化分组原则分为可待因组、穴位注射组及可待因+穴位注射组,每组各20例。纳入标准:①原发疾病均经病理组织病理证实者;②均为原发性肺癌,无伴随其他部位恶性肿瘤及严重的心、脑、肝、肾疾病者;③研究前均拒绝接受化疗、放疗、靶向、免疫等相关治疗者。排除标准:①合并肺部感染(包括真菌、结核杆菌、非结核杆菌、病毒、支原体、衣原体等)咳嗽者;②药物过敏者;③精神病者;④病情危急,对治疗的安全性和有效性造成干擾者;⑤无法耐受腕踝针、体针、头针、穴位注射疗法者。观察中止标准:①拒绝合作、临床依从性不配合、医生多次解释仍不配合者;②研究期间出现病情逐渐恶化,需立即采取紧急治疗者;③由于各种理由要求退出研究者;④已超过1/2疗程应进入研究统计者。本研究已获得医院医学伦理委员会批准,患者及其家属均知情同意。
1.2 方法
1.2.1 可待因组 口服磷酸可待因片(国药集团工业有限公司,国药准字H20103357,10#/2板)1片/次,3次/d[6]。
1.2.2 穴位注射组 取双侧足三里穴,暴露并指切患者穴位留痕后,用75%酒精棉球常规消毒,术者作自我手部消毒后,用5号注射器垂直刺入穴位1.5~2.0 cm,用强刺激法使患者有酸胀感后,抽吸无回血,缓慢注入0.9%生理盐水注射液2 mL;再取双肺俞穴,大致方法同双足三里,需注意的是,对准肺俞穴呈15°角斜刺入0.5~0.8 cm,进针避免直刺,深度不能超过2 cm;再取双侧定喘穴,大致方法同双足三里,需注意对准定喘穴呈90°直刺1.2~2.0 cm;再取双侧大杼穴,大致方法同双足三里,需注意呈30°角度直刺1.2~2.0 cm,本经背部诸穴,不易深刺,以免伤及内部重要脏器;再取双侧风门穴,大致方法同双足三里,需注意呈70° 1.2~2.0 cm。每日1次,10次为1个疗程。
1.2.3 可待因+穴位注射组 服药方法同可待因组,穴位注射法同穴位注射组。
1.3观察指标及评价标准
1.3.1 临床症状 治疗前、治疗5 d后、治疗10 d后行咳嗽问卷评分,包括莱斯特咳嗽问卷[7-9]、咳嗽特异性生活质量问卷[10]、咳嗽视觉模拟量表[11-13]及咳嗽症状评分[14]。
1.3.2 实验室检查 检测三组血清肺表面活性蛋白D(SP-D)和肺部活化调节趋化因子(CCL18)水平,晨起空腹经肘静脉采血约3 mL,3000 r/min离心10 min,取上清液置于-20℃待测;按试剂盒说明书于治疗前后采用酶联免疫吸附法检测。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据分析。计量资料以均数±标准差(x±s)表示,组内前后比较采用配对t检验,组间比较采用单因素方差分析;计数资料以[n(%)]表示 ,组间比较采用χ2检验。运用双侧检验,α=0.05 设定为检验标准,P<0.05为差异有统计学意义。
2 结果
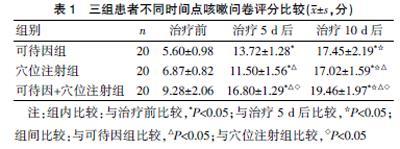
2.1 三组患者不同时间点咳嗽问卷评分比较
治疗5、10 d后,三组患者咳嗽问卷评分较治疗前有所升高,差异有统计学意义(P<0.05);治疗5 、10 d后,穴位注射组咳嗽问卷评分明显低于可待因组,可待因+穴位注射组咳嗽问卷评分明显高于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表1。

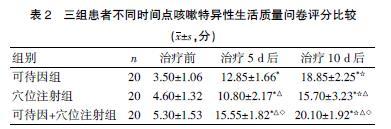
2.2 三组患者不同时间点咳嗽特异性生活质量问卷评分比较
治疗5、10 d后,三组患者咳嗽特异性生活质量问卷评分较治疗前有所升高,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射组咳嗽特异性生活质量问卷评分明显低于可待因组,可待因+穴位注射组咳嗽问卷评分明显高于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表2。

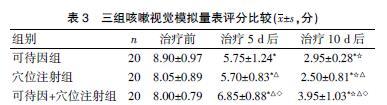
2.3 三组患者不同时间点咳嗽视觉模拟量表评分比较
治疗5、10 d后,三组患者咳嗽视觉模拟量表评分较治疗前有所降低,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射组咳嗽视觉模拟量表评分明显低于可待因组,可待因+穴位注射组咳嗽视觉模拟量表评分明显高于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表3。

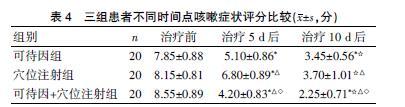
2.4三组患者不同时间点咳嗽症状评分比较
治疗5、10 d后,三组患者咳嗽症状评分较治疗前有所降低,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射組咳嗽症状评分明显高于可待因组,可待因+穴位注射组咳嗽症状评分明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表4。
2.5 三组患者不同时间点血清肺表面活性蛋白D(SP-D)和肺部活化调节趋化因子(CCL18)水平比较
治疗5、10 d后,三组血清肺表面活性蛋白D(SP-D)较治疗前下降,差异有统计学意义(P<0.05);治疗5、10 d后,穴位注射组血清肺表面活性蛋白D(SP-D)明显低于可待因组和可待因组,可待因+穴位注射组血清肺表面活性蛋白D(SP-D)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表5。
2.6 三组患者不同时间点肺部活化调节趋化因子(CCL18)比较
治疗5、10 d后,三组肺部活化调节趋化因子(CCL18)较治疗前下降,差异有统计学意义(P<0.05);治疗5 、10 d后,穴位注射组肺部活化调节趋化因子(CCL18)明显低于可待因组,差异有统计学意义(P<0.05);治疗5 d后,可待因+穴位注射组肺部活化调节趋化因子(CCL18)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05);治疗10 d后,可待因+穴位注射组肺部活化调节趋化因子(CCL18)明显低于穴位注射组和可待因组,差异有统计学意义(P<0.05)。见表6。
3 讨论
肺癌常伴有咳嗽症状,大多数为早期症状。据数据统计,47%~86%的肺癌患者伴随咳嗽症状,临床表现为无痰或少痰的刺激性干咳[15]。
中文版莱斯特咳嗽量表用于评估肺癌患者的咳嗽状况和生活质量情况。用于评估的疾病包括慢性、急性咳嗽以及慢性阻塞性肺疾病、肺癌等引起的咳嗽[16]。咳嗽特异性生活质量问卷是一项包括6个领域、28个条目的调查问卷,包括的领域为躯体不适、社会心理问题、极端躯体不适、自身健康焦虑、情感幸福及功能状况。咳嗽视觉模拟量表在慢性和急性咳嗽中表现为良好的可靠性、反应性和重复性,近期用于研究埃索美拉唑治疗慢性咳嗽及沙利度胺治疗特发性肺纤维化相关咳嗽患者的临床试验。咳嗽症状评分分为日间及夜间评分两部分[17],每部分均按照不同的严重程度划分为6个等级。该评分包括咳嗽的频率、强度以及咳嗽对生活质量影响的情况。不论成人或儿童,日间评分主要与咳嗽次数显著相关,但夜间评分反映咳嗽监测指标欠佳。本研究结果显示,穴位注射联合可待因组治疗效果优于穴位注射组(P<0.05);通过比较血清PARC/CCL-18趋化因子结果显示,治疗10 d后穴位注射联合可待因组PARC/CCL-18明显低于穴位注射组和可待因组(P<0.05)。
肺癌的发病机制是致癌物诱导的细胞基因损伤的多步骤过程,包括启动、促进和发展阶段[18]。肺癌发病率随着年龄增长逐步增长,以及吸烟者支气管上皮从不典型增生到原位癌的病理改变。有大量研究表明,具有致癌作用的因素包括烟雾中的尼古丁、苯并芘和放射性元素钋等,最常见的是鳞状上皮细胞癌和未分化小细胞癌[19]。有研究表明,烟雾中含有的成分均可引起细胞存活率降低、支气管炎症和细胞凋亡等。呼吸道受外界刺激后可引起呼吸道细胞损伤、细胞凋亡和炎症,如IL-6、SP-D、PARC/CCL-18等分泌参与自身免疫、炎症过程[20]。
肺部活化调节趋化因子/趋化因子配体18(PARC/CCL-18)又称趋化因子配体-18(CCL18)是一种在血清发现的肺部表达占相对优势的炎症蛋白。CCL18 mRNA在淋巴组织如淋巴结、胸腺和阑尾中低水平表达,在肺脏中呈持续高水平表达[21]。在多种肺部疾病中表现为CCL18 高水平表达,尤其是在肺癌或特发性肺纤维化疾病中,CCL18来源于淋巴细胞附近的间质炎症细胞[22-25],通过原位杂交和免疫组化技术体现。CCL18在抗炎和促炎等免疫系统的重要生理过程中,与肿瘤、过敏性疾病、COPD等密切有关。
肺组织分泌SP-D并参与肺部疾病发生时的机体炎症调节和免疫功能,故可作为肺部疾病的特异性标志物[26]。SP-D在阻止细菌及真菌感染、保护致癌物诱导细菌损伤等方面作用显著[27]。
综上所述,通过比较咳嗽问卷评分,包括莱斯特咳嗽问卷、咳嗽特异性生活质量问卷、咳嗽视觉模拟量表及咳嗽症状评分,可以比较可待因+穴位注射组、可待因组及穴位注射组治疗中央型肺癌后咳嗽的效果。中央型肺癌后咳嗽与血清PARC/CCL-18趋化因子、血清SP-D相关,主要考虑烟雾引起气道炎症,进一步影响炎症因子,但其具体作用机制需要进一步深入研究。
[参考文献]
[1] 钟南山,刘又宁.呼吸病学[M].北京:人民卫生出版社,2012:610.
[2] Werutsky G,Hochhegger B,Ant?觝nio LDFPJ,et al.PET-CT has low specificity for mediastinal staging of non-small-cell lung cancer in an endemic area for tuberculosis:A diagnostic test study[J].BMC Cancer,2019,19(1):5.
[3] 钟南山,刘又宁.呼吸病学[M].北京:人民卫生出版社,2012:616.
[4] 葛均波,钟南山,陆再英,内科学[M]. 8版.北京:人民卫生出版社,2013:75-76.
[5] Doyle D,Hanks GWC,MacDonald N,(eds):Oxford Textbook of Palliative Medicine,Oxford Univesity Press[M].Oxford,2004:995-1100.
[6] 國家药典委员会. 中国药典[M].北京:中国医药科技出版社,2010:65.
[7] Murray MP,Turnbull K,Mac Quarrie S,et al. Validation of the leicester cough questionnaire in noncystic fibrosisbronchiectasis[J]. Eur Respir,2019,34(1):125-131.
[8] Gao YH,Guan WJ,Xu G,et al.Validation of the Mandarin Chinese version of the Leicester Cough Questionnaire in bronchiectasis[J]. Int J Tuberc Lung Dis,2018, 18(12):1431-1437.
[9] Wang K,Birring SS,Taylor K,et al.Montelukast for postinfectious cough in adults:A double-blind randomised placebo-controlled trial[J].Lancet Respir Med,2019,2(1):35-43.
[10] Berkhof FF,Boom LN,Hertog NET,et al.The validity and precision of the Leicester Cough Questionnaire in COPD patients with chronic cough[J].Health Qual Life Outcomes,2018,10:4.
[11] Fletcher KE,French CT,Irwin RS,et al,A prospective global measure,the punun ladder,provides more valid assessments of quality of life than a retrospective transition measure[J].J Clin Epidemiol,2018,63(10):1123-1131.
[12] Shaheen NJ,Crockett SD,Bright SD,et al,Randomised clinicaltrial:High-dose acid suppression for chronic cough-a dounle-blind,placebo-controlled study[J]. Aliment Pharmacol Ther,2019,33(2):225-234.
[13] Horton MR,Santopietro V,Mathew L,et al.Thalidomide for the treatmeat of cough in idiopathic pulmonary fibrosis:A randomized trial[J].Ann Intern Med,2018,15(6):398-406.
[14] Baiardini I,Braido F,Fassio O,et al.A new tool to assess and nitor thw burden of chronic cough on quality of life:Chronic cough impact questionnaire[J].Allergy,2019,60(4):482-488.
[15] 钟南山,刘又宁.呼吸病学[M].北京:人民卫生出版社,2013:612.
[16] French CT,Irwin RS,Fletcher KE,et al. Evaluation of a cough specific quality-of-life questionnaire[J].Chest,2017,121(4):1123-1131.
[17] Sin DD,Miller BE,Duvoix A,et al. Serum concentrations and health outcomes in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2018,183(9):1187.
[18] Hsu JY,Stone RA,Logan-Sinclair RB,et al.Coughing frequency in patients with persistent cough:Assessment using a 24 Hour ambulatory recorder[J].Eur Respir,2019, 7(7):1246-1253.
[19] 葛均波,鐘南山,陆再英. 内科学[M]. 8版.北京:人民卫生出版社,2013:611.
[20] Strzelak A,Ratajczak A,Adamiec A,et al. Tobacco smoke induces and alters immune responses in the lung triggering inflammation,allergy,asthma and other lung diseases:A mechanistic review[J]. Int J Environ Res Public Health,2019,15(5):1033.
[21] Sethi S,Mahler DA,Marcus P,et al. Inflammation in COPD:Implications for management[J]. Am J Med,2019, 125(12):1162-1170.
[22] Sandhaus RA,Turino G. Neutrophil elastase-mediated lung disease COPD[J].Am J Med,2018,10(1):60-63.
[23] Makris D,Vrekoussis T,Izoldi M,et al.Increased apoptosis of neutrophils in induced sputum of COPD patients[J].Respir Med,2019,103(8):1130-1135.
[24] Bathoorn E,Liesker JJ,Postma DS,et al. Change in inflammation in out-patient COPD patients from stable phase to a subsequent exacerbation[J]. Int J Chronic Obstructive Pulmonary Disease,2019,102(4):101-109.
[25] Rinaldi M,Lehouck A,Heulens N,et al. Antielastin B-cell and T-cell immunity in patients with chronic obstructive pulmonary disease[J]. Thorax,2018,67(8):694-700.
[26] Bowler RP. Surfactant protein D as a biomarker for chronic obstructive pulmonary disease COPD[J]. Journal of Chronic Obstructive Pulmonary Disease,2012,9(6):651-653.
[27] Rinaldi M,Awasthi S.Surfactant protein (SP)-A and SP-D as antimicrobial and immunot-herapeutic agents[J].Recent Patents on Anti-infective Drug Discovery,2010, 5(2):115-123.
(收稿日期:2021-04-03)

