短期高盐饮食对过敏性哮喘小鼠气道炎症的影响
郭兴悦,李 琴,申云琴,田泽众,邹进超,杨 燕,陈彦球
(1.中山大学公共卫生学院,广东广州 510080;2.广东省营养与健康重点实验室,广东广州 510080;3.广东省营养转化工程技术研究中心,广东广州 510080;4.中山大学公共卫生学院(深圳),广东深圳 518000;5.中山大学附属肿瘤防治中心病案统计科,广东广州 510060;6.广州市妇女儿童医疗中心耳鼻喉科,广东广州 510623)
过敏性哮喘是一种慢性气道炎症性疾病,发病率逐年升高,难以治愈且容易反复发作,严重影响健康[1]。影响过敏性哮喘发生发展的因素有很多,如遗传因素、环境中的过敏原、感染、气候变化、睡眠、运动以及饮食等[2-3]。已有研究证明,饮食因素与过敏性哮喘发生发展有着密切的关联[4]。一项发表在《柳叶刀》杂志上的观察性研究发现,大多数国家人群平均每天的盐摄入量已经超过了WHO指南规定的限量5 g[5],因此,高盐饮食对机体健康与疾病的影响一直以来都是被关注的焦点。但是,关于高盐饮食对过敏性哮喘的作用,目前仅有呼吸道吸入的盐室治疗和部分观察性研究,且研究结论存在争议[6-9]。而通过膳食途径摄入高盐饮食作用于过敏性哮喘的动物体内干预实验,目前还尚未报道。因此,本研究拟通过对过敏性哮喘小鼠进行短期高盐饮食喂养,在体内初步探讨高盐饮食对过敏性哮喘小鼠气道炎症的作用,从而为过敏性哮喘的膳食防治提供新的思路和理论依据。
1 材料与方法
1.1 实验动物
20只4周龄SPF级BALB/c雌性小鼠,体质量13~17 g,购买于广东省医学实验动物中心,饲养于中山大学公共卫生学院SPF级动物房。动物实验操作符合中山大学动物实验伦理学规定,获得中山大学动物伦理委员会批准,许可证号:SYXK[粤]2017-0080。
1.2 主要试剂与仪器
AIN 93G普通饲料(NaCl浓度0.26%,江苏美迪森),NaCl(≥99.5%,北京凯国科技),卵清蛋白(ovalbumin,OVA,A5503纯度5级,Sigma),氢氧化铝(99.99%,阿拉丁),血钠浓度检测试剂盒(索莱宝),曾用五分类血球试剂包(迈瑞),流式细胞术抗体CD3e(PE-eFluor®610)、CD4(APC-eFluor®780)、CD8a(FITC)、IFNgamma(APC)、IL-17A(PE)、IL-4(PE-Cyanine7)、CD25(PE-Cyanine7)、IL-10(APC)、Foxp3(PE)(eBioscience),ELISA试剂盒IL-4、IL-17(美 国RD),IL-5、IL-13(eBiosci⁃ence),压缩空气式雾化器(江苏鱼跃),血液细胞分析仪(迈瑞-BC-5000V),贝克曼分析型流式细胞仪(CytoFLEX S),多功能微孔板检测仪(瑞士TE⁃CAN),倒置显微镜(Nikon)。
1.3 动物分组与处理
按随机数表法将20只小鼠随机分为4组(每组n=5):正常对照组(Control)、过敏性哮喘模型组(OVA)、4%高盐饮食组(4%high-salt diet,4%HSD)和8%高盐饮食组(8%high-salt diet,8%HSD)。过敏性哮喘小鼠具体造模方法为[10]:取40μg的OVA,4 mg氢氧化铝,并用PBS将终体积定容至200μL,于第0天、第7天和第14天在小鼠左下腹进行腹腔注射致敏。从第21天开始,配置5%的OVA溶液5 mL进行雾化吸入,随后用40 μg/μL的OVA溶液滴入小鼠鼻腔,每侧10μL。每天激发一次,连续5 d,正常对照组用等量PBS进行致敏和激发(图1A)。正常对照组和模型组给予普通饲料和饮水,高盐组分别给予4%和8%的高盐饲料以及1%的盐水。
1.4 一般情况效应指标
动物饲养过程中每天观察小鼠的一般状况,定期记录小鼠的摄食量、饮水量、体质量变化,以及激发前后的体质量差。末次激发后,同一时间内记录小鼠10 min的挠鼻次数。
1.5 样本采集和处理
末次激发24 h后,麻醉小鼠,拍照记录小鼠鼻部外观,心脏采集ACD抗凝血,取20μL血样测定血中各类炎症细胞的数量和百分比,其余血样离心处理得到血浆并保存在-80℃中待测。采血后以1 mL PBS行支气管肺泡灌洗得到肺泡灌洗液(bron⁃choalveolar lavage fluid,BALF),离心后上清冻存于-80℃冰箱用于细胞因子ELISA测定。随后取肺脏,右肺置于不完全培养基中用于流式检测,左上肺置于40 g/L多聚甲醛中固定用于后续组织病理学分析,左下肺冻存于-80℃用于其他指标检测。
1.6 肺组织病理学分析
小鼠左上肺用40 g/L多聚甲醛固定后,石蜡包埋,切片后行苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察气道炎症改变,计数支气管周围嗜酸性粒细胞数量;过碘酸-雪夫(peri⁃odic acid schiff,PAS)染色观察杯状细胞增生改变及气道黏液分泌水平,用ImageJ软件进行图像分析。
1.7 流式细胞术分析肺组织T细胞亚型
将新鲜的小鼠右肺剪碎,用DNA酶和胶原酶消化1 h后研磨得到单细胞悬液,加入细胞刺激剂于37℃,5%CO2培养箱中孵育5 h。随后使用相应抗体进行表面染色,破膜破核后继续进行胞内染色,洗涤后加入200μL BufferⅡ溶液重悬,上机检测,用Cyt Expert软件分析各类T细胞亚型结果。
1.8 血钠及细胞因子测定
微量法进行血浆钠水平的检测,用酶联免疫吸附试验方法(ELISA)测定BALF中细胞因子白介素(interleukin,IL)IL-4、IL-5、IL-13以及IL-17的水平,操作步骤按试剂说明书进行,用多功能微孔板检测仪进行结果读数。
1.9 统计学分析
所有研究数据采用SPSS 26.0软件进行统计学分析,统计图中计量资料以均数±标准误(mean±SEM)的形式表示,使用GraphPad Prism 5软件进行统计图的制作。由于本实验仅有一个干预因素,即高盐饮食,故各组定量资料都呈正态分布并且满足方差齐性时,多组计量资料采用单因素方差分析(One way ANOVA)检验方法进行分析,采用最小显著差法(least significant difference,LSD)检验进行两两比较;如果数据不满足方差齐性,多组比较采用Welch′s anova检验,随后的两两比较采用Games-Howell检验;当数据不满足正态性时,采用Kruskal WallisH检验进行分析,随后的两两比较采用Bonferroni法检验。统计分析采用双侧检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 各组小鼠摄食情况的比较
4%高盐饮食组小鼠的摄食量比其他三组偏高,但差异无统计学意义(P>0.05,图1B)。4%和8%高盐饮食组小鼠的饮水量均显著高于正常组和模型组(P<0.01,图1C)。4%和8%高盐饮食组小鼠的盐总摄入量均显著高于正常组和模型组(P<0.01),而8%高盐饮食组小鼠的盐总摄入量显著高于4%高盐饮食组(P<0.05,图1D)。

图1 小鼠摄食情况Fig.1 Food intakes changes of mice
2.2 高盐饮食调节小鼠体质量变化
在各组初始体质量、摄食量无差异的情况下,8%高盐组小鼠的终体质量明显低于其他三组(P<0.05,图2A);在激发后,除正常组外,其余三组小鼠体质量都发生了不同程度的下降,4%与8%高盐饮食虽略加重过敏性哮喘小鼠激发后体质量丢失的情况,但差异无统计学意义(P>0.05,图2B)。
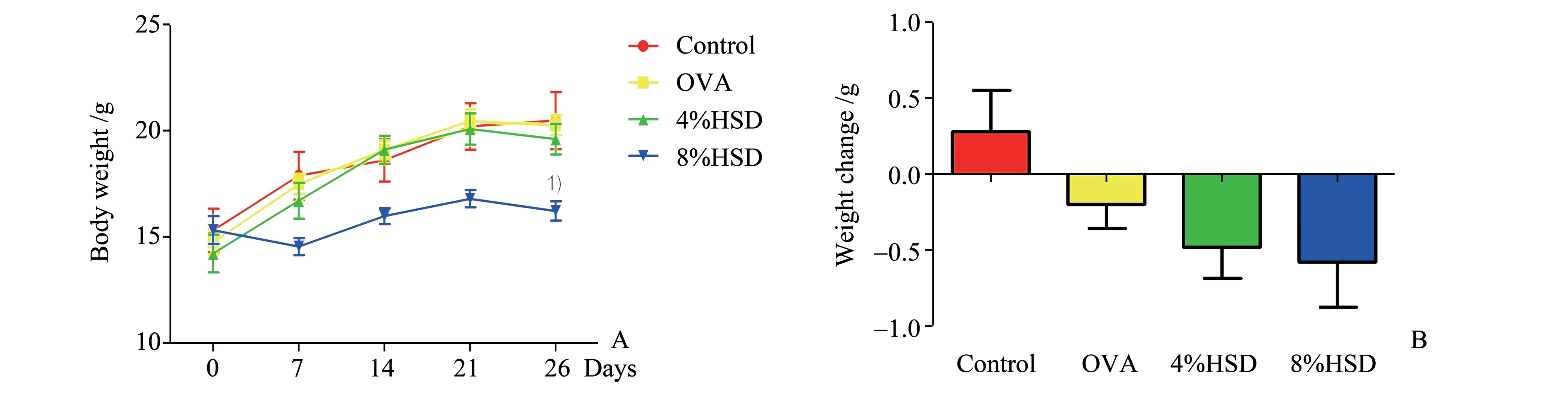
图2 高盐饮食对小鼠体质量变化的影响Fig.2 Effects of high-salt diet on body weight changes of mice
2.3 高盐饮食升高小鼠血钠水平
测量小鼠血浆钠水平发现,4%和8%高盐饮食组小鼠的血钠水平均显著高于正常组和模型组(P<0.01),8%高盐饮食组小鼠血钠水平显著高于4%高盐饮食组(P<0.01,图3)。

图3 高盐饮食对小鼠血浆钠水平的影响Fig.3 Effects of high-salt diet on plasma sodium levels of mice
2.4 高盐饮食缓解小鼠鼻部症状
末次激发后,正常组小鼠毛发光滑,活动正常,胡须完整,而模型组和4%高盐饮食组小鼠毛发散乱,反复挠鼻,烦躁不安,胡须明显稀少或短缺,8%高盐饮食组小鼠上述症状有明显缓解(图4A)。与正常组相比,模型组小鼠挠鼻频率显著升高(P<0.001),而8%高盐饮食组小鼠挠鼻频率显著下降(P<0.001,图4B)。

图4 高盐饮食对过敏性哮喘小鼠鼻部症状的影响Fig.4 Effects of high-salt diet on nasal symptoms of allergic asthmatic mice
2.5 高盐饮食调节小鼠血常规参数
各组小鼠血中总白细胞数、单核细胞比例、中性粒细胞比例、淋巴细胞比例以及嗜碱性粒细胞比例无显著差异(P>0.05,图5 A~C,E,G)。与正常组相比,血嗜酸性粒细胞比例以及嗜酸性粒细胞/淋巴细胞比值(ELR)在模型组中均显著升高(P<0.01),而4%与8%高盐饮食组小鼠嗜酸性粒细胞比例显著下降(P<0.05),仅4%高盐饮食组小鼠ELR值显著降低(P<0.05,图5 D,F)。8%高盐饮食组小鼠血红细胞数量明显低于4%高盐饮食组(P<0.01,图5 H)。与正常组相比,4%高盐饮食小鼠血小板明显升高(P<0.01,图5 I)。

图5 高盐饮食对过敏性哮喘小鼠血常规参数的影响Fig.5 Effects of high-salt diet on blood routine parameters of allergic asthmatic mice
2.6 高盐饮食改善小鼠肺部嗜酸性粒细胞浸润和杯状细胞增生情况
与正常组相比,模型组小鼠肺部嗜酸性粒细胞浸润程度以及杯状细胞分泌黏液显著增加(P<0.001),而仅8%高盐饮食组小鼠肺部嗜酸性粒细胞浸润程度显著下降(P<0.05),杯状细胞增生情况显著改善(P<0.001,图6A~D)。
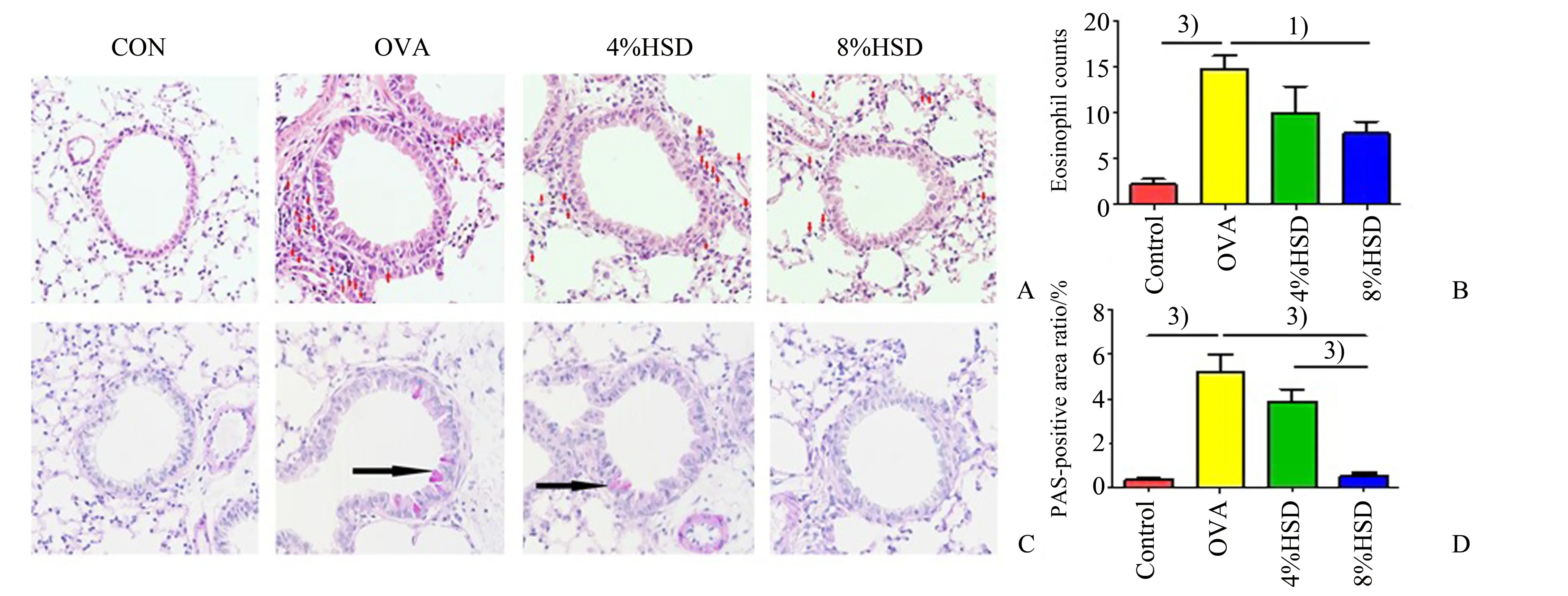
图6 高盐饮食对过敏性哮喘小鼠肺组织病理情况的影响Fig.6 Effects of high-salt diet on lung pathology of allergic asthmatic mice
2.7 高盐饮食调节小鼠肺组织各类T细胞亚型
结果显示,Th1细胞、Treg细胞比例及Th17/Treg细胞比值在各组间差异无统计学意义(P>0.05,图7 A,D,F)。与正常组相比,模型组小鼠肺组织Th2细胞、Th17细胞比例及Th2/Th1细胞比值均显著升高(P<0.01),4%与8%高盐饮食均可显著降低Th17细胞水平(P<0.01),而仅有8%高盐饮食可显著降低Th2细胞水平(P<0.05)及Th2/Th1细胞比值(P<0.01),4%高盐饮食虽有明显降低Th2细胞水平及Th2/Th1细胞比值的趋势,但差异无统计学意义(P>0.05,图7 B,C,E)。

图7 高盐饮食对过敏性哮喘小鼠肺组织各类T细胞水平的影响Fig.7 Effects of high-salt diet on T cell levels in lung tissues of allergic asthmatic mice
2.8 高盐饮食下调小鼠BALF中Th2与Th17细胞相关细胞因子水平
与正常组相比,模型组小鼠BALF中Th2细胞标志性细胞因子IL-4、IL-5、IL-13以及Th17细胞标志性细胞因子IL-17均显著升高(P<0.05),其中4%与8%高盐饮食均能显著降低IL-13与IL-17的表达水平(P<0.01),且8%高盐饮食降低IL-13水平的效果优于4%高盐饮食(P<0.01,图8 C,D),而仅有8%高盐饮食能显著降低IL-4与IL-5的表达水平(P<0.05),4%高盐饮食有降低IL-4与IL-5表达的趋势,但差异没有统计学意义(P>0.05,图8 A,B)。
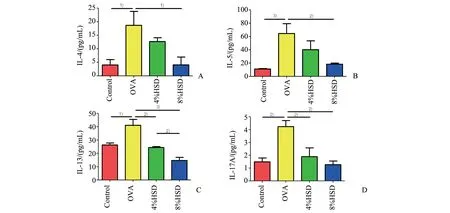
图8 高盐饮食对过敏性哮喘小鼠BALF中Th2与Th17细胞相关细胞因子水平的影响Fig.8 Effects of high-salt diet on Th2 and Th17 cytokines in BALF of allergic asthmatic mice
3 讨论
嗜酸性粒炎性细胞增多并伴有各种呼吸道症状是过敏性哮喘的主要特征[11]。本次研究发现,8%高盐饮食干预对过敏性哮喘小鼠症状发作与肺组织嗜酸性粒细胞浸润以及杯状细胞增生程度均有一定的缓解作用。另一方面,嗜酸性粒细胞以及嗜酸性粒细胞/淋巴细胞比值(eosinophil/lympho⁃cyte ratio,ELR)在预测哮喘气道炎症以及药物对嗜酸性气道炎症治疗反应上有着重要的意义[12]。本研究结果提示,高盐饮食可明显降低过敏性哮喘小鼠全血中的嗜酸性粒细胞比例以及ELR值,对过敏性哮喘小鼠体内的嗜酸性炎症有着明显的改善作用。Awobajo等[13]人也发现盐负荷大鼠血嗜酸性粒细胞计数明显下降,与本研究结果一致。气道高反应性是指气道对于正常不引起或仅引起轻度应答反应的刺激物出现过度的气道收缩反应,是过敏性哮喘的重要特征之一,本实验由于条件所限,未能测得该指标,值得在以后的实验研究中继续深入探讨。
过敏性哮喘的发病机制很复杂,目前比较公认的是与Th2与Th17免疫细胞过度分化,分泌细胞因子IL-4、IL-5、IL-13与IL-17增多,导致体内Th2/Th1与Th17/Treg细胞比例严重失调有关[14-15]。本研究表明,高盐饮食可以通过调节过敏性哮喘小鼠体内过度分化的Th2与Th17细胞及其分泌的细胞因子来改善过敏性气道炎症。一项体外实验研究也发现,用NaCl刺激可使原始T细胞分化成为Th2细胞的数量显著减少[16],与本实验的研究结果一致。而另一项研究表明,健康人体记忆T细胞在体外与50 mmol/L NaCl共孵育后,Th2标志性细胞因子IL-4和IL-13的产生增加,Th2分化增加[17];此外,高盐可能通过诱导Th17细胞增多加重实验性自身免疫脑脊髓炎和高血压[18],与本研究结果相反。Jobin等[19]综述了其他研究后表明,高盐饮食对免疫的影响取决于涉及的组织器官、免疫细胞类型、局部微环境以及机体疾病状态等,这或许可以解释高盐饮食在不同疾病模型中对同种免疫细胞的不同调节作用,具体机制还有待进一步研究。
目前高盐饮食对机体健康与疾病的作用有益还是有害尚存在争论。已有部分研究报道了高盐饮食对机体健康与疾病的有益作用,如高盐饮食可通过调节骨髓源性抑制细胞分化抑制小鼠肿瘤生长[20],抑制自发性中枢神经系统自身免疫疾病的小鼠自身免疫性疾病的发展[21],显著加快小鼠皮肤寄生虫感染的愈合速度[22]。我们本次研究也发现了高盐饮食对过敏性哮喘小鼠气道炎症改善的有益作用。当然,高盐饮食也有增加高血压、心血管疾病风险,加重肾脏负担,引发机体代谢功能紊乱等有害作用[23]。例如高盐饮食会导致小鼠大脑内皮功能障碍,大脑血流量减少,以及相关的认知能力下降[24]。围产期缺铁加上成年期高盐饮食可导致大鼠血管功能障碍[25]。高盐摄入还可引起循环代谢物的紊乱,包括肠道微生物、色氨酸、植物成分和γ-谷氨酰基氨基酸相关代谢物[26]。我们的研究也发现,两组高盐组都有加重过敏性哮喘小鼠激发后体质量下降的趋势,对过敏性哮喘小鼠机体代谢可能产生了一定的影响。在初始体质量、摄食量与其它3组无差异的情况下,8%高盐饮食组小鼠的终体质量明显低于其他三组,与Ferguson等[27]的研究结果类似。因此,高盐饮食在不同的疾病模型中可能会对机体产生不同的影响。针对如何在高盐饮食的情况下规避高盐带来的风险,有研究表明,在高盐饮食情况下,较高的钾、钙、维生素D、抗氧化维生素和富L-精氨酸的蛋白质的饮食摄入,对盐敏感人群是有益的;相反,与典型的西方饮食相似的饮食,富含饱和脂肪、蔗糖和果糖的饮食,再加上过量饮酒,可能会加剧盐敏感性的血压变化[28],如何在发挥高盐饮食对疾病有益作用的同时有效避免其对机体产生的不利作用,值得进一步探索。
研究表明,在OVA刺激后,雌性小鼠比雄性小鼠发展出更明显的过敏性气道炎症,造模成功率更高,因此通常用雌性小鼠建立过敏性哮喘小鼠模型[29]。此外,本研究所使用的高盐饮食剂量(4%HSD/8%HSD+1%NaCl饮水),为高盐饮食在动物实验中的常规使用剂量[18,27,30]。结果发现,4%高盐饮食组小鼠摄食量略高于其他三组,两组高盐组小鼠饮水量均显著高于正常组和模型组,与其他高盐饮食相关研究是一致的[20]。由于不同浓度的高盐饮食会对小鼠的摄食和饮水情况产生不同影响,因而最终的摄盐量可能并不会与饮食所含盐浓度成比例关系。经统计,4%高盐饮食组每只小鼠平均每天总摄盐量约为0.26 g,与其他研究结果相似[18]。8%高盐饮食组每只小鼠平均每天总摄盐量约为4%高盐饮食组的1.35倍,血钠浓度约为4%高盐饮食组1.12倍,与摄盐量比例相比有所下降,可能是由于8%高盐饮食组小鼠饮水量更多导致的血容量升高,血液稀释所致。
综上所述,本研究首次通过动物体内实验,初步证实了高盐饮食可以通过抑制嗜酸性粒细胞浸润,减少Th2、Th17细胞及其细胞因子的产生,缓解过敏性哮喘小鼠气道炎症,为过敏性哮喘营养膳食防治提供新的思路。而高盐饮食缓解过敏性哮喘的机制,仍需要进一步深入研究。

