肠炎沙门菌rfbG基因缺失株的构建及其生物学特性研究
王新为,宋 丽,王 铭,宋红芹
沙门菌病(Salmonellosis)是由沙门菌引起动物和人类急性和慢性疾病的总称。沙门菌(Salmonella)是一种革兰氏阴性菌,同时也是重要的食源性人兽共患病原菌,宿主谱广泛,且危害严重[1]。其中肠炎沙门菌可引起成年鸡隐性感染,并通过粪便向外界环境排菌,导致病原菌难以净化;受感染的雏鸡则表现为严重的全身性感染和高死亡率[2]。近年,有报道指出,肠炎沙门菌正逐渐替代鼠伤寒沙门菌成为最常见的食源性沙门菌血清型[3]。因此,加强肠炎沙门菌感染防控的研究势在必行。随着畜牧业的发展,抗生素的滥用,导致沙门菌耐药性增强,耐药谱加宽,给沙门菌的防控造成困难[4]。与亚单位疫苗和灭活疫苗相比,减毒活疫苗免疫原性好,是预防沙门菌病的重要手段[5]。
脂多糖(Lipopolysaccharide,LPS)作为革兰氏阴性菌菌体外膜结构的重要组成部分,主要影响沙门菌的表型、毒力及菌株间的免疫交叉反应[6-7]。LPS主要由O抗原、核心多糖以及类脂A组成[8]。参与LPS生物合成的相关基因主要为:rfa基因簇、rfb基因簇和rfc基因簇[9]。O抗原链的生物合成由rfb基因簇控制,其中rfbG基因负责编码CDP-glucose 4,6-dehydratase脱水酶[10]。研究表明,rfbG基因的失活会导致肠炎沙门菌LPS的缺失,且rfbG基因的缺失会降低菌株的毒力,其基因位点可作为细菌鉴别疫苗(Differentiation of Infected and Vaccinated Animals,DIVA)的潜在靶点。
本研究以肠炎沙门菌Z11为研究对象,通过无标记突变法,构建肠炎沙门菌Z11ΔrfbG缺失株,并研究其基本的生物学特性,包括菌株的生长速率、生化特性、生物膜形成能力以及细胞毒性等,为肠炎沙门菌减毒活疫苗的研究奠定基础。
1 材料与方法
1.1 质粒、菌株及细胞 菌株、质粒及细胞信息见表1。

表1 实验所用菌株、质粒及细胞Tab.1 Bacterial strains, plasmids and cells used in this study
1.2 主要试剂 DNA胶回收试剂盒、XbaI限制性内切酶、质粒纯化试剂盒、细菌基因组提取试剂盒、氯霉素(Cm)、DNA Marker、Primestar max DNA Polymerase均购自宝生物工程(大连)有限公司;ClonExpress One Step Cloning一步法连接试剂盒和2×Taq Master mix购自南京Vazyme生物科技有限公司;API 20E肠道菌鉴定卡购自法国Bio Mérieux公司;DMEM培养基、胎牛血清、0.25%胰酶购自美国ThermoFisher公司;快速质粒小提试剂盒、高效感受态细菌制备试剂盒及其他常规试剂购自生工生物工程(上海)股份有限公司;沙门菌属诊断血清试剂盒购自宁波天润生物药业有限公司;乳酸脱氢酶细胞毒性检测试剂盒购自上海碧云天生物技术有限公司。
1.3 引物设计与合成 根据肠炎沙门菌Z11的rfbG基因序列,运用引物设计软件Primer 5.0设计特异性引物,如表2所示。引物由南京擎科生物科技有限公司合成。

表2 PCR扩增引物序列Tab.2 Primers used for PCR in this study
1.4 肠炎沙门菌Z11ΔrfbG缺失株的构建
1.4.1 重组菌E.coliχ7213(pDM4-ΔrfbG)的构建 以肠炎沙门菌Z11基因组为模板,分别以rfbG-UP-F/R和rfbG-DOWN-F/R为引物,利用PCR扩增rfbG基因上下游同源片段,即rfbG-U和rfbG-D片段。利用XbaI限制性内切酶对pDM4载体进行酶切,用C115连接酶分别将rfbG-U和rfbG-D片段与pDM4载体连接,通过热激法将连接好的产物转入E.coliχ7213 λpir感受态中,以pDM4-F/R为引物对阳性单菌落进行PCR鉴定,并送至南京擎科生物科技有限公司进行测序,获得重组质粒pDM4-ΔrfbG,即获得供体重组菌E.coliχ7213(pDM4-ΔrfbG)。
1.4.2 接合转移与Z11ΔrfbG缺失株的筛选鉴定 以E.coliχ7213(pDM4-ΔrfbG)为供体菌,肠炎沙门菌Z11为受体菌进行接合转移。挑取阳性单菌落,以pDM4-F/rfbG-OUT-F和pDM4-R/rfbG-OUT-F两对引物分别进行PCR鉴定。将验证正确的阳性菌落接种于含Cm的LB液体培养基中,37 ℃培养。以1∶50扩大培养于含有15%蔗糖的LB液体培养基中,37 ℃培养。挑取菌液,三区划线于含有15%蔗糖的LB固体平板上,37 ℃培养。挑取阳性克隆制备模板,以rfbG-OUT-F/R为引物进行PCR鉴定。将验证正确的菌株以rfbG-IN-F/R为引物进行PCR鉴定,并将验证正确的菌株送至南京擎科生物科技有限公司进行测序。
1.5 肠炎沙门菌Z11ΔrfbG缺失株的生物学特性测定
1.5.1 生长速率测定 分别挑取野生株Z11和缺失株Z11ΔrfbG接种于LB液体培养基中,37 ℃培养。次日,将各菌液转入新的LB液体培养基中,并将转接后的菌液调至OD600=0.05(记作0 h读数)。分别将OD600为0.05的菌液转入96孔板中,用酶标仪检测OD600,每0.5 h测定1次,绘制生长曲线。
1.5.2 生化特性测定 分别挑取野生株Z11和缺失株Z11ΔrfbG接种于LB固体平板上,37 ℃培养。次日,挑取各菌株菌苔,分别搅拌混匀至含0.45%生理盐水的比浊管中,并将菌液比浊度调至0.6~0.8。根据使用说明书向生化鉴定卡中加入菌液,将API 20E生化鉴定卡置于37 ℃培养箱,24 h后观察并记录结果。
1.5.3 生物被膜形成测定 分别挑取野生株Z11和缺失株Z11ΔrfbG接种于LB液体培养基中,37 ℃培养。次日,将各菌液OD600值调为1后,加入到96孔板中,37 ℃静置培养48 h。将菌液弃掉,用超纯水洗涤;加入甲醇,固定一定时间,弃掉甲醇,晾干;加入结晶紫,染色一定时间,弃掉结晶紫;用超纯水洗涤,烘干;加入95%酒精溶解;用全自动酶标仪检测OD595,定量分析生物被膜形成情况。
1.5.4 粗糙表型鉴定 在载玻片上分别滴加20 μL O9单抗和吖啶橙,接种环挑取少许菌株分别与O9单抗和吖啶橙混合涂划均匀,观察凝集反应情况。
1.5.5 肠炎沙门菌Z11ΔrfbG缺失株的细胞毒性试验 将J774A.1细胞接种至48孔板,每孔加入1.5×105个细胞,培养至次日使细胞覆盖率为80%~90%。挑取野生株Z11和缺失株Z11ΔrfbG接种于LB液体培养基中,37 ℃培养。将菌液4 500 r/min离心5 min,弃去上清,用无菌PBS洗涤,再用无菌PBS重悬,将其OD600调为1。弃掉细胞培养液,换新鲜的无抗DMEM培养基,以MOI=100感染细胞。1 000 r/min离心10 min,37 ℃感染1 h。弃掉培养基,用PBS洗涤。加入含有20 μg/mL庆大霉素的Opti-MEM培养基,37 ℃培养3 h。利用乳酸脱氢酶细胞毒性检测试剂盒测定野生株与缺失株对J774A.1细胞的毒性。
1.5.6 统计学分析 本实验所有数据均使用GraphPad Prism 5软件进行分析统计学差异。检验水准α=0.05。
2 结 果
2.1 肠炎沙门菌Z11ΔrfbG缺失株鉴定
2.1.1 重组菌E.coliχ7213(pDM4-ΔrfbG)的构建及鉴定 以rfbG-UP-F/R和rfbG-DOWN-F/R为引物PCR扩增rfbG基因上下游同源片段(rfbG-U和rfbG-D片段),利用C115连接酶将rfbG-U和rfbG-D片段连接在pDM4载体上,再转入E.coliχ7213 λpir感受态细菌中,构建供体重组菌E.coliχ7213(pDM4-ΔrfbG)。以pDM4-F/R为引物进行PCR扩增,验证构建的的供体重组菌E.coliχ7213(pDM4-ΔrfbG),条带大小正确,约1 450 bp(图1)。
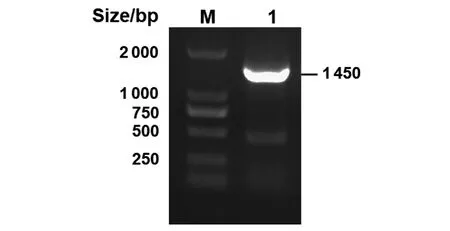
M:DL2000 Maker;1:rfbG基因上下游同源片段图1 重组质粒PCR验证Fig.1 PCR identification of E. coli χ7213(pDM4-ΔrfbG)
2.1.2 接合转移与ΔrfbG缺失株的筛选鉴定 以野生株Z11作为受体菌,重组菌E.coliχ7213(pDM4-ΔrfbG)作为供体菌进行接合转移,在含有Cm和DAP的LB固体平板上,挑取阳性单菌落,以pDM4-F/rfbG-OUT-F和pDM4-R/rfbG-OUT-F两对引物分别对其进行PCR鉴定。对验证正确的菌株以含有15%蔗糖平板进行负筛,以rfbG-OUT-F/R为引物进行PCR验证,获得候选缺失株约1 343 bp(图2)。以rfbG-IN-F/R,不能扩增出条带(图3)。结合测序结果,确定rfbG基因缺失株已构建成功,即获得缺失株Z11ΔrfbG。

M:DL5000 Maker;1-4:野生株;5:候选缺失株图2 筛选缺失株PCR验证Fig.2 PCR identification of screening deletion strains
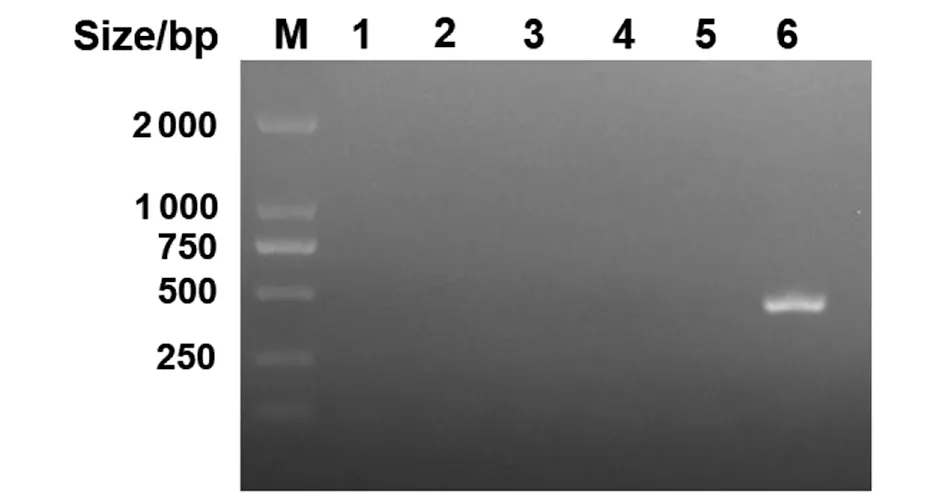
M:DL2000 Maker;1-5:Z11ΔrfbG缺失株;6:野生株图3 缺失株PCR验证Fig.3 PCR identification of deletion strains
2.2 肠炎沙门菌Z11ΔrfbG缺失株的生物学特性测定结果
2.2.1 生长速率 利用全自动酶标仪,在设定的时间点测定各菌液OD600值,从而绘制生长曲线(图4),结果显示野生株生长速率高于缺失株。
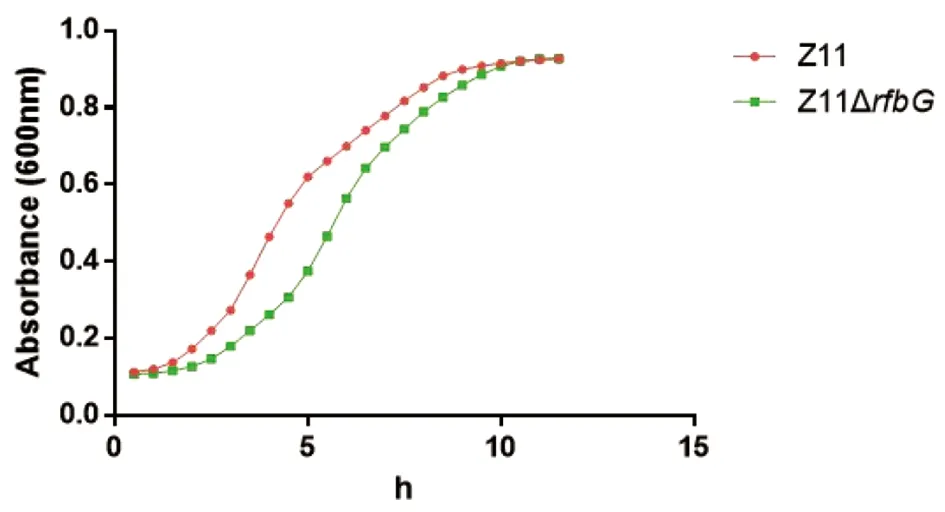
图4 Z11和Z11ΔrfbG生长曲线Fig.4 Growth curves of Z11 and Z11ΔrfbG
2.2.2 生化特性 野生株Z11和缺失株Z11ΔrfbG通过API 20E生化鉴定卡进行生化特性鉴定,结果显示rfbG基因的缺失对肠炎沙门菌Z11生化特性的主要指标并无影响(表3)。
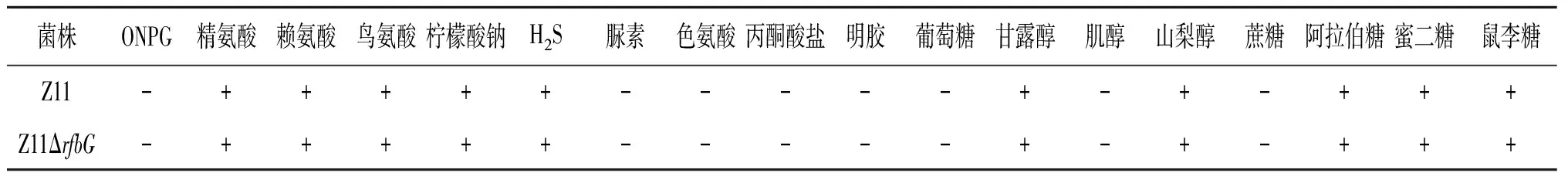
表3 Z11和Z11ΔrfbG生化特性Tab.3 Biochemical characteristics of Z11 and Z11ΔrfbG
2.2.3 生物被膜形成 将野生株Z11和缺失株Z11ΔrfbG分别置于96孔板中37 ℃培养48 h,用结晶紫对其生物被膜进行定量分析。结果显示,缺失rfbG基因之后,肠炎沙门菌Z11形成生物被膜的能力显著降低(图5)。
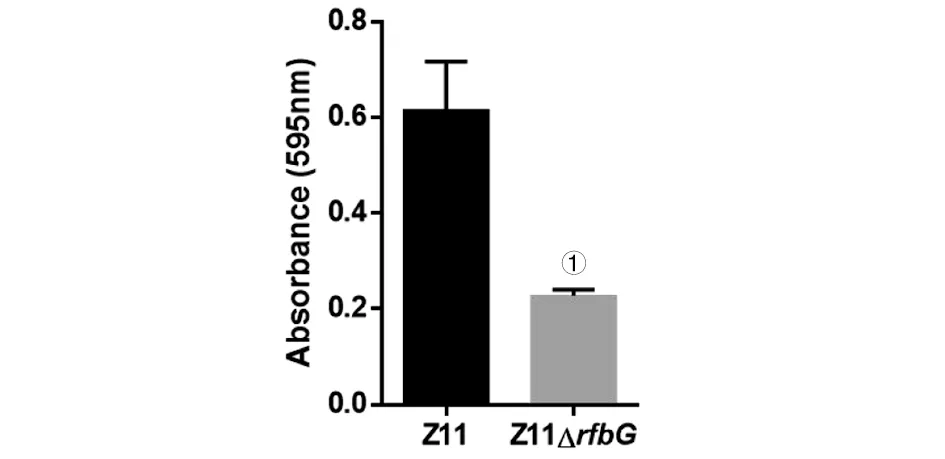
①P<0.05图5 Z11和Z11ΔrfbG生物被膜检测Fig.5 Biofilm of Z11 and Z11ΔrfbG
2.2.4 粗糙表型鉴定 野生株Z11缺失rfbG基因后,不与O9单抗发生凝集,与吖啶橙溶液发生凝集(图6),符合粗糙型沙门菌的特点。

图6 粗糙型菌株鉴定Fig.6 Identification of rough strains
2.3 细胞毒性试验 J774A.1细胞分别感染相同数量的野生株Z11和缺失株Z11ΔrfbG后,利用乳酸脱氢酶细胞毒性检测试剂盒测定乳酸脱氢酶活性。结果表明,在缺失rfbG基因之后,肠炎沙门菌Z11对J774A.1细胞的毒力降低(图7)。
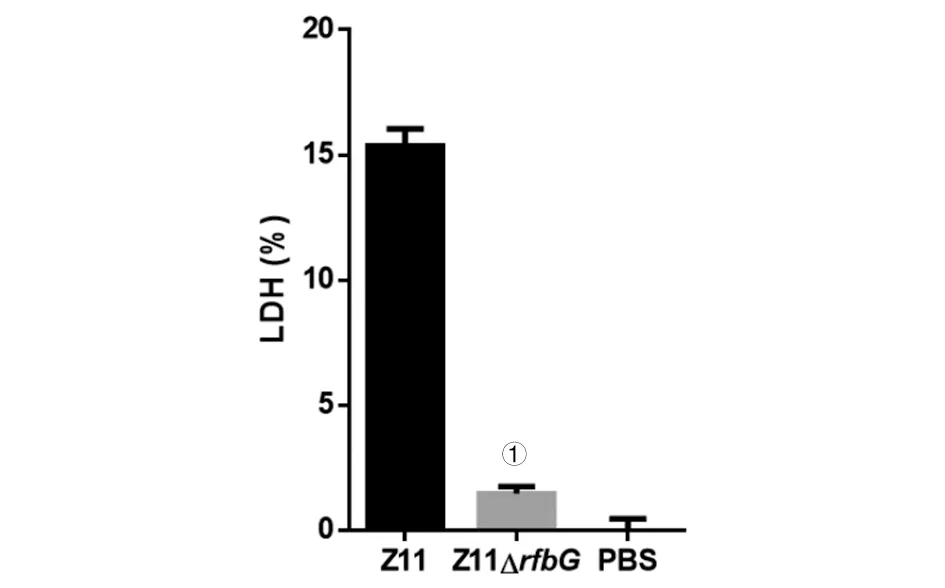
①P<0.05图7 细胞毒性检测Fig.7 Cytotoxicity test of Z11 and Z11ΔrfbG
3 讨 论
沙门菌减毒活疫苗具有免疫原性好和免疫方式类似自然感染等优越性,可以通过口服途径传递重组抗原到机体黏膜表面,从而诱导机体产生保护性免疫应答来对抗病原体的感染[11]。尽管可以通过物理、化学等方法获得减毒沙门菌,但其所得疫苗存在背景不清、毒力易返强等缺点[12]。随着分子生物学技术的发展,利用现代基因工程手段敲除单个或多个基因构建减毒沙门菌,可使其在降低毒力的同时,仍保留着高度的免疫原性[13]。目前引起沙门菌毒力减弱的基因主要包括毒力相关基因、调控基因、管家基因以及编码生物活性酶的基因,如cya、crp、steA、spiC、yieA、aceE等基因[11,13]。曹莉等[14]通过Red重组系统成功构建肠炎沙门菌yjeA基因缺失株,研究结果表明,与亲本株比较,yjeA基因缺失株生长稳定,毒力降低,且能够刺激机体产生特异性抗体。程瞾等[15]研究发现,鸡伤寒沙门菌同时缺失spiC与crp基因后,缺失株生长速率减慢,与亲本株相比其对雏鸡的LD50升高107倍。焦扬[16]利用信号标签诱变技术(STM技术)分别筛选到rfbG与rfbH基因,且研究结果表明rfbG基因缺失株能对小鼠提供较为优良的免疫保护效力,是理想的疫苗候选株。
综上所述,本研究在前期工作的基础上,以肠炎沙门菌Z11为研究对象,以rfbG作为目的基因,利用自杀质粒pDM4介导的同源重组技术,构建肠炎沙门菌Z11ΔrfbG缺失株。研究表明,rfbG基因缺失株与野生株相比,展示出相似的生化特性,但是在生长曲线前期则存在明显的差异,表明rfbG基因缺失对肠炎沙门菌Z11生长速率有一定影响。细菌生物被膜是细菌自身分泌的,如多糖、蛋白、脂质等细胞外多聚物,将细菌彼此黏附所形成的一种复杂的聚集体[17]。当细菌存在于生物被膜中时,其对抗生素的耐药性会提高10~1 000倍,生物被膜对细菌会产生保护作用[18]。本研究生物被膜试验结果显示,rfbG基因缺失株能够降低肠炎沙门菌Z11形成生物被膜的能力。曹堃[19]研究表明肠炎沙门菌G9ΔhilA生物被膜形成能力强,耐药性高,而G9ΔssrAB生物被膜形成能力弱。由此推测rfbG基因缺失株可能会降低其对抗生素的耐药性,这部分工作值得进一步研究。
细菌感染细胞后,细胞发生坏死而造成的细胞膜结构的破坏会导致细胞浆内的LDH释放到培养液里,通过检测细胞培养液中的LDH的活性,可以对细胞毒性进行定量分析。LDH活性越高,坏死的细胞越多,则细菌毒性越强;反之,则细菌毒性越弱[20]。本研究细胞毒性试验显示,野生株感染J774A.1细胞后,LDH的活性高。而与野生株相比,rfbG基因的缺失降低了菌株的毒力。
可鉴别疫苗即DIVA疫苗可利用简便的血清检测手段,快速甄别免疫动物与天然感染动物。DIVA疫苗所用的减毒株多为特定抗原(如脂多糖、神经氨酸酶)缺失菌株,因此LPS是构建DIVA疫苗合适的选择靶标[21]。郭荣显[22]研究表明,rfaL基因编码O-抗原连接酶,参与LPS的合成,缺失后形成截短的LPS结构,鸡白痢沙门菌S06004ΔspiCΔrfaL与O9单抗不发生凝集,与吖啶橙溶液发生凝集现象,具有显著的DIVA特征。本研究结果与其研究结果相似,肠炎沙门菌Z11缺失rfbG基因后,O9单抗玻板凝集试验呈阴性,吖啶橙凝集试验呈阳性,Z11ΔrfbG符合粗糙型沙门菌的特点,即rfbG基因的缺失会影响LPS的合成。根据rfbG缺失株的这一特点,rfbG基因具有作为DIVA疫苗靶点的潜力。总之,肠炎沙门菌Z11是由本实验室从鸡体分离所得,适于构建预防家禽肠炎沙门菌感染的减毒疫苗候选株,而且Z11ΔrfbG具有DIVA疫苗的功能,开发前景广阔。
利益冲突:无
引用本文格式:王新为,宋丽,王铭,等.肠炎沙门菌rfbG基因缺失株的构建及其生物学特性研究[J].中国人兽共患病学报,2021,37(11):971-976,984. DOI:10.3969/j.issn.1002-2694.2021.00.137

