山东省潍坊市农村人群海氏肠球菌恶唑烷酮类耐药基因流行情况研究
王晓慧,王 爽,张 倍,胡 军
肠球菌是一种革兰氏阳性球菌,能够引起泌尿道、血流等多种临床感染[1-2],约占医院感染或医院获得性感染的10%,是全世界败血症的主要原因[3]。海氏肠球菌在临床上的感染发生率较低[4],但病例都为与菌血症相关的严重疾病,且感染病例正在增加[5]。耐药基因cfr、optrA、poxtA均可介导恶唑烷酮类(利奈唑胺)和苯丙醇类(氟苯尼考)耐药。3种耐药基因均在多个地区不同来源的革兰氏阳性球菌(主要在葡萄球菌和肠球菌)中被检出,近年阳性率有所上升,且存在人兽传播的风险[6-9]。畜牧业抗生素的残留能够将细菌的抗药性转移给人类[10]。健康人群中携带的耐药基因也可能造成人与人、人向环境或食物的传播[11]。本研究通过对来自山东省潍坊市的12个村的620份粪便样品进行检测,研究农村地区健康人群中海氏肠球菌的耐药性和耐药基因cfr、optrA、poxtA的携带率,有助于了解农村人群中恶唑烷酮类耐药基因的流行情况及存在的公共卫生隐患。
1 材料与方法
1.1 样本采集 2017年在山东省潍坊市12个村对全体无症状健康常住村民进行采样,采样对象最小年龄6岁,最大年龄94岁;其中男性360人,女性260人。共收集到620份无重复粪便样本,低温运送至实验室,于-80 ℃条件保存。
1.2 主要仪器与试剂 基质辅助激光解析电离-飞行时间质谱仪 (MALDI-TOF-MS) 购自德国Brukert公司; PCR仪购自美国Thermo Fisher Scientific公司;毛细管凝胶电泳仪购自德国QIAGEN公司;脉冲场凝胶电泳仪、凝胶成像系统均购自美国Bio-Rad公司。肠球菌培养基 (叠氮钠-结晶紫-七叶苷琼脂) 基础、Mueller-Hinton琼脂 (MHA) 购自北京陆桥技术股份有限公司;氟苯尼考、万古霉素、四环素、环丙沙星、利奈唑胺、氯霉素、庆大霉素、利福平、呋喃妥因、美罗培南、左氧氟沙星、红霉素、克林霉素、甲氧苄啶、磺胺甲恶唑、阿莫西林,购自上海阿拉丁生化科技股份有限公司;氨苄青霉素购自北京索莱宝科技有限公司;克拉维酸购自于中国食品药品检定研究院;细菌DNA提取试剂盒产自北京天根生化科技有限公司;PCR反应体系、SmaⅠ限制性酶切体系均购自日本TaKaRa公司;PCR引物由上海生工生物工程股份有限公司合成。
1.3 细菌分离与鉴定 粪便样本接种划线于氟苯尼考 (10 mg/L) 肠球菌选择性培养基,37 ℃培养过夜,筛选出肠球菌。用无菌取菌环挑取单个菌落接种于哥伦比亚血平板上,37 ℃培养过夜,分离纯化细菌后,MALDI-TOP-MS鉴定细菌种属。
1.4 药敏试验 采用琼脂稀释法进行药敏试验,粪肠球菌ATCC 29212作为质控菌株。测定共14大类15种抗菌药物的最小抑菌浓度 (minimum inhibitory concentration, MIC),包括:四环素、万古霉素、氨苄青霉素、环丙沙星、氯霉素、利奈唑胺、利福平、呋喃妥因、硫酸庆大霉素、美罗培南、左氧氟沙星、红霉素、克林霉素、复方新诺明、阿莫西林/克拉维酸。结果判定参照美国临床和实验室标准协会推荐方法 (CLSI 2019) 和欧盟药敏试验标准委员会推荐方法 (EUCAST 2019)。
1.5 耐药基因cfr、optrA、poxtA的检测 按照细菌基因组DNA提取试剂盒说明提取海氏肠球菌DNA。以DNA为模板,使用PCR扩增cfr、optrA、poxtA基因,毛细管凝胶电泳检测目的条带。具体引物序列和PCR反应条件如表1所示。
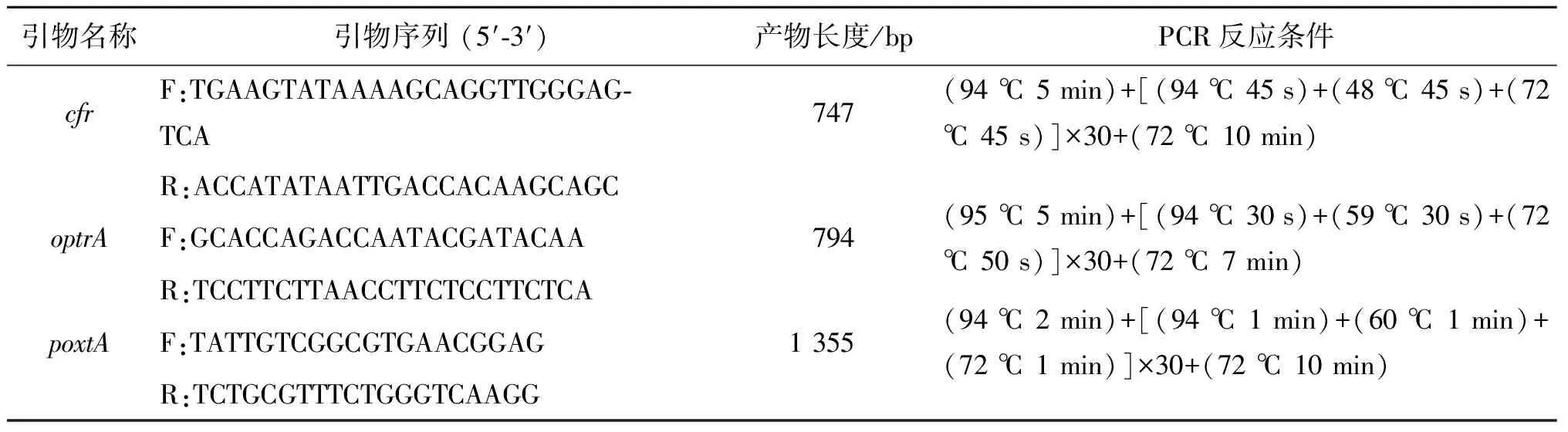
表1 耐药基因cfr、optrA、poxtA引物序列信息Tab.1 Primer sequences for resistance genes cfr, optrA, poxtA
1.6 脉冲场凝胶电泳 使用PFGE对poxtA阳性菌株进行分子分型分析。使用限制性内切酶SmaⅠ酶切体系对海氏肠球菌全基因组进行酶切,沙门菌H9812经过XbaⅠ限制性内切酶切后作为分子量参考标准。凝胶成像系统获得PFGE指纹图谱,BioNumerics (Version 6.0) 软件进行聚类分析。
2 结 果
2.1 菌株分离与药敏试验结果 12个村620份粪便样本共分离获得29株海氏肠球菌,分离率为4.68%。29株海氏肠球菌对克林霉素和四环素全部耐药,对氯霉素、复方新诺明、红霉素、利福平、环丙沙星、呋喃妥因、庆大霉素、美罗培南、左氧氟沙星的耐药率分别是96.6% (28/29)、75.9% (22/29)、58.6% (17/29)、37.9% (11/29)、17.2% (5/29)、13.8% (4/29)、10.3% (3/29)、3.4% (1/29)、3.4% (1/29),对氨苄青霉素和阿莫西林/克拉维酸均敏感。除两株万古霉素中介菌株外,未检测到万古霉素耐药菌株。利奈唑胺耐药率为10.3% (3/29),在剩余的海氏肠球菌中,有4株利奈唑胺MIC值被判定为中介 (MIC=4 mg/L),其余22株被判定为对利奈唑胺敏感。多重耐药菌株检出率为100%。所有海氏肠球菌耐药表型见表2。
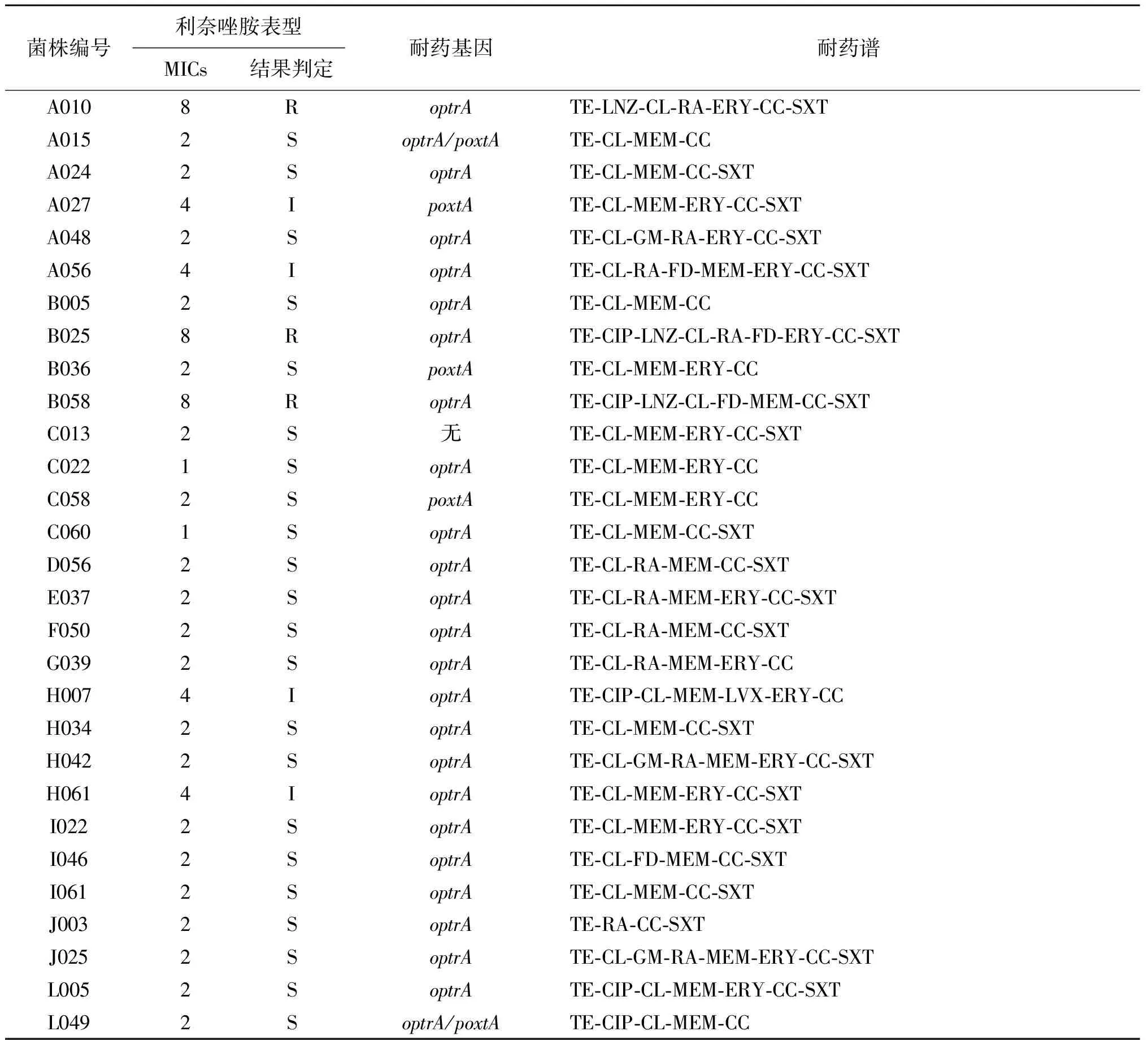
表2 29株海氏肠球菌耐药性及耐药基因的携带情况Tab.2 Antibiotic resistance and resistance genes of twenty-nine Enterococcus hiraes
AM:氨苄青霉素;VAN:万古霉素;TE:四环素;CIP:环丙沙星;LNZ:利奈唑胺; CL:氯霉素;GM:庆大霉素;RA:利福平;FD:呋喃妥因;MEM:美罗培南;LVX:左氧氟沙星;ERY:红霉素;CC:克林霉素;SXT:复方新诺明;AMC:阿莫西林/克拉维酸。
2.2 耐药基因cfr、optrA、poxtA检出结果 29株海氏肠球菌中有28株携带cfr、optrA和poxtA中的一种或两种耐药基因,有一株未检测到以上任何耐药基因。未检测到携带cfr基因的菌株;optrA阳性菌株有25株,阳性率为86.2% (25/29);poxtA基因阳性菌株有5株,阳性率为17.2% (5/29);同时携带optrA和poxtA基因的有2株。具体信息见表2。
2.3 PFGE分型结果 5株poxtA阳性海氏肠球菌被分为5种PFGE带型,呈现高度多态性。结果如图1所示:H1和H2属于一个分支,带型相似度为85.7%;H3和H4属于一个分支,带型相似度为88.2%;上述两个分支间的相似度为81.1%;H5与H1、H2、H3、H4不在一个分支,相似度为76.8%。
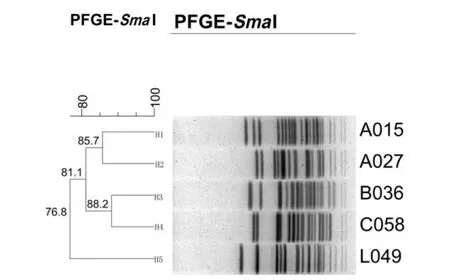
图1 5株poxtA阳性海氏肠球菌PFGE聚类图Fig.1 PFGE cluster of five poxtA-positive Enterococcus hiraes
3 讨 论
肠球菌不仅是医院感染的常见细菌,也是获取、保存、传播各种耐药基因的中心枢纽[12]。海氏肠球菌作为肠球菌的一个种属,近年来由它引起的人类感染时有发生。例如,西班牙报道的菌血症肺炎[1],韩国、土耳其报道的尿路感染[13-14],美国、丹麦报道的心内膜炎[15-16],此外,美国还报道了一例婴儿血流感染病例[5]。在既往耐药基因cfr、optrA、poxtA的研究中,绝大部分集中在粪肠球菌和屎肠球菌,海氏肠球菌研究结果较少。研究表明,在动物源海氏肠球菌存在携带多种耐药的可移动遗传元件,有助于包括poxtA在内的耐药基因在肠球菌中的传播和持续存在[17]。
本研究从620份农村健康人粪便样本中分离出29株海氏肠球菌,检出率4.68%,相比动物源海氏肠球菌检出率低,目前,尚未有人源海氏肠球菌的报道[17-18]。药敏试验结果显示,海氏肠球菌耐药情况严重,利奈唑胺耐药率为10.3% (3/29),药敏结果提示利奈唑胺低水平耐药。cfr未在本研究中检出,但optrA和poxtA阳性率高。Hua等[19]报道了optrA基因在利奈唑胺低水平耐药机制中有重要作用。提示海氏肠球菌中,optrA也可能与利奈唑胺低水平耐药有关,但需研究证明。PFGE分析显示海氏肠球菌属于不同的带型,表明山东省潍坊市农村健康人群粪便携带的poxtA阳性海氏肠球菌基因型表现为高度的多态性,这可能受海氏肠球菌例数较少的影响。本研究中海氏肠球菌利奈唑胺耐药率低于Cai等[11]的健康人群粪肠球菌和屎肠球菌利奈唑胺的耐药率,而optrA阳性率则高于Cai等[11]的研究,这可能与采样地区和肠球菌种属相关。
综上所述,本研究中海氏肠球菌耐药情况严重,耐药基因携带率高,poxtA阳性菌亲缘关系较远。农村地区常住人口组成特殊,农场和屠宰场分布较多,由于知识水平限制,容易不规范使用甚至滥用抗生素,使细菌产生耐药性。为防止耐药菌在农村健康人群中的传播,应宣传规范用药,加强对环境和食品中抗生素和耐药菌的监测。此外,既往研究表明,医院病人中利奈唑胺耐药率和三种恶唑烷酮耐药基因阳性率较高[20],因此医疗机构也应做好相关预防措施,避免通过医疗过程造成不同人群间耐药菌的传播。
利益冲突:无
引用本文格式:王晓慧,王爽,张倍,等.山东省潍坊市农村人群海氏肠球菌恶唑烷酮类耐药基因流行情况研究[J].中国人兽共患病学报,2021,37(11):1017-1021. DOI:10.3969/j.issn.1002-2694.2021.00.142

