支原体营养代谢特征的研究进展
张晓亮,郝华芳,陈胜利,颜新敏,储岳峰
支原体(Mycoplasma)是一类缺乏细胞壁、呈高度多形性、能通过滤菌器、可在无生命培养基中生长繁殖的最小原核细胞型微生物。目前,已经从人类和动植物体中分离出了多种致病性支原体,例如感染人类的人肺炎支原体(M.pneumonia, Mp),在新生儿以及青少年中有极高的发病率;感染动物的如能引起山羊传染性胸膜肺炎(contagious caprine pleuropneumonia, CCPP)的山羊支原体山羊肺炎亚种[1](M.capricolumsubsp.capripneumoniae, Mccp)和感染植物的如能引起枣疯病(Jujube witches’-broom disease)的枣疯病植原体(Jujubewitches’-broomphytoplasma, JWBP)等[2],各种动植物支原体对世界畜牧业以及粮食产业造成了严重的经济损失,也威胁人类生命健康。
支原体基因组是环状双股DNA,大小480~2 200 kbp,G+C含量低,在23%~40%之间,支原体基因组中编码氨基酸和其他各种如嘌呤,嘧啶,生物素等生长因子生物合成的基因数量很少[3],缺乏能量代谢途径中许多重要基因,脂肪酸和磷脂代谢基因及相关调控基因也很少[4]。因此,支原体是氨基酸、脂类和某些生长因子的营养缺陷型生命体,难以应对环境的变化,仅在特定环境中生存[5],这就造成了支原体培养困难。但体外培养是开展支原体生物学、病原学及防控技术研究的基础前提,尤其由于抗药性越来越普遍[6],疫苗成为防治支原体病的重要方向。尽管用支原体培养物制造疫苗在人类和动植物支原体病防控方面取得了一些成果[7-8],但支原体对营养要求高、生长缓慢和菌体密度低的特点极大阻碍了现有疫苗生产效率和推广应用。所以,探究支原体的代谢特点,开发新培养基和培养技术,是解决支原体培养难题的有效途径,也是支原体研究领域的基础性问题。
本综述总结了支原体这一具有“营养缺陷”特点的微生物在转运系统、营养需求以及代谢网络方面的研究进展,对研发支原体高效培养技术和培养基提供参考,同时希望从代谢角度对探索支原体的致病机制、毒力因子等有所启发。
1 支原体的转运系统
运输系统被认为在支原体的生存中起着重要作用。由于支原体的生物合成能力有限,许多营养物质需要依靠外源性供给,因此支原体需要较多的运输系统来运输营养物质[9],在Mp中有17%的基因是编码运输过程所需的转运蛋白或脂蛋白[10]。但与大肠杆菌和枯草杆菌相比,支原体转运蛋白的数量并不多,可能是由于支原体只有一个通透屏障,其运输系统的底物特异性较低,且生物合成过程中耗能少等所致[11]。在支原体中已发现3种类型的转运系统,即ATP结合型转运系统(ATP-binding cassette transporter,ABC)、依赖磷酸烯醇丙酮酸的磷酸转移酶系统(Phosphotransferase system,PTS)和易化扩散。
1.1 ABC转运系统 ABC转运系统由胞质中的两个ATP结合区、两个跨膜区和一个胞外底物结合区组成,主要参与胞内和胞外的物质转运,包括糖类、肽类、蛋白质和毒素等。该系统的某些蛋白可以自由改变构象,从而能相应地改变底物的特异性和转运功能。首先在猪鼻支原体(M.hyorhinis)和猪Mp(M.hyopneumoniae)中发现了ABC转运系统存在,后来在Mp(M.pneumoniae)、生殖支原体(M.genitalium)和发酵支原体(M.fermentans)中也都发现了ABC转运系统的存在。可以说,ABC转运系统是支原体与外界进行物质交换的“高速公路”。近些年,对ABC转运蛋白的研究是微生物代谢和合成生物学领域研究的热点之一。通过对其转运蛋白的结构与基因组分析,解析其具体的作用机制,探究其是否可以由一种转运蛋白转运多种底物,提高微生物的代谢性能,设计出科研工作者想要的具有特定代谢性能的菌株,使其更适用于疫苗生产和科学研究[12-15]。2019年,Masukagami比较了野生型牛支原体和假定ABC转运蛋白基因转座子突变株的代谢产物谱,并用13C-同位素标记甘油转运蛋白的突变株。发现突变体的两个基因组编码转运蛋白的功能与基因组注释结果不同,假定的氨基酸转运蛋白(mbovppg450533)似乎更有可能与运输核苷酸有关,而假定的二羧酸/氨基酸:阳离子转运体(mbovppg450568)更有可能起生物蝶呤/叶酸转运体的作用。说明基因注释的某些转运蛋白功能与实际情况存在一定差异。进一步推测支原体的转运系统似乎有高度可变性,对其适应环境和营养供给的变化有重要意义[16]。
1.2 PTS转运系统 PTS是大多数细菌的糖转移系统,包含对糖专一的酶II和不专一的酶I及HPr(Heat-stable histidine-phosphoryl protein,HPr)蛋白,目前已经发现山羊支原体(M.capricolum)的PTS与大肠杆菌相似,但两者的酶II和HPr的分子结构有差异,不存在交叉免疫反应[17]。
对PTS转运系统的酶和调节成分的活性研究是支原体代谢研究方面的主要方面,尤其对HPr和HPr激酶/磷酸化酶(HPrK/P)的生理活性研究极大地促进了各国学者对支原体PTS系统功能活性的了解。2004年,Halbed等人研究了Mp利用不同碳水化合物的能力及其对不同PTS组分活性的影响,结果发现在添加果糖或甘油时Mp的培养时间比添加葡萄糖时大约延长了1倍,产量也较低,因此葡萄糖是Mp最好的碳源。另一方面,虽然Mp基因组编码甘露醇分解代谢所需的所有基因,但其在体外培养时并不能利用甘露醇。在研究中所有测试的生长条件下,PTS的酶I、HPr和HPrK/P均存在。然而,如果培养基中添加了甘油,HPrK/P活性会显著增加[18]。随后,Merzbacher等发现HPrK/P是Mp为数不多的调控蛋白之一,其调节方式与其他细菌有明显不同:MpHPrK/P在低ATP浓度下就具有激酶活性,而其他细菌的HPrK/P蛋白需要高ATP浓度才能发挥出激酶活性;Mp的HPrK/P蛋白对ATP具有非常高的亲和力,而果糖-1,6-二磷酸只有微弱的调节作用。进一步研究发现,HPrK/P活性部位——核苷酸结合的P环的突变导致了MpHPrK/P独特的调节方式,P环区域突变显著影响ATP结合,从而影响酶的功能发挥[19]。HPrK/P缺陷的Mp突变株不再表现出HPr激酶活性,但仍具有针对丝氨酸磷酸化HPr的磷酸酶活性。编码蛋白磷酸酶2C(Protein Phosphatase 2C,PP2C)家族的假定蛋白丝氨酸/苏氨酸磷酸酶的基因(PrpC)可能在调节细胞HPr磷酸化状态中起重要作用[20]。总之,HPr和HPrK/P作为PTS发挥功能的重要组成部分,对支原体的能量摄取具有重要作用,通过调节HPr和HPrK/P的功能发挥来改造PTS系统对今后支原体的代谢乃至毒力因子[21]的研究有重要意义。
2 支原体的一般性营养需求
支原体的一般性营养需求包括碳源、氨基酸、无机盐和水。碳源在细胞内经过一系列复杂的代谢后,成为支原体自身的细胞物质(如碳水化合物、蛋白质和脂类等)和代谢产物。碳元素占细胞干重的50%左右,因此碳源是最基本的营养要素,需要量大,一般的糖类、甘油等可作为支原体的碳来源。尤其是甘油代谢过程中,支原体中的3-磷酸甘油氧化过程涉及一个产生过氧化氢的甘油-3-磷酸氧化酶。而过氧化氢是大部分支原体的主要毒力因子之一,所以甘油代谢过程和甘油-3-磷酸氧化酶在支原体的毒力中起着关键作用,目前在鸡毒支原体和猪Mp相关毒力研究中均有报道[22-23]。氨基酸也是支原体不可或缺的营养需求,不同的支原体对氨基酸的需要量也不同,但大部分支原体均需全谱氨基酸。另外,研究发现无机盐也是支原体稳定生长所需的必需物质,Beier等发现为使猪Mp稳定生长,在全组分确定的培养基CMRL+中添加了多种无机盐,各种无机盐的添加浓度和作用见表1[24]。总之,一般性营养需求是支原体培养的物质基础。
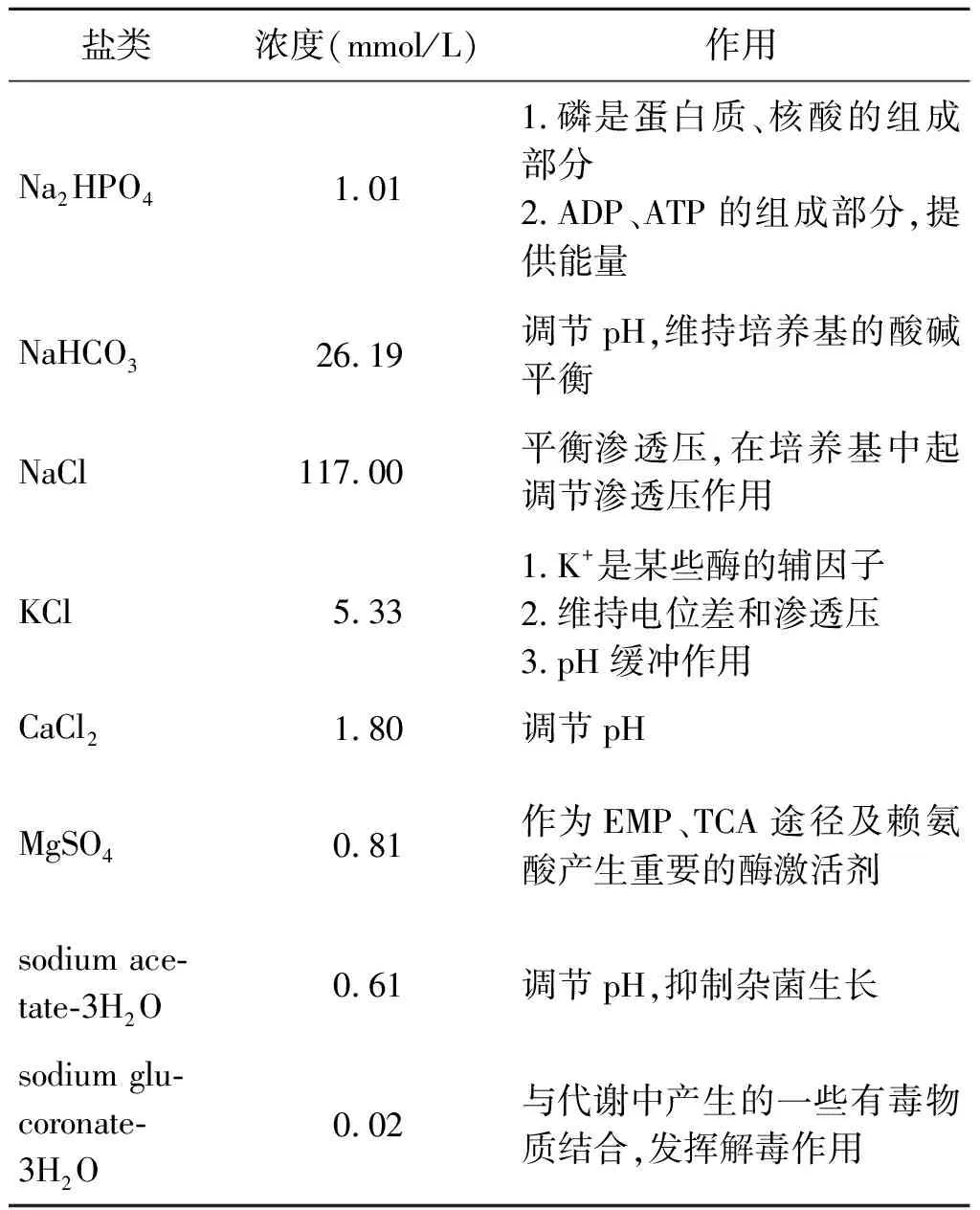
表1 CMRL+培养基中添加的几种盐类物质Tab.1 Several salts added in CMRL+ medium
3 支原体的特殊营养需求
支原体基因组很小,生物合成和代谢能力有限,因此支原体生存需要的营养成分主要靠从外界摄取。支原体对营养物质要求苛刻,一般来讲,其特殊营养成分主要包括:胆固醇和脂肪酸、核酸前体和能量来源。
3.1 胆固醇和脂肪酸 大多数支原体的生长需要胆固醇,因此通常在培养基中添加血清,目的是提供支原体生长过程中必需的胆固醇和饱和及不饱和脂肪酸[25]。牛、马血清中所含胆固醇的主要成分是高密度脂蛋白(HDL),并且血清中的蛋白是支原体生长所需脂肪酸的载体。由于不同动物甚至同种动物不同批号的血清所含HDL、低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)的量有差异,故其培养支原体的效果也有所不同[26]。到目前为止,还没有关于支原体脂肪酶的实验信息。然而,目前认为脂肪酶对支原体和其他柔膜体纲物种非常重要,因为这些微生物不能合成脂肪酸,因此依赖于从环境中获取脂肪酸。事实上,3个脂肪酶编码基因已经在丝状支原体山羊亚种(M.mycoidessubsp.capri, Mmc)中被确定[27],并且在Mp和生殖支原体的基因组中也预测了3个脂肪酶编码基因。并且假定的脂肪酶编码基因在Mp都是必不可少的,这表明他们是专门的底物特异性酶[28]。此外,在猪Mp中发现了一种偏爱较短脂肪酸的脂解酶[29],在Mp中也存在相应的蛋白质(MPN407)。
由于大多数支原体都存在隐性感染的问题,难以及时诊断发现,目前也有诸多学者提出利用感染早期血清代谢标志物检测的方法来解决支原体隐性感染的问题。而血清代谢标志物也在一定程度上反映了支原体的代谢特点,在2019年,Meera等人利用非靶向代谢组学技术,检测到在猪Mp早期感染的猪的血清中,发现肉豆蔻酸,棕榈油酸,油酸和亚油酸等几种脂肪酸的含量较未感染猪的血清中显著上升,提示了猪Mp在机体中生长繁殖对脂肪酸具有强烈需求[30]。
3.2 核酸前体 支原体缺乏合成嘧啶所需的乳清酸代谢途径和合成嘌呤所需的酶促代谢途径,因此,培养基内需要提供一定量的嘌呤碱和嘧啶碱。实验证明,许多支原体的酶系统可以将培养液中的核苷酸分解为自由碱基[31],因此可以通过核苷酸补救合成途径合成支原体生长过程中所需要的核苷酸。
最早在1977年,Mitchell等通过试验确定了丝状支原体(M.mycoides)中核苷酸合成的主要途径,发现其不具有从头合成核苷酸的途径,但能够进行核苷酸的相互转化,因此,尿嘧啶提供了对两种嘧啶的需求。此外还需要胸腺嘧啶,说明其无法进行尿嘧啶的甲基化[32]。目前,在支原体核苷酸代谢研究中,公认的是大多数支原体都缺乏核苷酸从头合成途径,核苷和脱氧核苷被核苷激酶和脱氧腺苷激酶有效地吸收和磷酸化为它们各自的核苷酸。核酸酶是通过次黄嘌呤磷酸核糖基转移酶(HPRT)、腺嘌呤磷酸核糖基转移酶(APRT)和尿嘧啶磷酸核糖基转移酶(UPRT)系统补救[33]。2013年,Sun和Wang在Mp基因组核苷酸生物合成中共鉴定到17种酶,其中15种是必不可少的,对30种核苷或核苷碱基类似物的药物评价发现7种药物能够有效抑制Mp的生长,其机制是抑制了核苷酸生物合成途径和核苷转运蛋白中的酶[34]。支原体对外源核酸及核酸前体的需求,是支原体区别于其他微生物的重要营养代谢特征,而支原体对核酸的摄取造成宿主机体的损害,也是某些支原体的重要毒力因素。图1展示了Mp中核苷酸的生物合成途径。
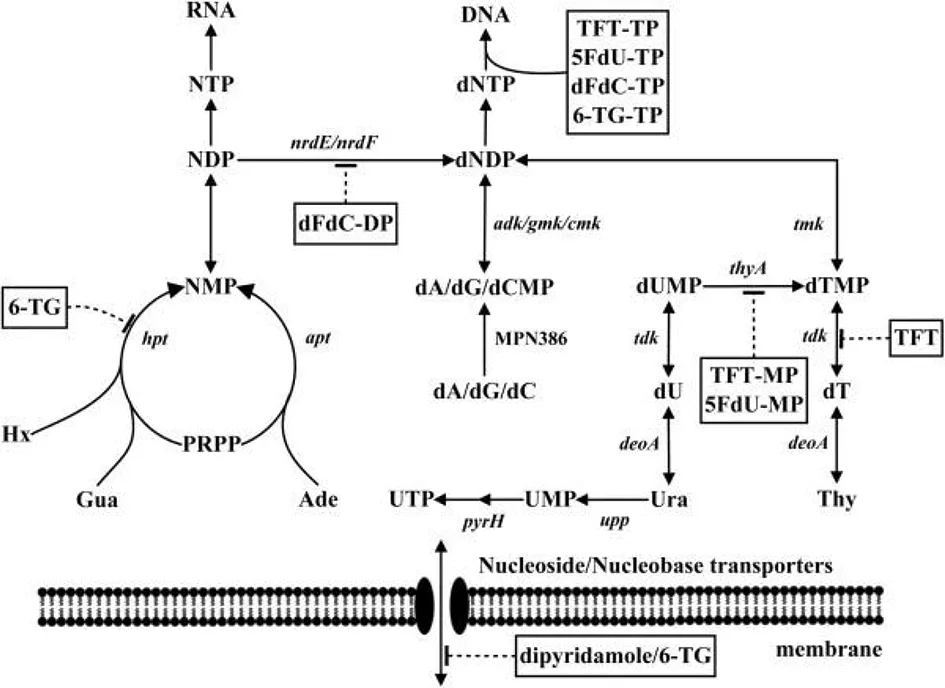
Hx:次黄嘌呤,Gua:鸟嘌呤,Ura:尿嘧啶,Thy:胸腺嘧啶,dT:胸苷,dA:脱氧腺苷,dC:脱氧胞苷,dG:脱氧鸟苷,PRPP:焦磷酸核糖基,NMP:核苷一磷酸,NDP:二磷酸核苷,NTP:三磷酸核苷, dNDP:脱氧核苷二磷酸,dNTP:脱氧核苷三磷酸,TFT:三氟胸苷,TFT-MP:三氟胸苷一磷酸, TFT-TP:三氟胸苷三磷酸, 5FdU-MP:5-氟脱氧尿苷一磷酸,5FdU-TP:5-氟脱氧尿苷三磷酸, dFdC-DP:吉西他滨二磷酸, dFdC-TP:吉西他滨三磷酸, 6-TG:6-硫鸟嘌呤,6-TG-TP:6-硫鸟嘌呤三磷酸。酶:hpt:次黄嘌呤鸟嘌呤磷酸核糖基转移酶(MPN672),apt:腺嘌呤磷酸核糖基转移酶(MPN395),upp:尿嘧啶磷酸核糖基转移酶(MPN033),deoA:胸苷磷酸化酶(MPN064),tdk:胸苷激酶(MPN044),thyA:胸苷酸合酶(MPN320),tmk:胸苷酸激酶(MPN006),adk:腺苷酸激酶(MPN185),gmk:鸟苷酸激酶(MPN246),cmk:胞苷酸激酶(MPN476),nrdE/nrdF:核糖核苷酸还原酶(MPN322和MPN324),pyrH:尿酸激酶(MPN632),脱氧腺苷激酶(MPN386),I:抑制。图1 Mp核苷酸生物合成示意图[34]Fig.1 Schematic overview of M. pneumoniae nucleotide biosynthesis[34]
3.3 能量来源 由于缺少编码中间代谢产物的基因,支原体的能量代谢系统比较简单,缺乏细胞色素和三羧酸循环所需的酶类等,呼吸链进行不完整,因此支原体是主要依靠底物的磷酸化产生ATP,而不是氧化磷酸化过程。大部分支原体以葡萄糖、精氨酸以及有机酸如丙酮酸等作为能量来源。值得注意的是,虽然支原体对培养条件要求较高,但并非培养基的营养成分越丰富,培养效果越好。有些较难培养支原体并非是缺乏相应的营养成分,而是某种营养成分对支原体的毒性作用。如蛋白胨、酵母提取液中的某些生长因子对某些支原体而言是一种生长抑制因子。1977年,Washburn在研究中发现,精氨酸量的增多抑制发酵支原体和Mp的生长,因为过多的精氨酸代谢产生的游离碱干扰了这两种支原体发酵葡萄糖[35]。
根据对糖类分解能力的不同,可将支原体分为发酵型和非发酵型两种。发酵支原体主要依靠糖酵解途径分解葡萄糖合成ATP作为能源。发酵型支原体中,以对Mp的研究居多。Mp可以利用葡萄糖、果糖和甘油作为碳源[36]。这些碳水化合物通过糖酵解分解,作为 ATP 生成的主要途径。鉴于糖酵解对Mp的重要性,糖酵解途径的效率对其生长至关重要。事实上,大多数Mp的糖酵解相关酶可以形成复合物,这可能对确保糖酵解途径高通量进行起到了关键作用[37-38],由于磷酸戊糖途径和三羧酸循环缺乏氧化部分,所以糖酵解对于柔膜体纲的重要性不言而喻[39]。而在非发酵型支原体主要通过精氨酸脱氢酶、鸟氨酸甲酰转移酶及氨基甲酸盐激酶三个酶系统,将精氨酸通过底物水平磷酸化而分解成瓜氨酸、鸟氨酸、CO2、NH3及产生ATP而获得能量。但是,精氨酸脱氢酶途径在少数发酵型支原体中也存在,因此,当培养这一类支原体时,如果培养基中同时含有葡萄糖和精氨酸,分解葡萄糖产生的酸可能被分解精氨酸产生的碱中和,使其pH不发生明显改变,从而影响精氨酸利用试验的结果判断。Fenske等发现鸡毒支原体、人型支原体和发酵支原体在含高浓度精氨酸(34 mmol/L)和低浓度精氨酸(4 mmol/L)的培养基中培养时,人型支原体菌体蛋白的含量和精氨酸脱亚胺酶的比活性在前者中都显著增加,而鸡毒支原体和发酵支原体虽然在前者中培养时也表现出蛋白含量的增加,但酶的比活性没有增加,这说明精氨酸在某些支原体中可能作为一种替代能源使用[40]。2009年,Pereyre等发现人型支原体的糖酵解通路是不完整的,而精氨酸二水解酶途径对促进其生长不可或缺,同时预测了二甲基精氨酸和二甲氨基水解酶的存在,提示精氨酸分解代谢是极其复杂的[41]。
4 支原体代谢与组学研究
随着基因组学、蛋白质组学和代谢组学等各种组学技术的发展,通过高通量的基因组测序,蛋白质筛选和代谢物分析,解析支原体基因组与蛋白功能,为研究支原体这类最小微生物代谢提供了更多的数据与实验基础。
2017年,Kamminga等在猪Mp基因组测序基础上构建了基于284种化学反应和298种代谢物的基因组代谢模型,该模型预测猪Mp标准株中84%的能量用于非生长相关的生命维持,仅有16%的细胞能量用于生长和生长相关活动。发酵实验发现通过添加丙酮酸可增加用于生长的细胞能量的质量分数,从而使生长速率增加[42]。目前,在支原体培养基中添加适量丙酮酸盐用来提高支原体的产量已成为各国学者的共识。同年王晓晖等[43]比较了丝状支原体山羊亚种(Mmc)PG3菌株生长周期4个不同阶段的动态基因表达,发现45个差异表达基因(P<0.01)与PG3代谢相关。这些基因编码的酶主要参与ATP合酶、嘧啶代谢、烟酸和烟酰胺代谢、精氨酸和脯氨酸代谢,其中,胞苷激酶、果糖1,6-二磷酸醛缩酶II类、烟酸-核苷酸腺苷酰转移酶和二氢硫辛酰胺脱氢酶在Mmc代谢中起关键作用,该研究为了解Mmc代谢机制奠定了基础。之后,作者又对绵羊MpNM151菌株和丝状支原体亚种PG3菌株的不同生长阶段进行了“点对点”的比较。结果表明,核苷酸代谢的最大差异出现在生长曲线的稳定期。转录组试验比较发现,PG3的核苷酸合成主要是从头合成,而NM151核苷酸合成途径主要是利用核苷酸的补救途径。与 PG3相比,NM151缺乏脱氧胸腺嘧啶单磷酸酯合成的相关反应,并通过体外添加丝氨酸来弥补这一反应途径的空白,延长了NM151的生长稳定期,解决了Mo死亡较快的问题[44]。
2017年,Masukagami等使用代谢组学技术发现牛支原体和鸡毒支原体在代谢产物稳态水平和碳源利用方面表现出明显的差异。鸡毒支原体积极吸收外源性葡萄糖并积累大量的磷酸己糖,随后在糖酵解和磷酸戊糖途径中异化,产生ATP,这表明其PTS系统和碳水化合物转运体系统具有高效作用。然而有趣的是,即使是在外源葡萄糖水平很高的情况下,牛支原体似乎也是主要通过糖异生途径产生磷酸化糖。两种支原体均可以吸收其他中性糖,可能是通过非特异性的碳水化合物ABC转运蛋白CUT-2转运蛋白来实现的,进一步通过细胞稳态分析发现尽管鸡毒支原体培养基中的糖消耗更快,但牛支原体细胞中葡萄糖和果糖的水平高于鸡毒支原体细胞,推测可能是由于缺乏葡萄糖激酶同源物,牛支原体培养过程中外源葡萄糖转化为葡萄糖-6-磷酸(G-6-P)和其他糖磷酸盐的转化率低造成的。同时发现,牛支原体中乳酸含量较高,并且从培养基中快速吸收乳酸,这表明牛支原体可能利用乳酸作为首选的碳源,而在鸡毒支原体中丙酮酸发酵产生乳酸可能是导致培养过程中pH下降的原因。牛支原体摄取乳酸不仅是为了获取能量,也能够氧化乳酸产生过氧化氢,这也是支原体的毒力因子之一,在许多支原体代谢中都存在。结果表明牛支原体优先使用非糖类碳源,这可能反映了以反刍动物为宿主的支原体所处的生化环境,其中挥发性脂肪酸和乳酸盐(而不是葡萄糖)是肠粘膜吸收能量的主要来源[45-49]。这是为数不多的关于动物支原体病病原的代谢组学研究,对指导我们了解支原体代谢提供了新的试验参考和理论支持。
Mp是目前支原体组学方面研究最多的病原。2013年,Wodke等对Mp代谢网络进行了详细的分析和描述,并将一系列条件下不同组学分析的数据整合到一个模型中。通过模型预测、逻辑假设、实验测试和模型细化,精确地绘制了Mp的代谢网络,并对能量代谢进行了定量研究,发现Mp的大部分能量用于维持生命,而不是生长[50]。Maier等则进行了Mp大规模代谢组学分析以及与基因组学和蛋白质组学数据的定量整合研究,检测到超过50%的代谢中间物,得到了在实验室生长条件下Mp代谢途径的定性图像,测定了体内糖酵解酶的催化参数。同时将细胞质内代谢物的量的大小与来自生长培养基的营养物质及其相应的形式结合起来,解释了Mp细胞内代谢稳态维持的生化机制。揭示了Mp将代谢途径作为功能单元进行调节,表明Mp的代谢网络具有更模块化的调节方式,极大地简化了代谢流程中各种复杂的调节过程,尽量省去不必要的能量消耗,用于维持Mp的生命和生长[51]。
5 支原体的合成生物学
支原体作为自然界目前已知的能在无生命培基中生长繁殖的最小的微生物[52],一直是合成生物学领域的重点研究对象。2010年,美国J. Craig Venter团队合成丝状支原体(M.mycoides)基因组,然后将其移植入另一种关系密切的山羊支原体(M.capricolum)中,制造出他们称为JCVI-syn1.0的合成细胞。2016年,研究人员在syn1.0细胞的基础上,不断尝试删除其基因组中不必要的基因,最终把syn1.0中901个基因删除约一半,只剩下473个基因,合成了一个目前已知的具有最小基因组的可自主营生的最小细菌细胞,取名为JCVI-syn3.0合成细胞[53]。2019年, 美国伊利诺伊大学的Zaida Luthey-Schulten团队又以syn3.0为基础,进一步研究了这一具有最小基因组的人工生命体的必需代谢网络,为进一步研究这一最小生命体奠定了基础[54]。2020年,以JCVI-syn3.0为基础构建的计算机基因敲除模型以及生化反应网络模型被设计出来[55-57],为利用计算机技术体外重构生命体代谢网络和指导合成生物学发展奠定了基础。
6 结 论
支原体作为一种体外较难培养的微生物,从上世纪70年代各国学者都在致力于优化其体外培养条件,降低体外培养难度和培养成本,尤其是致力于弥补其某些代谢通路的缺失,并期望寻找培养基中血清替代物从而降低其培养成本。同时,支原体作为一类具有最小基因组的可自主营生的微生物,可将其作为一种模式生物体外重构基因-蛋白-代谢物网络,探寻三者之间的联系,从高通量、大数据、全局性角度为支原体的致病性研究提供数据支撑。
利益冲突:无
引用本文格式:张晓亮,郝华芳,陈胜利,等.支原体营养代谢特征的研究进展[J].中国人兽共患病学报,2021,37(11):1029-1036. DOI:10.3969/j.issn.1002-2694.2021.00.146

