一种感染性非人灵长类实验装置的生物安全研究
李巧红,鲜巧阳,王 蓓,王 勇,张振东,王 洋,周 立,汤宏斌
非人灵长类(主要是猕猴)动物模型广泛应用于例如埃博拉等烈性病原微生物感染相关的药物和疫苗的开发[1-2]。利用猕猴模型进行感染性科学研究,必须有与研究目的相适应的饲养环境和设施,猕猴在饲养及实验活动过程中的动物福利要求也高于其它实验动物,因此,猴饲养装置的规格及内环境参数要求较高。国外生物安全实验室内的猴饲养装置主要采用两种模式。第1种,采用普通式猴饲养笼具,将笼具置于高等级生物安全实验室内。实验人员穿戴正压防护服进行相关实验操作。第2种,在高等级生物安全实验室内配备负压隔离笼,将实验及动物饲养过程中潜在的病原微生物暴露风险控制在隔离笼内[3]。
目前,国内对于高等级生物安全实验室专用的非人灵长类实验装置没有统一的行业标准和规格。用传统的非人灵长类笼进行烈性病原微生物,如结核分枝杆菌、流感等气溶胶的研究时,频繁饲喂及进行实验操作时无法对实验人员进行有效的保护,存在较大的暴露风险,防护不当可能会导致感染。因此,自主研发相应的动物饲养和解剖设备,并制定相应的检测评价标准将有助于生物安全关键设备的国产化和标准化。
1 材料与方法
1.1 实验装置原理 感染性非人灵长类实验装置如图1所示,隔离系统包括两个或多个由不锈钢外壳以及玻璃门完整密封拼接之后形成的外部壳体,壳体内设置有笼,分为上、下两层。在壳体上部及背部设置有顶置灯罩和后置灯罩。壳体有送风通道和排风通道,送风通道位于壳体上方,送风通道依次设置有送风口、送风阀、送风风机、管道、安装在隔离系统相邻壳体之间的导流风扇、负压隔离器右侧的滤网及导流板;排风通道设置有右侧背部排风高效过滤器、与此相连的排风管、壳体上方排风阀、排风风机、排风口,排风口经过软管与实验室排风设备相连接。还有安装在壳体顶部用于切换自循环模式及补新风模式的气动阀门。负压隔离器左侧安装有监测过滤器的压差表。可编程逻辑控制器(PLC)控制单元对自循环模式、补新风模式之间的切换进行控制,通过控制送、排风风量,最终达到压力梯度的控制要求。气流自循环系统首先通过PLC控制单元打开气动阀门,关闭送风阀、气流通过滤网及导流板,循环风机、管道、气动阀门、送风风机进入壳体内,再通过导流风扇,形成平流层,起到活塞效应,到达滤网及导流板,实现气流自循环。在此过程中,可按照需求送新风,通过PLC控制单元对送、排风进行控制,调节风量,此时关闭气动阀门,打开送风阀,新风通过送风口、进入管道,随后经送风风机进入壳体内,通过导流风扇,到达右侧背部高效过滤器,经过排风管、打开排风阀、经排风风机,通过排风口排到实验室排风设备。在达到送新风要求的同时,保证壳体内的负压梯度的要求,最终达到污染空气不会泄露到壳体外(如图2)。除此之外,本隔离装置有多个饲养实验单元,每一饲养实验单元包括外笼和内笼,内笼设在外笼包括隔离板、第一外笼门和第二外笼门,外笼通过隔离板隔离成上层和下层,上层通过第一外笼门开闭,下层通过第二外笼门开闭,内笼包括第一内笼和第二内笼,第一内笼设在隔离器上层内,第二内笼设在隔离器下层内,隔离装置的第一内笼和第二内笼可拆卸地安装在外笼内,第一内笼底面设有第一通道,第二内笼顶面设有与第一通道连通的第二通道,第一通道上设有可拆卸地第一通道门;在实验中,打开外笼门时,内笼送排风系统依然形成定向气流,既可以保证笼内动物正常通气,也可完全阻断笼内空气的外溢。

图1 感染性非人灵长类实验装置示意图Fig.1 Schematic diagram of the Non-human primate isolation device
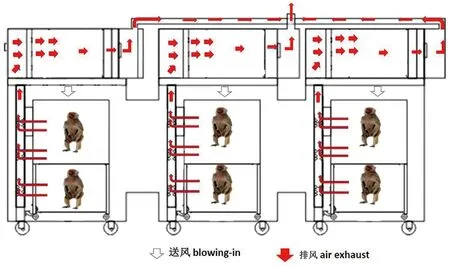
图2 感染性非人灵长类实验装置通风原理图Fig.2 Ventilation principle of the Non-human primate isolation device
1.2 设备参数设定及检测 按照《Ⅱ生物安全柜YY5069-2011》中的气流烟雾模式测试方法,使用空气定向检测仪(HBI-201,优礼福公司),观察负压设备工作窗口气流模式。同时使用热敏式风速仪(AR866A,希玛公司)检测截面风速。图中下笼展示为工作创口的结构图,其中红色圈 “O”处为检测点位置,共10个(如图3)。
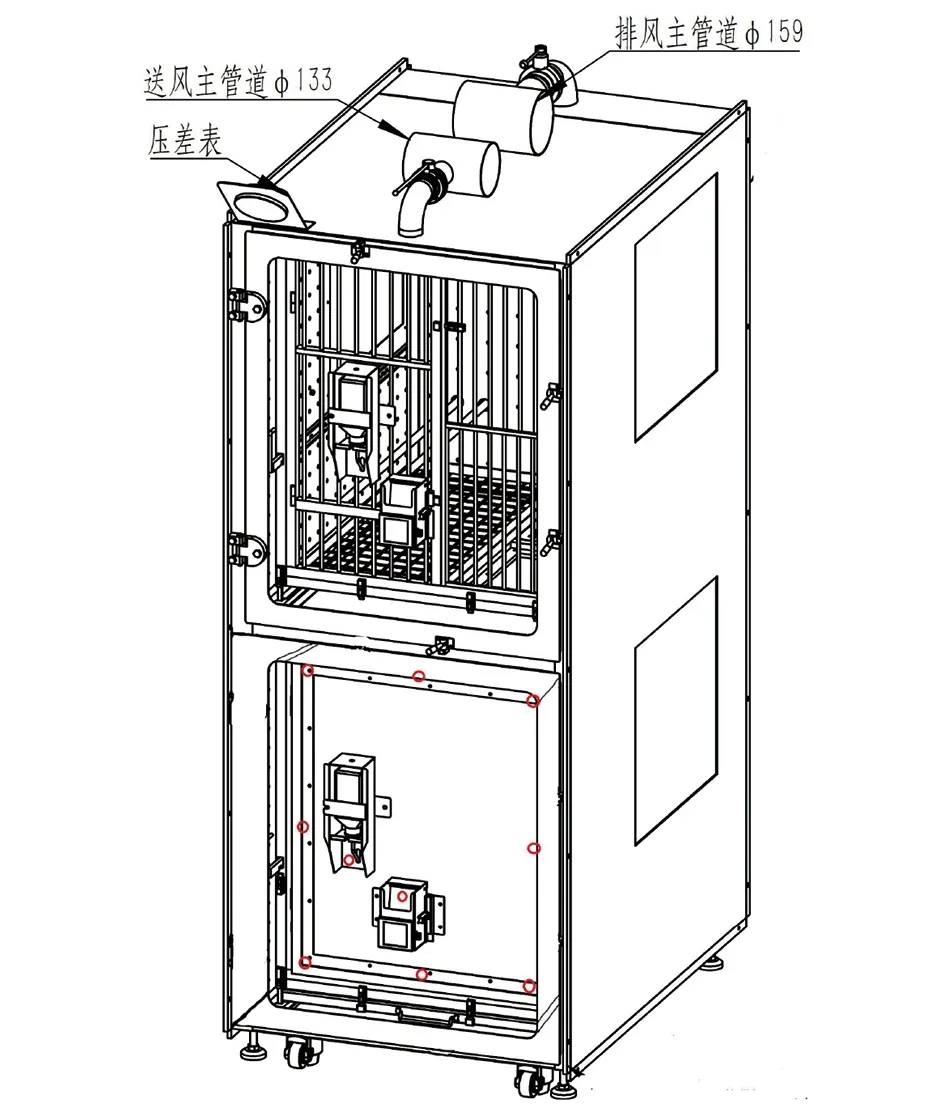
图3 感染性非人灵长类实验装置内监测点分布图Fig.3 Detection points in the Non-human primate isolation device
1.3 指示菌和生物气溶胶发生模型制备 大肠杆菌为环境中常见微生物,且在普通环境中生存能力较强,为排除自然环境中大肠杆菌对实验的干扰,采用具有氯霉素抗性基因的基因工程菌作为指示微生物。在开放笼门和密闭笼门两种状态下,对自主研发的非人灵长类实验装置内微生物进行检测[4]。氯霉素抗性的大肠杆菌E.coli的基因工程菌株为Rossetta菌,在LB培养基中进行培养时加入浓度为50 μg/mL氯霉素(Cl+)。针对该菌的计数常采用固态的LB培养基。
将含有小鼠垫料的小鼠笼盒放入正常工作的隔离器,将过夜培养的指示菌液(5×1010个氯霉素抗性的菌)与小鼠垫料充分混合,再放入两只8周龄C57BL/6雌性小鼠(动物饲养繁殖AUP#2019078,实验项目号S01319050R)。小鼠在小鼠笼盒内翻腾垫料时,引起指示菌飞扬,模拟气溶胶的发生。
1.4 沉降指示菌采集 使用含有50 μg/mL氯霉素的LB固体培养基的培养皿(9 cm直径)采集实验装置内和生物安全实验室区域的沉降菌,采集时间为2 h,放在37 ℃培养箱中培养48 h,对平皿的菌落进行计数。实验方法参照 GB/T 14925-2010[5],采样点见图4:

图4 生物安全三级实验室内采样点分布图Fig.4 Sampling points in the facility and animal isolation device at the ABSL-III laboratory
1)空白对照,IV房间,两个放置点(IV房间1#和2#取样皿);
2)III房间,四个方位,各一个放置点(III房间1-4#取样皿);
3)III房间实验笼内笼门正下方,2个放置点(III房间5-6#取样皿);
4)内笼的四个方位,各一个放置点(III房间7-10#取样皿);
5)外笼门正下方,1个放置点(III房间11#取样皿)。
1.5 生物气溶胶颗粒收集 参照GB14925-2010实验动物环境及设施空气洁净度检测方法采集实验装置内生物气溶胶颗粒。使用气体撞击采样器(FSC-A6,宏瑞公司)进行收集。气流速度为28.3 L/min,采样时长15 min/次,采样孔径为第6级(0.65~1.1 μm),内含50 μg/mL氯霉素的LB固体培养基的培养皿(9 cm直径)[6]。
1.6 实验装置的消毒验证 非人灵长类笼的消毒采用汽化过氧化氢发生器(HTY-SUPER SD2,泰林公司)管道消毒模式,将过氧化氢消毒机的进出气口分别于猴笼主机的进出风口相连,汽化的过氧化氢通过进风口进入主机送风系统、猴笼和主机排风系统,然后进入过氧化氢发生器进行循环消毒(如图5)。参数设置:湿度30%,灭菌时间30 min,除残40 min,过氧化氢蒸汽流量4.0 L/min。于1、2号笼的4个笼位(1、2号笼位置如图1所示)分别在远近端放置过氧化氢化学指示条(TERRAGENE)和APEX钢片式生物指示剂(HMV-091,含嗜热脂肪芽孢杆菌孢子),灭菌结束后将APEX钢片式生物指示剂放入含颜色指示剂的TSB液体培养基(MesaLabs),56 ℃培养7 d后观察结果,培养时设置阳性对照。判断标准:化学指示条颜色由棕色变成黄色表示经过了过氧化氢消毒;液体培养基颜色未变色(紫色),表示未有细菌生长,颜色变黄或浑浊,表示有菌生长。最终以化学指示条变黄且培养液未变色(紫色)判断为消毒合格。

图5 过氧化氢消毒方式示意图Fig.5 Schematic diagram of hydrogen peroxide disinfection
2 结 果
2.1 实验装置基本参数 如图6所示,在开门状态下,测试饲养内笼与负压外套之间通风截面的定向气流流速,均能形成明显的定向气流。4个笼位的四周截面流入气流平均流速为0.408 75 L/min。上下侧截面风速的数值有一定的差别,但左右侧截面的定向气流数值较为均衡,如图6所示。
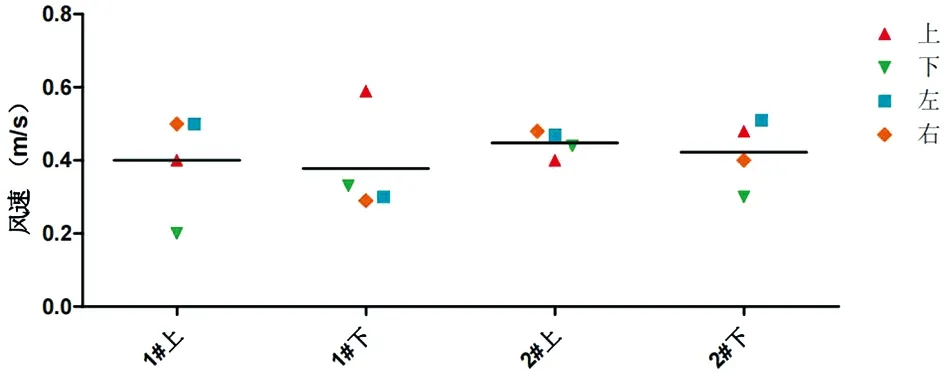
图6 笼位内笼与外套之间截面的定向气流Fig.6 Directional airflow in the cross-section between the cage and the outer shell
2.2 指示菌检测 按照所示位置放置含氯霉素的LB平皿采集下沉菌落(图7)。在进行实验之前,所有位置放置的平皿均未检测到指示菌。 在非人灵长类笼内放置模拟气溶胶发生模型的制备。将外笼关闭,将平皿开盖放置指定位点,放置2 h后收集平皿,放在37 ℃培养箱中培养48 h,对平皿的菌落计数。检测结果发现,外笼关闭状态下,房间内、笼外及外笼均未检测到指示菌,仅在内笼检测到指示菌富集(7±8.25)(图7A)。而将外笼打开进行实验,检测结果发现,外笼开启状态下,房间内、笼外及外笼同样均未检测到指示菌,仅在内笼检测到指示菌富集(4±3.67)(图7C)。且内笼气流顺风端平皿富集的指示菌数量大于逆风端(图7B和D)。

方位1#上1#下2#上2#下上0.40.590.40.48下0.20.330.440.3左0.50.30.470.51右0.50.290.480.4
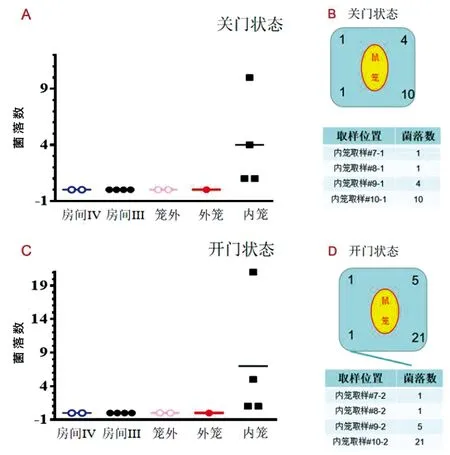
图7 收集指示菌的数量和分布Fig.7 Number and distribution of collected indicator bacteria
2.3 生物气溶胶检测 在15 min内采集实验装置各部位0.65~1.1 μm的生物气溶胶(图8),内笼各部位均有指示菌气溶胶,其中内笼中间部位气溶胶颗粒浓度最高(15个)。笼外房间及内笼门侧门外均未收集检测到指示菌气溶胶颗粒。
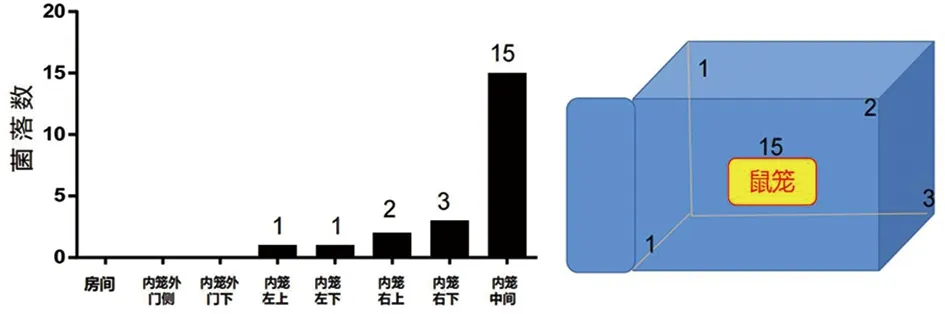
图8 生物气溶胶收集及分布Fig.8 Collection and distribution of bioaerosols
2.4 动物实验装置消毒验证 将模拟气溶胶发生模型移出,对实验装置内部进行过氧化氢蒸汽循环消毒。结果如图9所示,图9A为过氧化氢化学消毒指示条结果(最右侧试纸条为未经过氧化氢消毒的阳性对照纸质条,未变色为棕色);图9B为APEX钢片式的生物指示剂消毒后的菌片培养结果(9号为未经过氧化氢消毒的阳性对照试管,变为黄色)。图中1-8号指示条和菌片分别对应的位置分别为:1、2是1#上笼位的远、近端;3、4是1#下笼位的远、近端;5、6是2#上笼位的远近端;7、8是2#下笼位的远近端。放置于1#和2#四个笼位中近端和远端共8个位置上的化学指示条的颜色由棕色变为黄色,表示指示条所处的位置经过了过氧化氢的消毒;APEX钢片式生物指示剂培养液没有变色(紫色),表示指示剂上的嗜热芽孢杆菌已被灭活。

图9A为过氧化氢化学消毒指示条结果;图9B为APEX钢片式的生物指示剂消毒后的菌片培养结果图9 实验装置消毒效果检测Fig.9 Detection of the effects of disinfection on the experimental device
3 讨 论
感染性动物实验装置其主要的功能要求有3方面:一是根据实验所需的动物生活习性,满足所饲养的动物在生存方面的需求。二是能根据实验供试品的生物安全等级和要求,在设计使用时确保生物安全。三是使用具有灵活性,其在设计使用时应当便于进行实验操作。在满足各项动物福利的同时,也不能出现任何生物安全方面的问题[7]。传统饲养笼具规格庞大且安装起来十分复杂,很难根据动物的生活习性进行调整。目前国内也并没有针对高等级生物安全实验室内猴隔离器的原位消毒标准,很难对猴笼进行全方位的消毒。近年来,特别是新冠肺炎疫情以来,从事病原微生物的研究人员不断增加,这就使得针对相关的病原微生物的生物安全问题,逐步成为人们备受关注的热点问题[8-12]。
大肠杆菌常被用作追踪环境、水和食品污染源的指示剂[13-15]。经过简单处理,溶液中的大肠杆菌即可形成气溶胶大肠杆菌气溶胶能作为指示剂,研究鸡舍周围的生物气溶胶来源及其向环境空气的传播方式,也被用于负压屏障设施动物饲养笼具暴露风险的测试和评估。因此,本文借助于大肠杆菌气溶胶,评估猴隔离器的阻止气溶胶感染的效果。
通过定向气流的检测和制造指示菌气溶胶发生模型的方法,经落下菌自然沉降收集和气体撞击采样器主动收集后培养,均证明无论其外笼在打开还是在关闭状态下,内笼内产生的细菌/气溶胶均未在笼外检测出,使病原微生物被隔离在笼内。可见,该装置能有效防止气溶胶污染的风险,能将病原微生物暴露风险控制在隔离笼内,这有助于为一些病原体自然感染的研究提供新的设备平台。
在消毒方面,采用循环过氧化氢蒸汽消毒的方法能够有效地进行原位消毒。这大大提高了实验装置的消毒效率和装置循环使用的生物安全可靠性。此种针对非人灵长类实验装置的原位消毒方法将会为国内该类型装置的消毒提供参考依据。
相较于传统非人灵长类笼装置,该实验装置的实施能够制定相关设备的技术标准,建立可靠的现场评价方法,提供安全可靠的操作规程。且在设计上采取了内笼和外笼设计、上下层布局,饲养笼可以进行组合和拼装。这种设计能够根据生物安全实验室核心区的使用面积自由组合隔离器的数量。还能根据猕猴群居的特性,在隔离器之间设计动物通道,使非人灵长类笼之间贯通。这种理念首次出现在生物安全实验室内非人灵长类饲养隔离器的设计中,能够大大增加实验动物福利,同时也为一些病原体自然感染的研究提供了新的设备平台。
利益冲突:无
引用本文格式:李巧红,鲜巧阳,王蓓,等.一种感染性非人灵长类实验装置的生物安全研究[J].中国人兽共患病学报,2021,37(11):965-970. DOI:10.3969/j.issn.1002-2694.2021.00.144

