高毒力肺炎克雷伯菌中KPC-2型碳青霉烯酶对细菌毒力的影响
祝俊英, 魏 清, 沈 震, 袁 挺, 李 敏
肺炎克雷伯菌(Klebsiella pneumoniae)被WHO列为“紧急威胁” 人类健康的病原菌,可引起严重的肺炎、血流感染及肝脓肿等[1]。目前对临床威胁最大的主要是碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKP)和高毒力/高黏液肺炎克雷伯菌(hypervirulentKlebsiella pneumoniae, hvKP)[2-3]。CRKP主要引起医院获得性感染,毒力低但耐药率高,肺炎克雷伯菌对碳青霉烯类药物的耐药机制是产碳青霉烯酶,临床常见的碳青霉烯酶主要有 KPC-2、NDM-1及 OXA-48[4]。相较于 CRKP,hvKP多表现为高黏液表型,耐药率低但毒性较强,主要引起社区获得性肝脓肿,且极易引发眼内炎和脑膜炎等侵袭综合征,致死率及致残率较高[5]。随着细菌耐药及毒力的传播扩散,毒力高且对碳青霉烯类耐药的肺炎克雷伯菌不断出现。2016年Zhang等[6]首次报道了浙江地区由K1型ST1797碳青霉烯类耐药高毒力肺炎克雷伯菌(carbapenemresistant hypervirulentKlebsiella pneumoniae,CR-hvKP)引起的医院感染,引发了极大的关注。
本研究通过体外过表达blaKPC-2并转化hvKP的方法构建碳青霉烯类耐药的hvKP株,即CR-hvKP,比较hvKP耐药前后细菌毒力变化, 现将结果报道如下。
1 材料与方法
1.1 菌株及来源
收集上海交通大学医学院附属仁济医院2018年1—12月临床标本中分离的3株碳青霉烯类敏感的高毒力肺炎克雷伯菌(carbapenem-sensitive hypervirulentKlebsiella pneumoniae, CS-hvKP) 作为实验菌株。体外药物敏感性试验采用肉汤微量稀释法。参照美国临床和实验室标准化协会(CLSI)方法进行[7]。
1.2 高黏液表型(HM)检测、荚膜血清分型及毒力基因检测
1.2.1 拉丝试验 采用黏液拉丝试验检测细菌高黏液表型,用接种环轻触血琼脂平皿上过夜培养的新鲜菌落向外牵拉,重复牵拉2次,若2次均有黏液丝形成并且长度大于5 mm即判为HM表型阳性[8]。
1.2.2 毒力基因PCR检测 采用PCR方法扩增检测10种毒力基因及6种常见荚膜血清分型,毒力基因包括(rmpA、rmpA2、iroB、iutA、ybtS、entB、allS、mrkD、magA、kfu),血清型包括K1、K2、K5、K54、K57 及K20。PCR扩增引物及条件参照文献[9-10]。
1.3 细菌分子流行病学检测
采用多位点序列分型(MLST)对hvKP进行同源性分析。PCR扩增细菌7个管家基因片段(rpoB、gapA、mdh、pgi、phoE、infB、tonB)后测序,结 果 与 网 站(https://bigsdb.pasteur.fr/klebsiella/klebsiella.html)进行比对。
1.4 转化株CR-hvKP(blaKPC-2)构建
1.4.1 pHSG396-KPC重组质粒的构建 自行设计blaKPC-2基因全长的扩增引物,5’处添加酶切位点和保护碱基,引物信息见表1。选取临床上分离的经PCR扩增并测序分析后确定为blaKPC-2阳性的肺炎克雷伯菌,采用煮沸法制备模板,扩增blaKPC-2,将PCR产物酶切后连接至pHSG396载体上,并转化至DH5a感受态细胞,在含50 mg/L氯霉素的LB平板上筛选阳性转化子,将转化子增菌培养后,抽提重组质粒,核酸定量后-20℃保存备用。

表1 pHSG396-KPC重组质粒构建的扩增引物Table 1 Amplification primer for construction of pHSG396-KPC recombinant plasmid
1.4.2 pHSG396-KPC重组质粒的转化 将3株临床分离的hvKP增菌培养至对数期,制备电转化感受态细胞,将pHSG396-KPC重组质粒电转至敲除株中,在含50 mg/L氯霉素的LB平板上筛选阳性转化子,鉴定转化成功的细菌为CR-hvKP,即blaKPC-2转化株。
1.5 血清抵抗试验体外检测细菌毒力
采用血清抵抗试验检测细菌对血清中补体等杀菌物质的抵抗能力,方法参考文献[11]。将待测菌株增菌培养至对数生长期并调整菌液浓度为1×106CFU/mL,将上述菌液分别与健康成年人的混合血清按照体积比1∶3混合在一起,37℃孵育,对孵育0 h、1 h、2 h和3 h后混合物进行活菌数计数(viable counts, VC)。计算存活率(survival rate, SV),即 1 h/0 h、2 h/0 h、3 h/0 h 相应表示为SV1h、SV2h及SV3h。按照参考文献[12]根据细菌存活率变化划分为6个等级(1级:SV1h<10%,SV2h<10%,SV3h<0.1%;2级:SV1h10%~100%, SV3h<10% ;3 级 : SV1h>100%,SV2h<100%,SV3h<100% ;4 级 :SV1h>100%,SV2h>100%, SV3h<100% ;5 级 :SV1h>100%,SV2h>100%,SV3h>100%在第三阶段菌落数有所下降 ;6 级 :SV1h>100%, SV2h>100%, SV3h>100%在3个阶段菌落数一直上升),1级和2级为对血清中杀菌物质敏感,3级和4级为中介,5级和6级为耐药。
1.6 结晶紫染色法测定生物膜形成能力
生物膜测定参考文献[13],将待测菌液浓度调整为1×107CFU/mL,取150 μL待测菌株加入96孔平底板,同时做3个复孔,37℃孵育16~24 h后用0.5%的结晶紫染色20 min, 蒸馏水将未结合染料冲洗干净,结合染料用95%乙醇溶解后检测600 nm处吸光度(D)。实验重复3次,取平均值。将生物膜形成能力按照D600测定值作以下分类:强生物膜形成能力(D600>0.5),中等生物膜形成能力(0.2≤D600≤0.5),弱生物膜形成能力(D600<0.2)。
1.7 细菌黏液性检测及荚膜多糖测定
1.7.1 低速度离心法检测细菌黏液性 细菌黏液性测定参照文献[13],将培养6 h的菌液浓度调整至D600为1.0,低速度(1 000×g)离心5 min,测定上清液D600。与低黏液性菌株相比,高黏液性菌株沉淀不坚实,且上清液较为浑浊,D600较高。
1.7.2 苯酚-硫酸法检测细菌荚膜多糖含量 细菌荚膜多糖提取及测定参照文献[14]。500 μL过夜菌与100 μL含有1% zwittergent 3-14的柠檬酸(pH 2.0)混合,50℃孵育过夜,离心取上清液250 μL,加入无水乙醇,4℃沉淀荚膜多糖,30 min后离心去掉上清液,沉淀在管底的荚膜多糖晾干后用100 μL蒸馏水溶解。提取好的荚膜多糖与一定浓度范围(0、50、100、150、200 mg/L)的糖醛酸标准品均进行以下测定,加入600 μL硫酸(含12.5 mmol/L硼酸),煮沸5 min后,加入3-氨基苯酚至体积比为0.15%,测定D520,荚膜多糖含量经糖醛酸标准曲线计算得出。同时,对500 μL过夜菌进行稀释计数,最终,荚膜多糖含量经换算单位表示为μg/109CFU。
1.8 荧光定量PCR(RT-PCR)检测荚膜多糖结构基因及调控基因转录水平
提取hvKP野生株及blaKPC-2转化株的mRNA,利用反转录试剂盒反转录为cDNA。RT-PCR检测hvKP野生株及blaKPC-2转化株荚膜多糖结构基因orf1-2(galF)、orf3-15(wzi)、orf16-17(manC)及调控基因rmpA、rmpA2转录水平表达量。采用2-ΔΔCT法计算基因转录水平表达差异。hvKP野生株为对照菌株,23S rRNA 为内参基因,以rmpA基因为例,如下所示:
ΔCT= CT(rmpA基因)-CT(23S rRNA基因)
-ΔCt=ΔCT(hvKP野 生 株 )-ΔCT(blaKPC-2转化株)
2-ΔΔCT即为rmpA基因的表达量。
2 结果
2.1 hvKP野生株荚膜血清型、毒力基因分布及临床资料
3株hvKP野生株均为HM阳性。其中1株(K1843)为ST23 K1型,来源于急诊内科,标本类型为静脉血,所检测的10种毒力基因均为阳性。2株为ST65 K2型,来源于住院患者,标本类型分别为痰液(K1953)及肝穿刺液(K1722),2株hvKP 中rmpA、rmpA2、iroB、iutA、ybtS、entB、mrkD均为阳性,magA、allS及kfu均为阴性。见表2和表3。

表2 3株hvKP临床资料及分子分型特征Table 2 Clinical data and molecular typing of the 3 hypervirulent Klebsiella pneumoniae strains

表3 3株hvKP药敏结果及毒力基因携带情况Table 3 Antimicrobial susceptibility and prevalence of virulence genes among the 3 hvKP isolates
2.2 blaKPC-2转化株的特性
琼脂糖凝胶电泳结果见图1,hvKP野生株中blaKPC-2为阴性,而过表达株中blaKPC-2为阳性,即为过表达及转化成功,此外,药敏试验也显示,hvKP野生株对亚胺培南和美罗培南敏感,而blaKPC-2转化株对这两种药物转为耐药,该结果也可证实过表达及转化成功。
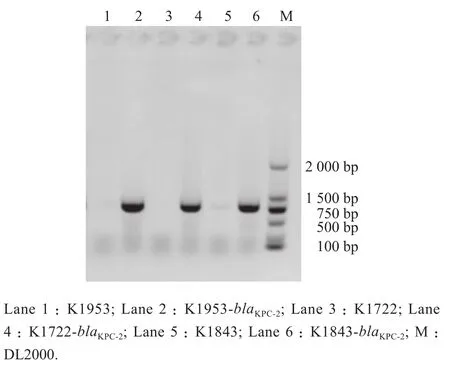
图1 hvKP野生株与blaKPC-2转化株琼脂糖凝胶电泳鉴定图Figure 1 Identification of wild-type hypervirulent Klebsiella pneumoniae and blaKPC-2 transformants by agarose gel electrophoresis
血清抵抗试验显示,K1843野生株在1 h、2 h及3 h生存率均超过100%,但在3 h时细菌存活率有所下降,按照判定规则可判定为5级,对血清中杀菌物质耐受。同样地,K1953和K1722均可判定为3级,对血清中杀菌物质中介。而blaKPC-2转化株均可判定为1级,对血清中杀菌物质敏感。见图2。
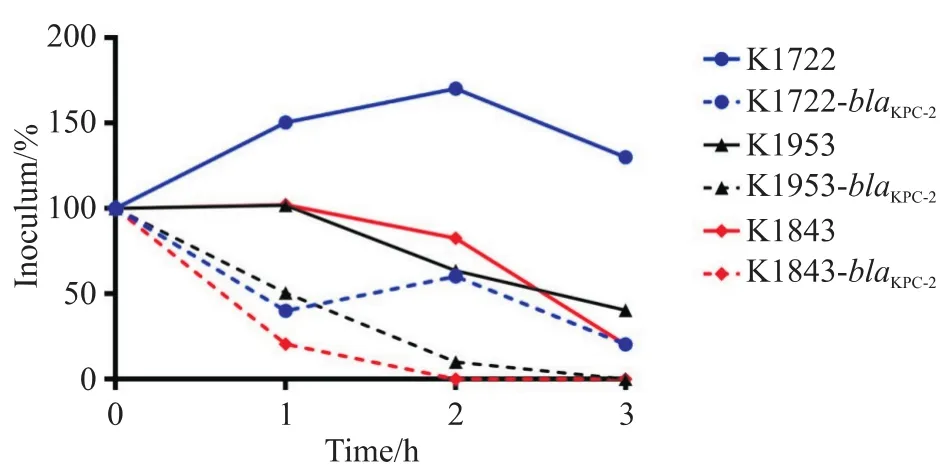
图2 hvKP野生株与blaKPC-2 转化株血清抵抗试验结果Figure 2 Serum assay of hvKP wild-type and blaKPC-2 transformants
生物膜测定结果显示,K1722野生株与blaKPC-2转化株生物膜形成能力没有差异。与K1953和K1843野生株相比,相应的blaKPC-2转化株生物膜形成能力明显下降,差异具有统计学意义,见图3。

图3 hvKP野生株与blaKPC-2 转化株生物膜实验Figure 3 Biofilm assay of hvKP wild-type and blaKPC-2 transformants
2.3 细菌黏液性及荚膜多糖含量检测
与3株hvKP野生株相比,blaKPC-2过表达株经低速度离心后,底部沉淀形成坚实,上清液较为清澈,黏液性明显降低,且荚膜多糖含量明显下降。见图4A。
采用苯酚-硫酸法测定荚膜多糖含量并经标准曲线计算发现,3株hvKP野生株荚膜多糖含量明显高于blaKPC-2过表达株,差异具有统计学意义(P<0.001),见图4B。
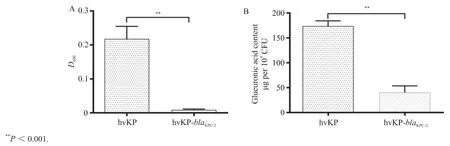
图4 hvKP野生株与blaKPC-2转化株荚膜多糖含量及黏液性测定Figure 4 Capsular polysaccharide production and mucoviscosity of hvKP wild-type and blaKPC-2 transformants
2.4 blaKPC-2转化株荚膜多糖结构基因及黏液表型相关基因转录水平表达变化
hvKP野生株与blaKPC-2转化株荚膜多糖结构基因及黏液相关基因转录水平差异经RT-PCR方法检测,结果显示,blaKPC-2转化株3个结构基因(galF、wzi、manC)及黏液表型相关基因(rmpA、rmpA2)表达下调30%~70%,差异具有统计学意义,见图5。
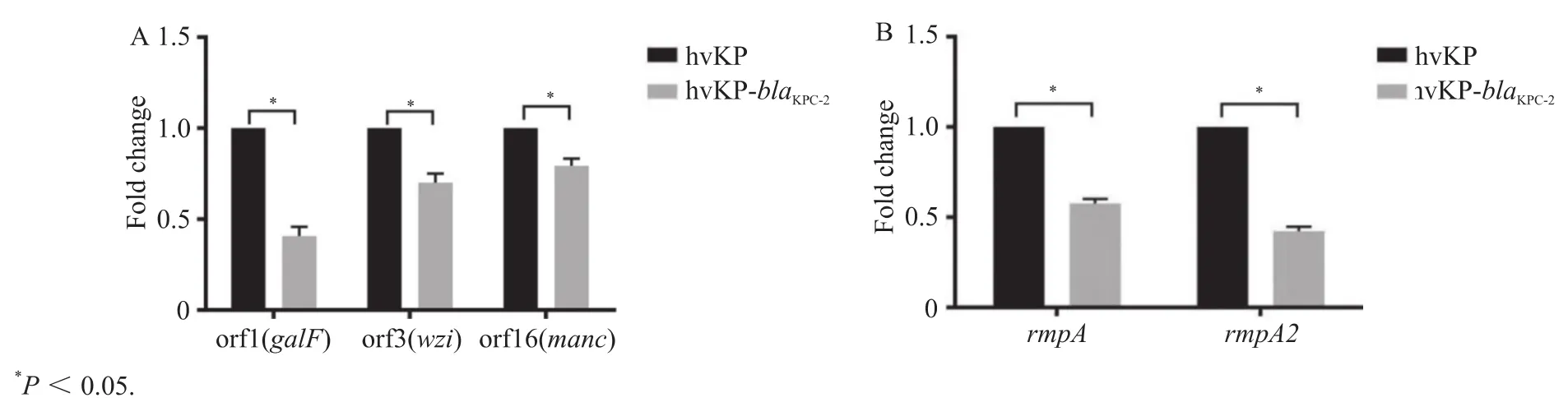
图5 hvKP野生株与blaKPC-2转化株荚膜多糖结构基因(A)及黏液相关基因(B)转录水平差异Figure 5 Transcriptional levels of capsular polysaccharide construction genes (A) and mucoviscosity related genes (B) in hvKP wild-type and blaKPC-2 transformants
3 讨论
随着抗生素使用及细菌间可移动元件的传播扩散,新的超级细菌不断出现。近年来,自浙江地区2019年首次报道了CR-hvKP后,该菌在临床上检出率越来越高,且已经出现了由CR-hvKP引起的医院暴发感染的报道[15]。然而hvKP获得碳青霉烯类耐药基因如blaKPC-2后,对于细菌毒力的影响至今报道较少。近年来,众多研究发现,细菌耐药性的产生对细菌有多方面的影响。有学者认为细菌获得耐药性后会增强细菌毒力,也有学者认为会降低细菌毒力。Pozzi等[16]研究表明,耐甲氧西林金黄色葡萄球菌(MRSA)可通过影响细菌生物膜表型、降低细菌蛋白酶产生而降低细菌致病力,此外,MRSA还可通过干扰细菌群体感应调节系统下调毒力细菌毒力基因表达。Choi等[17]通过体外改变hvKP脂质A结构构建黏菌素耐药菌株,结果发现与野生株相比,黏菌素耐药株黏液表型下降,荚膜多糖含量降低,毒力基因magA和rmpA2表达下降,细菌毒力降低。
本研究通过体外过表达blaKPC-2并转化hvKP的方法构建blaKPC-2转化株,比较同一遗传背景下细菌获得耐药性后对毒力的潜在影响。结果发现hvKP获得blaKPC-2后细菌对血清中杀菌物质的抵抗能力下降,生物被膜形成能力下降,细菌黏液性下降,荚膜多糖结构基因及调控基因转录水平下降,荚膜多糖产生量降低,即细菌毒力降低。然而Siu等[18]通过接合实验将blaKPC-2和blaKPC-3接合至K1型hvKP,结果发现hvKP仍对血清中杀菌物质保持较高的抵抗能力及毒力。本研究与其他研究结果的差异可能与细菌获得耐药的途径不同,本研究所采用的是过表达blaKPC-2,而Siu等[18]采用接合实验的方法使hvKP野生株产生耐药。此外,研究结果不同可能与实验所选取的细菌本身的遗传背景等有关。
无论细菌耐药性的产生对细菌毒力是增强还是减弱,都是细菌适应环境后,向有利于细菌生存方向发展的表现。本研究结果显示肺炎克雷伯菌获得碳青霉烯类耐药后会导致细菌毒力因子荚膜多糖量降低,但是临床上已经出现了高毒力、高耐药菌株导致患者死亡的案例[15],这些超级细菌的出现会给临床抗感染治疗带来极大的威胁,研究细菌毒力与耐药性之间的关系对于临床感染性疾病的诊断、治疗及预防十分重要。

