HPV16、18、52与宫颈疾病的关联研究
王虹娟
(山西省中西医结合医院, 山西 太原 030013)
宫颈疾病是临床常见的女性宫颈区域病变,例如宫颈炎、子宫内膜异位、宫颈癌前病变、宫颈癌等[1]。其中宫颈癌是女性各种恶性肿瘤中患病率最多的一种癌症,影响女性健康生活体验,大大降低其生活质量水平,严重者会威胁生命健康。在发展中国家,宫颈癌发病率和致死率仅低于乳腺癌和肺癌[2]。数据统计分析发现,全球宫颈癌每年新发病例有57万人次,其中死亡病例占据2/3[1];我国宫颈癌发病年增长人数约10余万,占据全球新发病例总数的20%[3]。高危型人乳头瘤病毒(HPV)是一种常见嗜黏膜、皮肤的环状双链DNA乳头状病毒,由病毒蛋白外壳和核心DNA构成[4],HPV感染是宫颈疾病的重要诱因,其持续感染会大大增加宫颈癌发生率。
本研究将宫颈疾病患者作为研究对象,设定HPV16、18、52为考察指标,采用RT-PCR法,分析并研究推测宫颈疾病患者与HPV16、18、52的关联性,以期为临床宫颈疾病预防、诊断以及治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2015年3月~2019年5月山西省中西医结合医院妇科住院、门诊的宫颈癌、宫颈炎等宫颈疾病患者150例为研究对象,其中宫颈癌患者(宫颈癌组)75例,年龄24~64岁,平均(47.4±19.9)岁;宫颈炎患者(宫颈炎组)75例,年龄20~61岁,平均(36.7±18.8)岁,同期随机取正常对照组(宫颈正常组)70例,年龄28~60岁,平均(38.6±20.4)岁,共计220例样本,各组之间一般资料无差异(P>0.05)。
所有宫颈癌患者均已通过组织活检确诊,详细记录临床诊断。本研究已通过医院伦理委员会审核,且全部患者均对本研究知情同意。按序依次采集所有试验参加者的宫颈脱落上皮细胞。标本采集后迅速处理,并置于-70℃冰箱保存备用。
1.2 仪器与试剂
主要仪器为实时荧光定量PCR分析仪(ABI-7500,产于美国 ABI 公司);Thermo Fisher B2生物安全柜(美国 Thermo Fisher公司),Fresco 17高速冷冻离心机(美国Thermo Fisher公司)。主要试剂为高危型人乳头瘤病毒核酸(分型)检测试剂盒(湖南圣湘生物科技有限公司)。
1.3 方法
样本类型为宫颈脱落细胞。样本采集时必须为非孕期,沟通告知病人最佳采集时间(备注最佳采集期为妇女绝经前,月经中后期为最佳理想采集时期,切记避开经期);采集样本前,叮嘱病人检查前不能涂抹使用任何阴道药膏,排除因异物造成收集细胞的困难。去掉有子宫切除史或盆腔放疗史的样本;采集样本前,叮嘱强调病人采样前48 h内禁止性交、盆浴和阴道检查等活动。
采用一次性宫颈细胞采集器进行样本采集,具体步骤如下:将检测专用宫颈刷缓缓伸入,将刷头轻轻引置于宫颈管内鳞柱上皮交界,刷头前伸至贴紧宫颈口周围,沿顺时针方向旋转缓慢转动十圈以上,禁止反向转动采样。旋转完成后缓慢取出宫颈刷,置于无菌样本管中,逐一检查,整理标记复核对应样本和检验申请单标记号码,用移液枪加2 mL生理盐水于样本管中,待检。采集的标本应立即进行检测,如暂不检测,室温放置应低于24 h,于4℃冰箱冷藏保存时尽量不多于5 d,-20℃冷冻条件下保存不多于7个月,反复冻融低于7 d。
将试剂盒中试剂于室温放置至室温相平,涡旋混匀,设置离心条件为10 000 r/min,离心20 s后备用。分别精密吸取人乳头瘤病毒(16、18、33、39)、人乳头瘤病毒(45、59、35、66)、人乳头瘤病毒(51、52、53、68)、人乳头瘤病毒(31、56、58、β-球蛋白) PCR 反应液n×38 μL 分别与4份n×2 μL 酶混合液(n=待检样本数+质控品2个),充分混匀制成PCR反应液,同样条件下再次离心20 s,备用。
将无菌样本管中的样本置于漩涡振荡器中,充分震荡洗脱2~3 min,分别移至预先备好的两支灭菌离心管中,一支用于留样复检,一支用于待测。取其中一份样本,10 000 r/min离心10 min,弃上清液,离心管底部沉渣加入100ml生理盐水,充分吹打混匀、备用。准备一支新的灭菌离心管,吸取预处理后的样本25 μL并同时加入25 μL核酸释放剂,充分吹打混匀,作为待测样本备用。吸取25 μL阴性对照、阳性对照,分别与25 μL核酸释放剂吸打混匀,待用。将每个PCR反应管中加入上述处理好的待测样本、阴性对照、阳性对照各10 μL,重复4次,注意吸取不同样本时必须更换吸头,加样结束后,室温静置10 min以上,将40 μL上述已配制好的4种PCR混合液分别对应加入4个反应管,盖上管盖,轻轻涡旋后待测。
将上述加好样的PCR八联管放置于PCR扩增仪样品槽中,按照加样顺序依次分别设置并标注样本名称为阴性对照、阳性对照以及各待测样本。选择FAM通道,检测人乳头瘤病毒16、45、51、56-DNA;选择HEX或VIC 通道检测人乳头瘤病毒18、53、58、59-DNA 选择 ROX 通道,检测人乳头瘤病毒35、39、68-DNA 及β-球蛋白;选择CY5通道,检测人乳头瘤病毒31、33、52、66-DNA,进行检测。循环参数设置为:50℃ 2 min;94℃ 5 min;94℃ 15 s,57℃ 30 s,共45个循环。
1.4 统计学方法
利用SPSS 21.0软件进行统计学处理分析。以例数或拷贝数代表计数资料,采用χ2检验,当P<0.05时,结果具有统计学差异。
2 结果
2.1 各类宫颈病变组织HPV16,18,52型分布及DNA水平
宫颈癌组患者HPV16,18阳性检出率、DNA拷贝数与宫颈炎正常组比较有统计学差异(P<0.05)。宫颈炎组HPV52型阳性检出率、DNA拷贝数与宫颈炎正常组比较有显著性差异(P<0.05)。见表1、2。
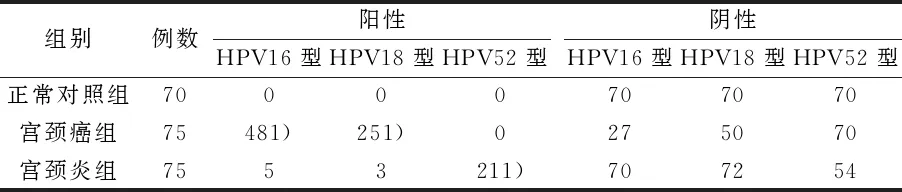
表1 各类宫颈病变组织HPV16,18,52型分布 例

表2 各类宫颈病变HPV16、18、52型DNA水平
2.2 HPV16、18、52在各类宫颈疾病的分布情况
检测结果分析显示;宫颈癌患者中HPV16亚型单一感染率最高,而宫颈炎患者中HPV52单一感染率居多。宫颈炎单一感染21例,多重感染8例;宫颈癌单一感染50例,多重感染23例。宫颈癌的单一感染率低于宫颈炎,见表3。同时反映出感染HPV16、18亚型很大程度可能会发生宫颈癌病变,且复合检出率中多为HPV16与其他亚型的复合感染。见表3。

表3 HPV16、18、52在不同疾病的感染分布 [n(%)]
3 讨论
国内外专家研究表明,宫颈疾病的发生和发展可能与各类人乳头瘤病毒感染有关[1-3]。德国Haras WzurHausen病毒学博士于1974年发现了HPV,第一次提出高危型HPV病毒感染是宫颈疾病的主要诱因,证实HPV与宫颈癌存在着必然的联系[5,6]。本研究对患者HPV16,18,52基因进行分析,研究结果表明宫颈癌患者HPV16型病毒阳性率为64%,HPV18型病毒阳性率为33.3%。宫颈炎患者中HPV16型病毒阳性率为6.7%,HPV18型病毒阳性率为4%,HPV52型病毒阳性率为28%,且DNA拷贝数随疾病严重程度而呈现增加趋势。据统计结果发现宫颈疾病类型与HPV不同亚型有很大程度相关性,阳性检测结果中HPV16、18亚型在宫颈癌组表达高于宫颈炎,而宫颈炎组HPV16、52亚型的检出率明显,同时发现HPV16易于其他亚型产生复合感染,且HPV16、18亚型是引起宫颈癌病变的重要因素。因此可将检测HPV亚型类别做为早期宫颈疾病筛查依据,警惕女性宫颈癌变。而从各组HPV检测为阳性的患者年龄范围可分析看出宫颈疾病感染患者愈加年轻化,探求有效检测、提早预防的手段是非常有必要的。建议广大各年龄段女性定期检查各类HPV病毒,早期筛查,及时诊断,预防或避免宫颈疾病的发生和扩散,保障自身健康和生活质量。

