双重释放双氯芬酸钠的可溶性透明质酸微针的制备与表征*
张 扬,刘光丽
(1.陆军炮兵防空兵学院 机械工程系,安徽 合肥 230031;2.安徽医科大学 生物医学工程学院,安徽 合肥 230032)
微针技术作为一种新型的经皮给药技术已经在生物制药领域得到了广泛的探索[1-2]。与传统的皮下注射相比,微针技术最大的特点就是将传统的注射针头微型化,并以阵列的形式进行排列。经过微针技术的不断发展,制备的材料已由传统的不锈钢等金属材料向现在的透明质酸、麦芽糖等高分子聚合物发展[3-4]。现如今大多数观点认为,通过在血管丰富的真皮层中形成亲水通道,微针可以促进药物向全身循环传递,微针还可以促进药物分子透过表皮和真皮进入皮肤深层组织[5-6]。其优势是显而易见的,如不会对皮肤造成损伤,易于医护人员的管理、储存和处理以及不会引起患者的疼痛等[7-8]。
透明质酸是一种非硫酸化的糖胺聚糖,在真皮中含量最高,它是维持皮肤水分的关键分子之一,具有独特的保湿能力。在生物制药领域已经尝试将透明质酸输送到皮肤中。双氯芬酸钠作为一种低成本的非甾体抗炎药,在临床上常用于镇痛、抗炎、解热等目的[9-10],此药物由于对胃肠道有较大的刺激,所以常常会限制其应用。在本文中将双氯芬酸钠与透明质酸结合制备可溶性微针,HA作为一种生物高分子材料,具有生物相容性和可生物降解性,并且HA和DS都是高度水溶性,因此选择HA作为制备微针的聚合物基质。在微针表面覆盖一层双氯芬酸钠粉末,探究了微针的制备工艺、机械强度和释放特性等参数,在增加药物输送总量的同时减少透明质酸微针的吸湿性。
1 材料与方法
1.1 材料与设备
材料:透明质酸粉末(hyaluronic acid, HA,医用级,华熙福瑞达生物医药有限公司)、磺酰罗丹明B(sulforhodamine B, SRB,分析纯,上海信裕生物科技有限公司)、双氯芬酸钠缓释片(diclofenac sodium, DS,医用级,江西仁和药业有限公司)、聚二甲基硅氧烷(polydimethylsiloxane, PDMS)微针模具(广东微科有限公司)、猪皮(当地屠宰场)、磷酸盐缓冲液(phosphate buffered saline, PBS,海克隆生物科技有限公司)、琼脂糖(分析纯,国药集团化学试剂有限公司)。
设备:202-OA真空干燥箱(南京华奥干燥设备有限公司)、紫外分光光度计Evolution 220(赛默飞世尔科技有限公司)。
1.2 方法
微针制备过程如下:去离子水配置一定浓度梯度的HA与DS的水溶液。搅拌均匀后倒入制备好的PDMS微针模具中抽真空3 min,使HA水溶液完全浸入型腔中。为了避免混合液在高温时过度失水,放置在37 ℃恒温状态下12 h完成干燥,取出微针,表面均匀涂抹DS颗粒。为了便于观察,通常微针中掺入1%(体积分数)的SRB粉末。在真空干燥过程中,为控制温度,将加湿器放置在真空干燥箱中设置37 ℃恒温。利用湿度计读数,通过控制加湿器的功率从而达到控制相对湿度的目的。具体的制备工艺如图1所示。

图1 微针制备工艺流程图
取成年猪的腹部离体皮肤,去除多余的皮下脂肪后平铺。将加入SRB的可溶性微针插入猪皮中,并保持插入状态2 min后除去剩余的微针,此过程测试微针刺入皮肤的性能。将微针刺入封口膜后露出针尖的部分浸泡入10 mL的PBS缓冲液中,观察微针在体外完全溶解的时间。称取15 g的琼脂糖粉末放置在100 mL的去离子水中,加热搅拌至完全溶解,冷却后得到透明琼脂糖凝胶,将融合了SRB的HA微针完全刺入琼脂糖凝胶中,确定微针在仿体模型中释放药物的情况。分别配制1~20 μg/mL的DS水溶液作为标准溶液,使用紫外分光光度计测得其在284 nm波长处有最大吸收,由此测定出DS水溶液的吸收-浓度标准曲线。在猪的腹部皮肤上进行体外透皮的试验,并将试验重复5次保证数据的可靠性,皮肤的平均厚度为(0.47±0.18)mm,对照组是浓度30%(质量分数)的DS溶液,1测试组是HA-DS微针,2测试组是微针表面涂覆DS的HA-DS微针,待微针穿刺皮肤并释放DS 24 h后,取1 cm2皮肤放于5 mL水中,待皮肤中的DS全部溶于水中后,使用紫外分光光度计测定水中DS的吸收曲线,对照标准曲线确定样本浓度。
2 结果与讨论
2.1 微针尺寸表征结果
制备的微针阵列是15×15的圆锥阵列,底面直径为380 μm,高度为860 μm,针尖距离为700 μm。微针阵列图如图2所示,图2a和图2b分别代表了表面未添加DS粉末和添加DS粉末的数码相机图;而图2c和图2d则是相对应的光学显微镜图。由于HA具有吸湿性,所以常常会在高湿度的环境中潮解。将烘干后的HA表面均匀地覆盖上DS粉末,由于微针的相对表面积减少,能有效阻止在高湿度下的微针的潮解。从图2中可以看到,表面覆盖了DS粉末相比没有覆盖DS粉末的微针能更长时间地保持微针结构的完整性。

a)未添加DS粉末的微针
2.2 HA浓度对微针成型的影响
HA浓度对微针的影响见表1。将温度设定在37 ℃,控制HA的浓度后发现,在低浓度状态下(20%),由于HA的含量在水溶液中的比例过低,完全干燥后无法产生实心的微针。而当浓度过高时,由于溶液的粘度过大,在干燥过程中常出现气孔、空腔等。分析主要原因是HA的浓度过高造成溶液流动性下降。经过反复试验,认为HA浓度为50%的状态下能够制备完整的微针阵列,同时不会产生气孔等缺陷,微针的制备性能主要受到HA浓度的影响。

表1 HA浓度对微针的影响
2.3 微针穿刺皮肤试验
采用成年猪的腹部皮肤进行穿刺试验模拟(见图3)。由图3可知,当微针插入皮肤后,皮肤中的组织液等溶液会溶解HA。皮肤表面的红色点阵说明微针已经完全扎入猪皮中,而红色的方框是因为微针四周的边缘与皮肤相接触,表明微针能与猪皮完全贴合而没有在施加压力的过程中发生脆断。

图3 微针穿刺皮肤实物图
2.4 微针在PBS溶液中的溶解速率
试验结果如图4所示,表面覆盖DS粉末的微针在颗粒的保护作用下刚开始溶解缓慢,在(11.15±0.13)s时,随着微针表面覆盖的DS的溶解,溶解速率增快;在(0.00±0.20)~(11.15±0.13)s时,无DS覆盖的微针会由于较大的接触面积快速溶解;在(30.03±0.15)s结束时,2种不同的微针的溶解速率相似。试验结果验证了当微针表面覆盖DS时能够有效控制微针的吸湿性。

图4 微针的溶解速率图
2.5 微针在仿体模型中的药物释放
微针的仿体释放试验如图5所示,微针在琼脂糖凝胶中不断释放SRB,红色的区域随着时间的增加而变大,开始时由于微针融入的SRB局部浓度较高,红色释放速度较快,随着局部浓度的不断降低,扩散速度逐渐变慢。在琼脂糖凝胶中仅需要(12±0.25)h则完全停止扩散。
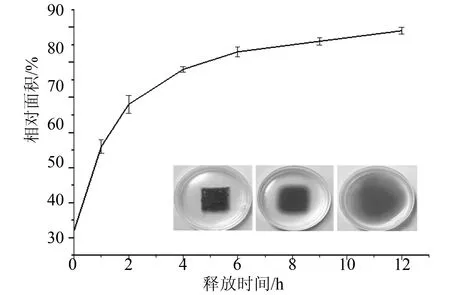
图5 微针的仿体释放试验
2.6 微针在组织的体外透皮试验
皮肤内DS的递送量见表2。表2列出了表皮和真皮内DS的递送量以及整体的递送量结果,在皮肤内的总递送结果显示,对照组(30%的DS溶液)和1测试组(HA-DS微针)的递送总量分别为(45.2±4.3)和(36±4.9)μg/cm2,2测试组(表面涂覆DS的HA-DS微针)的递送总量为(103.9±3.4)μg/cm2,皮肤内DS的总递送量明显增加。此外,真皮层中的数据也显示,表面涂覆DS的HA-DS微针可以更好地将药物递送到真皮层中。

表2 皮肤内DS的递送量
3 结语
本文基于可溶性微针技术制备了包封双氯芬酸钠的双重释放微针,并就微针的机械强度、释放速率和制备工艺等方面进行评价,拓展了其实际应用的可行性。双重DS微针在传统可溶性微针将药物与HA互溶的基础上,利用高分子材料特有的粘性,在表面进一步覆盖DS颗粒,从而进一步扩大了载药量,同时改善了水溶性微针容易吸水潮解的问题,对微针的临床应用和深入研究有着一定的参考价值。

