河北省适龄女性宫颈HPV感染现状及配偶感染情况分析
常玉梅 王薇 张凤喜 易洁 张俊杰
子宫颈癌是女性最常见的恶性肿瘤之一,其发病率和死亡率仅次于乳腺癌位居第二位,严重威胁女性健康[1-3]。宫颈癌是目前所有肿瘤中唯一明确病因、可早发现早预防早期治疗的肿瘤[4]。大量研究数据表明,人乳头状瘤病毒(human papilloma virus,HPV)感染与子宫颈上皮内瘤变及子宫颈癌的发病密切相关[5]。性接触为其主要传染途径。女性的一生中可反复感染HPV,也可同时感染多种不同型别的HPV[6,7]。同样也会导致男性外生殖器疣、阴茎癌、前列腺癌等的发生[8]。我国很多地区都进行了宫颈癌筛查和流行病学调查报道,目前没有河北省省直女性HPV检测结果分析,并未见关于感染HPV的宫颈病变情况的回顾性报道,以及配偶感染情况的分析。因此,本研究调查了河北省省直部分女性人群中各个年龄段的HPV感染情况,以及女性HPV感染者配偶(以下简称“感染者配偶”)外生殖器HPV感染状况,并对夫妻型别吻合率进行分析,报道如下。
1 对象与方法
1.1 调查对象 选择2009年4月至2020年10月,在河北省直属机关门诊部就诊及体检行 HPV 检查的女性5 000 例,年龄15~75 岁,平均55.6岁,HPV 结果异常者配偶行HPV检测。5 000例HPV共检测出阳性802例,对802例HPV感染者配偶或性生活>6个月的性伴侣,在自愿和知情同意的原则下,对其阴茎头上皮细胞和尿道口分泌物进行 HPV 分型检测,其中男性被检测者年龄15~65岁,平均47.04岁,女性被检测者年龄15~67岁,平均 45.37岁。所有患者签署知情同意书。女性纳入标准:①性生活>6个月适龄女性;②近6个月无不洁性生活史。
1.2 检测方法
1.2.1 HPV检测:检查前48 h内未阴道用药及冲洗、无性生活史。以专用 HPV 采样刷采集宫颈移行带脱落细胞,置于含有细胞保存液的样品管中,4℃保存,于3 d内检测。采用广东省潮州市凯普公司提供的HPV检测系统(含HPV-DNA提取试剂盒、HPV-DNA扩增试剂盒、医用快速杂交仪、HPV 检测试剂盒),扩增采用杭州博日PCR 扩增仪或德国 Biometra PCR 扩增仪,根据杂交位点不同,可检测21种中、高危型(16,18,31,33,35,39,45,51,52,53,56,58,59,66,68)和6 种低危型(6,11,42,43,44,81/cp8304)。
1.2.2 纳入与排除标准:女性排除标准:①妊娠期、哺乳期女性;②确诊宫颈癌及有宫颈病变治疗史的患者;③近6个月有不洁性生活史;④患有免疫功能低下及代谢性疾病。男性纳入标准:①其配偶或性生活>6个月的性伴侣; ②夫妻双方或性伴侣之间6个月内无不洁性交史。男性排除标准:① 6个月内有不洁性生活史; ②有尿道、生殖器其他感染性疾病尚未治愈者; ③患免疫功能低下、代谢性疾病等。
1.2.3 男性取材方法:所有男性患者按照顺序依次取尿道口、冠状沟、龟头分泌物,将 HPV 拭子缓慢插入尿道口顺时针旋转5周以上取出拭子后沿患者龟头、冠状沟处顺时针摩擦1周取材,然后将拭子放入洗脱管中,沿刷柄折痕处折断,拧紧管盖,立即送检。
1.3 观察指标 设定观察指标为完全吻合、部分吻合、无相关性3个等级,完全吻合标准:男女双方HPV 感染型别完全一致;部分吻合标准:男女双方 HPV 感染型别部分一致(即有≥1 个型别不一致);无相关性标准:男女双方 HPV 感染无同一型别。
1.4 统计学分析 使用Excel 汇总数据,采用描述性统计学方法。
2 结果
2.1 HPV感染情况 5 000例女性中HPV阳性802例,总感染率为16.04%;21种基因亚型除了45亚型均有检出,以16型最多,其次为52型、58型、33型。这些感染中,单一感染572例,占比71.32%;双重感染145例,占比18.08%;三重感染54例,占比6.73%;四重及以上感染 31例占比3.87%。见表1、2。
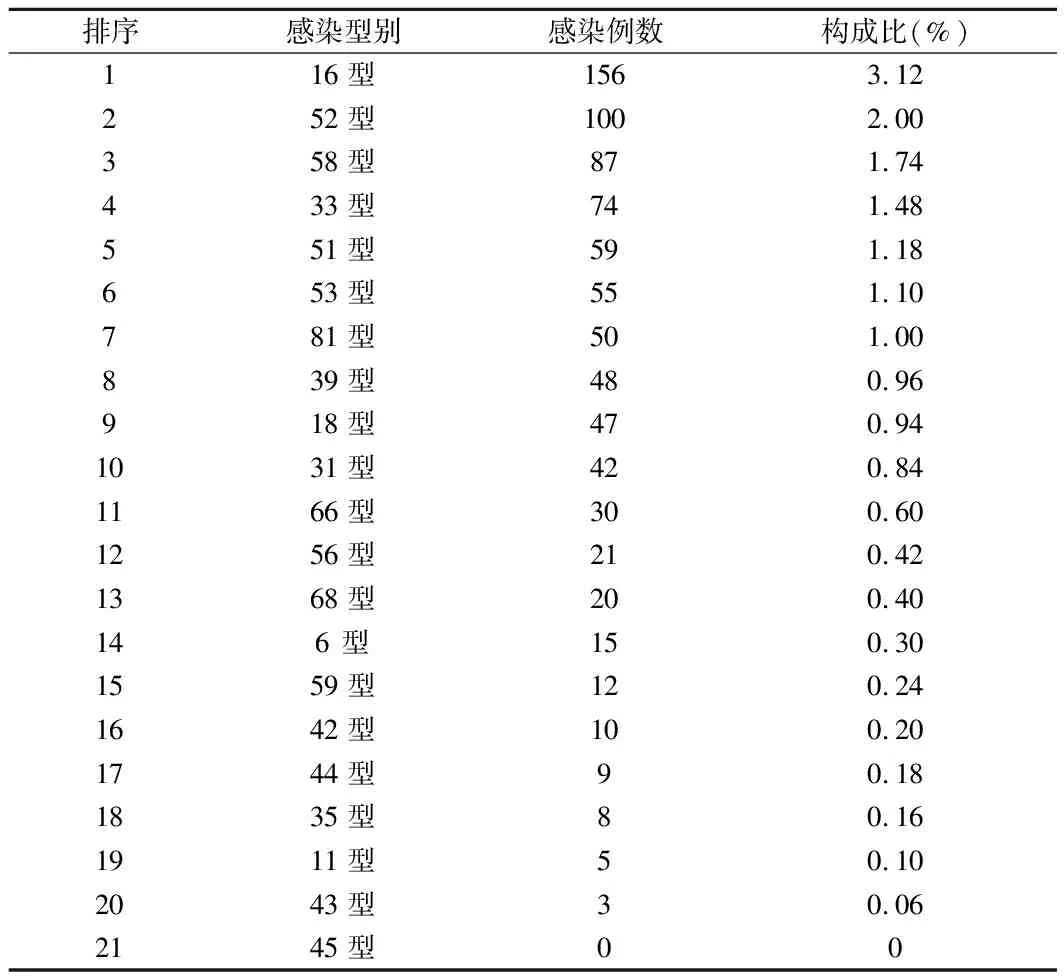
表1 HPV各基因型别感染率

表2 HPV多重感染情况
2.2 HPV感染现状及各年龄组 HPV感染率比较 本研究共纳入符合调查要求的女性5 000例,按每10岁分为1个年龄段组,65岁以上人数偏少,故将此年龄段合并为>65岁组,因15~24年龄段HPV感染率较高,所以将此年龄段分为2组:<21岁组、22~24岁组。结果显示:5 000例女性中,高危型HPV的检出率为16.04%(802/5 000)。见表3。

表3 不同年龄组 HPV 感染情况
2.3 感染者配偶HPV感染者年龄分组 643例配偶行HPV检测,阳性199例,阴性444例,HPV感染率为30.95%(199/643),<21岁组感染率最高,其次为55~64岁组,感染率为39.47%,与女性感染率的年龄段相符。见表4。

表4 感染者配偶不同年龄组 HPV 感染情况
2.4 双方HPV感染配对亚型吻合情况 199例男性 HPV阳性中共检测HPV型别20种,HPV45型别未检测到。单一亚型感染率49.75%(99/199),双重亚型感染率31.16%(62/199),多重亚型感染率19.10%(38/199)。其中67对HPV亚型完全吻合,完全吻合率33.67%(67/199),另有52例亚型部分吻合,吻合率26.13%(52/199),即双方感染型别中至少含1种相同亚型。双方吻合率59.80%(119/199)。见表5。
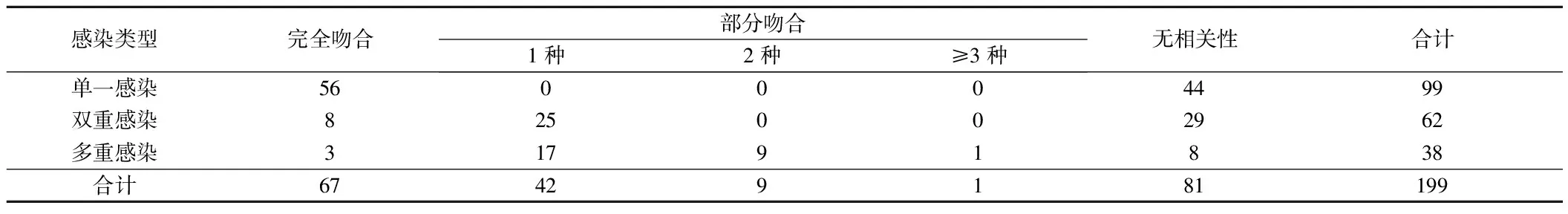
表5 199对男女双方HPV感染吻合情况 对
2.5 199对男女双方HPC吻合感染中具体亚型分布情况 进一步分析199对夫妻HPV感染吻合具体亚型情况,前3位均为高危亚型,从高到低:HPV 18、52、16,第4为低危亚型6感染率为64.70%,可见配偶感染吻合中以高危亚型为主。见表6。

表6 199对男女双方HPV吻合感染中具体亚型分布情况
3 讨论
3.1 不同地区感染率 据目前国内的统计资料,中国女性宫颈细胞的HPV感染率为13.5%~45.6%,不同地区感染率不同,感染的HPV亚型有差异[9]。本地区其他单位来源于门诊的报道的阳性率33.05%(8 719/26 385)[10]。本次研究显示:5 000例女性中HPV阳性802例,总感染率为16.04%,单一感染572例,占比71.32%;双重感染145例,占比18.08%,由于本研究数据来源于河北省适龄女性及其配偶,主要感染型别高危亚型以16型最多,其次为52型、58型、33型。低危亚型6为常见。没有筛查出高危45亚型。
3.2 同地区不同年龄组的感染率 本次研究,<21岁年龄组感染率最高为25.58%,其次为55~64岁年龄组感染率23.99%,35~44岁组、45~54岁分别为14.42%、14.27%。2组感染率与其他组比较差异均有统计学意义(P<0.05),2组间感染率比较差异有统计学意义(P<0.05)。<21岁年轻女性可能是由于初次性生活时间早,且宫颈上皮发育不成熟易受HPV感染。55~64岁组女性,感染率偏高,可能是由于HPV检查以往检查次数少,或许是绝经以前存在HPV的感染;或者是绝经以后激素水平降低,机体免疫力低下,易感染HPV病毒所致。35~54岁年龄组,可能是处于性活跃年龄段,HPV感染偏高。所以,加强对年轻人的HPV的健康教育,特别是对年轻未婚有性生活的女性的健康教育,了解健康知识,积极检查身体,才能降低女性HPV感染的阳性率,以及降低宫颈癌及癌前病变的发病率。
3.3 男性HPV筛查在防治宫颈癌及癌前病变的意义 目前,男性HPV感染的机制尚不十分清楚,但研究显示,性传播途径是HPV的主要传播途径之一[11]。643例感染者配偶行HPV检测,199例男性HPV感染阳性,HPV感染率为30.95%(199/643)。本研究采集尿道口、包皮冠状沟的细胞,宁海明等[12]报道男性外生殖器不同部位(尿道口与包皮冠状沟)对高危型、低危型HPV的易感性不同;Aguilar等[13]也报道男性外阴不同部位(阴囊、包皮、龟头、冠状沟、尿道)的HPV检出率不同,尿道黏膜的HPV检出率最低。
3.4 夫妻双方HPV感染配对吻合情况 配偶双方亚型吻合率为59.80%(119/199)。其中67对HPV亚型完全吻合,完全吻合率为33.67%(67/199)。HPV 吻合率与 HPV 型别具有一定相关性,配偶HPV吻合率最高的分别是高危18、52、16亚型和低危6亚型。表明男性在女性HPV感染过程中起着载体的作用,这与女性HPV持续阳性,或者是复发阳性密切相关,所以当女性HPV检查为阳性时,一定要对配偶行HPV检测,并采取相应的治疗措施。这对于预防病毒传播,夫妻共同防治HPV感染有着重要意义。
本研究结果表明,河北省适龄女性宫颈HPV感染率较高,应做为常规查体的检查项目,由于HPV检查费用偏高,对于偏远山区不发达地区政府应给与部分支持,保证HPV检测的覆盖率,这样才能降低宫颈癌及癌前病变的发病率,对于HPV检测阳性的配偶常规行HPV检测,加强宫颈癌防治的健康教育,特别是HPV 感染女性及配偶的健康教育,初次性生活过早、性伴侣多、与高危人群性接触等感染 HPV 的风险大[14],雷雨等[15-17]的调查示,性伴侣包皮过长或包茎是女性HPV 感染的独立危险因素。HPV分型检测对宫颈癌及癌前病变的筛查具有重要意义,本研究为河北地区宫颈癌的筛查防治提供了重要的临床依据。

