第一原理的原子热力学方法及反应相图分析
楚兴丽,张岩星,杜爱慧
(河南师范大学 物理学院 国家级实验教学示范中心,河南 新乡 453007)
教育部《关于一流本科课程建设的实施意见》指出[1],把立德树人作为检验高校一切工作的根本标准,深入挖掘各类课程和教学方式中蕴含的思想政治教育元素,建设适应新时代要求的一流本科课程.因此教学内容应突出创新性,体现前沿性与时代性,及时将学术研究、科技发展前沿成果引入课程.物理学本科专业的培养目标不仅是培养掌握物理学基本理论、基本知识及实验技能,更是培养具备一定科研能力、能胜任中学物理教学以及相关科学技术领域中科研、教学、技术和管理工作的高级专门人才.所以要求教师在授课的过程中时刻穿插介绍一些活生生的、与原理密切相关的最新科学前沿成果,激发学生的求知欲.
“热力学与统计物理”[2]是物理学专业学生的核心课程,与理论力学、量子力学和电动力学统称四大力学.其中热力学是研究热运动的宏观理论,它以几个基本的实验定律为基础,主要研究物质系统在各种条件下物理、化学变化中所伴随着的能量变化,从而对化学反应进行的方向和限度作出准确的判断[3].在材料科学的理论研究中具有重要的作用,在实践中具有指导和预测作用.
众所周知,VASP(Vienna Ab-initio Simulation Package,即维也纳从头计算模拟包的缩写)[4]被广泛应用于材料模拟研究领域,可以对材料表面的吸附和反应进行相应的理论模拟和计算研究.但是基于密度泛函理论(Density Functional Theory,DFT)[5]的VASP计算程序包所计算的是多电子体系的基态,结果仅适用于分析反应在零温、零压下的性质,然而实际的反应过程都是在一定的温度和压强下发生的.那么,温度和压强对反应过程会有什么样的影响?在不同的温度和压强下表面的结构和组分又是什么?这是DFT所无法解答的问题.为了解决这个问题,本文引入热力学相平衡理论[2],分析当系统达到平衡时,材料表面有什么吸附物种;随着温度或压强的变化系统如何变化等,为实验提供一定的指导.同时在教学过程中可以结合这些研究成果,将相关的国际前沿物理介绐给同学,从而开阔学生的视野,引起学生的学习兴趣.
本文首先根据热力学理论简述相平衡原理及其应用,然后重点介绍第一原理的原子热力学方法,并通过引入具体案例丰富教学内容,深化学生对物理知识内涵的理解,并可使他们初步掌握科学研究的方法.
1 相平衡原理
在热力学中,系统发生的一切热力学过程应遵守热力学基本定律.热力学第二定律指出:一切与热现象有关的实际过程都有其自发进行的方向,是不可逆的.孤立系统内发生的不可逆过程总是朝着熵增加的方向进行,当孤立系统达到平衡态时,熵就达到了最大值.在实际的问题中,根据经常遇到的物理条件,可以引入其他的热力学函数来判断一个系统是否达到了平衡态.由热力学基本不等式dU≤TdS-pdV和定义式G=U-TS+pV可得,约束在等温、等压条件下的系统发生的不可逆过程总是朝着吉布斯函数减少(即 ΔG<0)的方向进行.当等温、等压系统达到平衡态时,吉布斯函数就达到了最小值.此时系统不再发生物理和化学变化,即达到了相平衡[2].
相平衡原理主要是应用热力学原理研究多相系统中有关反应的变化方向与限度的规律,即研究温度、压强及反应物质等因素对系统状态的影响.相平衡的研究无论在科学研究领域还是在工业生产方面都有着重要意义,例如在冶金工业上根据冶炼过程中的相变情况,可以监测金属的冶炼过程以及研究金属的成分、结构与性能之间的关系.
固体氧化物燃料电池(Solid Oxide Fuel Cells,简称SOFCs)因其具有燃料适应性广、能量转换效率高等优点,被称为21世纪的绿色能源之一[6].然而阳极材料表面因出现硫中毒现象而失去活性,将极大地限制固体氧化物燃料电池的广泛应用[7,8].Wang等人[9]利用以相平衡理论为基础的第一原理热力学方法研究了SOFCs“硫中毒”现象,考虑到温度和分压对反应的影响,发现H2S和Ni表面相互作用产生Ni2S3物种(如图1所示),这在实验上利用光学显微镜观察原位拉曼光谱图像是可以发现的[10].

图1 利用第一原理热力学方法计算得出的S-Ni相图.其中三个区域分别对应干净的 Ni相、Ni表面吸附 S*相以及 Ni3S2体块相.黑色的线是Rosenqvist等人[11]的 bulk相图实验数据,空心正方形线是S*在不同表面覆盖度时的实验数据[12],方块是抗硫中毒实验数据[13].纵轴表示温度,下横轴表示H2和H2S气相压强比值的对数,上横轴表示H2S的含量(ppm表示百万分之几).
2 第一原理的热力学计算方法
基于DFT的第一性原理方法,计算结果仅适用于零温、零压下的性质,因此并不能分析在实际环境下的反应过程.第一原理的热力学方法依据DFT的计算结果,结合实验测得的热力学量,算出体系在一定温度和压力下的吉布斯函数,根据吉布斯函数随着温度和压强的变化来判断反应进行的方向,以此来分析生成物种.下面是有关的计算和分析公式.
对于气-固界面反应,如图 2所示[14],有
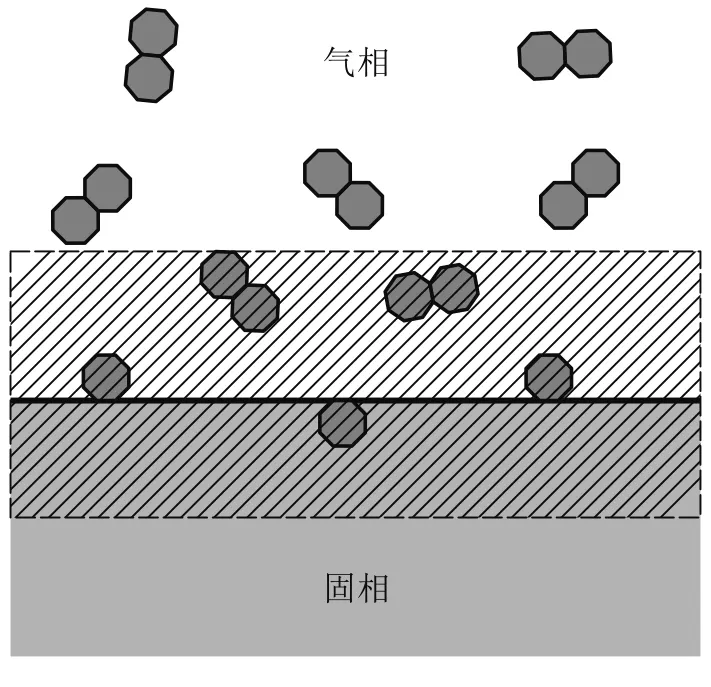
图2 在一定的温度和压强下,气体分子和固体相互作用示意图
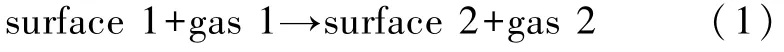
其中surface 1和surface 2分别表示固相的反应物和生成物,gas 1和gas 2表示气相的反应物和生成物.
吉布斯函数的增加(以下称为吉布斯自由能)可以表示为[2]
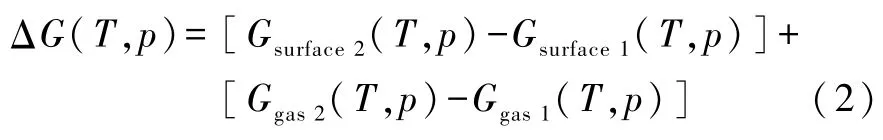
对于固相(即衬底)的吉布斯自由能可表示为[2,14]

其中EDFT表示零温下的真空吉布斯自由能或亥姆霍兹自由能,因为零温下有 EDFT=G(0,0)= F(0)[2].Fvib表示来自于吸附物分子与表面相互作用引起的表面振动对吉布斯自由能的贡献,即表面影响的谐波近似下的n基模振动自由能,表示为[15]
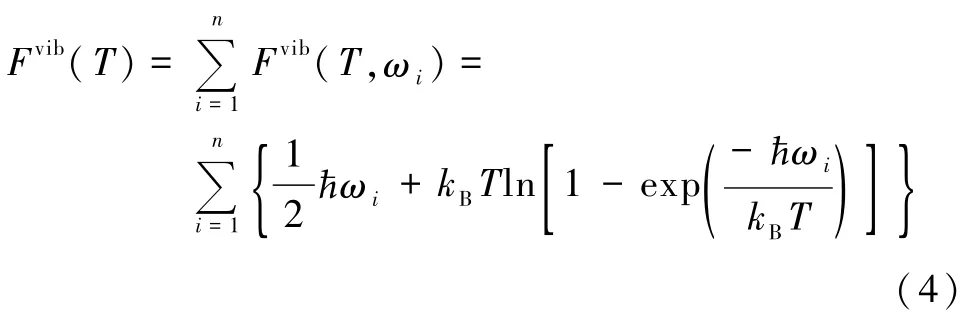
Fvib(T)中每一项的获得都来自于对各种表面物种振动的详细分析,即将衬底固定对全部动力学矩阵对角化.ωi表示爱因斯坦固体理论近似下的简谐振动模频率.按照公式(3)和(4),就可以计算出相应的由于衬底对气体分子的吸附作用所引起的振动能随温度的变化趋势.
与固相相比,温度和压强将极大地影响气相的吉布斯自由能.根据热力学理论可以表示为[2]
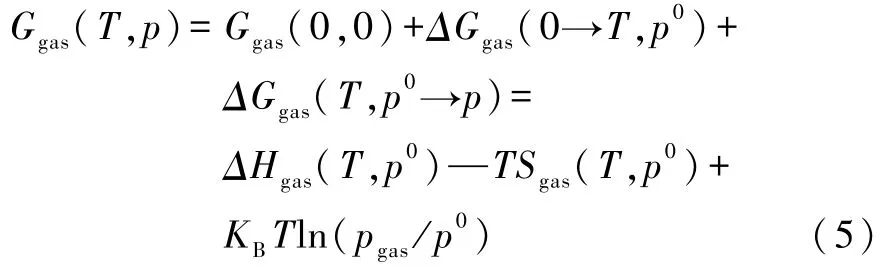
将式(3)、(4)、(5)代入式(2)可得
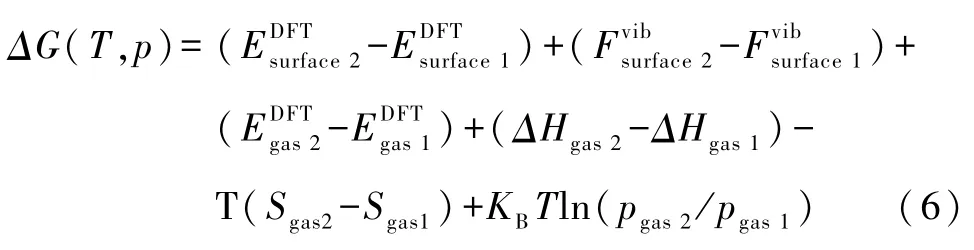
根据吉布斯函数判据,在一定温度和压强下所有的反应都是朝着吉布斯函数减小的方向进行[ΔG(T,p)<0].当系统达到平衡态时,吉布斯函数就达到了最小值.令公式中的ΔG=0,求出反应结束时温度随着压强的变化关系,并在p-T相图中画出相平衡曲线,即相图边界,相应的就可以区分出在某个温度和压强下的生成物种,为实验提供一定的指导.
3 应用举例
3.1 SOFCs 阳极材料硫中毒现象研究[17]
SOFCs通过阳极提供燃料气体,阳极又称为燃料极.目前应用最广泛的SOFCs阳极材料是Ni-YSZ(yttria stabilzed ziroonia,8 mol% 的钇掺杂的氧化锆)金属陶瓷[18,19].众所周知,在 SOFCs 阳极通入的碳氢燃料或重整气中含有各种各样的含硫污染物,特别是H2S,能够在阳极材料表面与之发生反应,以致造成硫中毒.研究表明,当燃料中H2S的浓度仅为0.1 ppm时,就可以使SOFCs阳极发生硫中毒,这将导致电池性能随时间增长而大幅衰减[8].这是SOFCs亟待解决的问题之一.本文利用第一性原理,结合第一原理热力学方法,对富氧的YSZ(YSZ+O)表面硫中毒现象进行系统的研究[17],进而阐明 YSZ体系的微观结构特点和硫中毒的微观机理,为SOFCs阳极材料改良提供一定的理论依据.
反应方程表述如下:
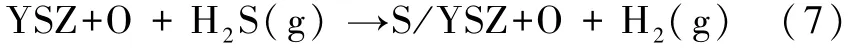
令方程(6)中的 ΔG(T,p)= 0可以画出反应式(7)的相图曲线,如图3所示.相图的黄色区域表示硫吸附的表面,白色区域对应干净的 YSZ+O(111)表面.正如前面所述,反应将会受到 H2S和 H2分压的影响.例如,如图3中的线Ⅰ所示,在1 000 K时,很少的 H2S,大约 0.01 ppm,即 log(pH2/pH2S)≈7.8,则在干净的YSZ+O表面上就会发生反应生成 H2,通过相图边界从无污染的白色区域进入到硫吸附的黄色区域.在一定pH2/pH2S比例(如线Ⅱ所示)条件下,硫原子的表面覆盖度将随着温度的增加而增加.
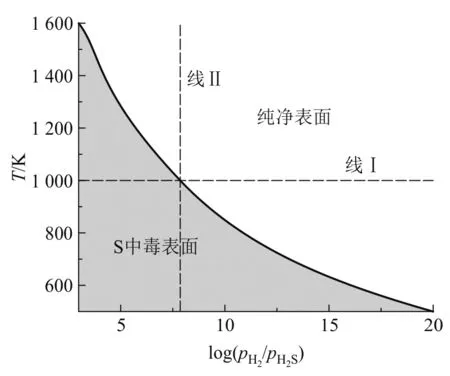
图3 H2S在YSZ+O(111)表明吸附发生反应的热力学相图.其中白色区域表示干净的 YSZ+O(111)表面,黄色区域为 S吸附的 YSZ+O(111)表面.
3.2 硫中毒 YSZ+O(111)表面的再生[17]
硫原子吸附在YSZ+O(111)表面上阻碍了燃料氧化的活性,使其产生了硫中毒.因此,为了使表面再生,必须通过加入氧化剂,例如O2和H2O,去氧化吸附物,然后除去吸附在表面的硫原子,反应过程被描述为
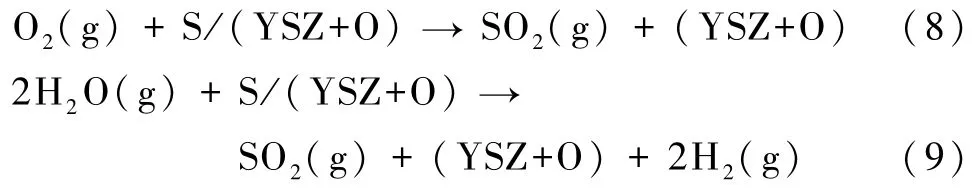
相应的吉布斯自由能如下:
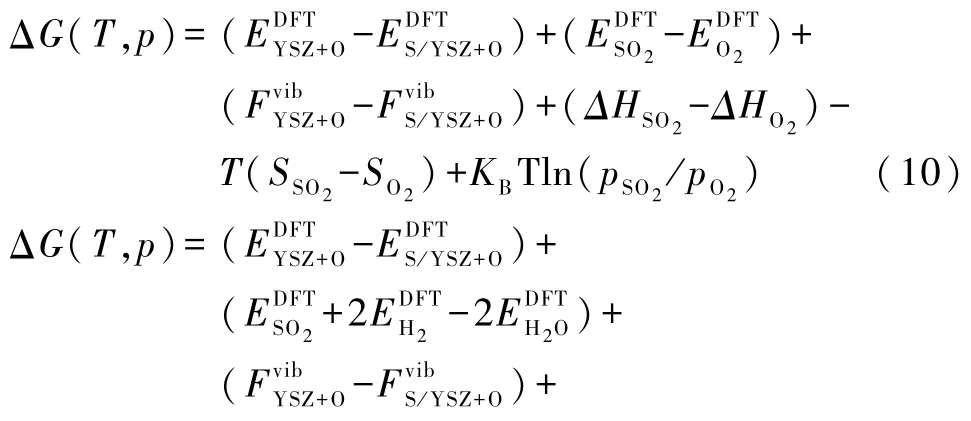
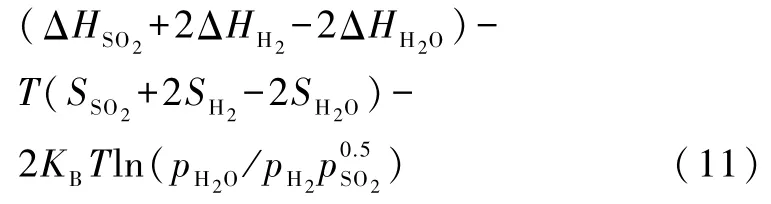
令方程(10)和(11)中的 ΔG(T,p)= 0 画出相图边界,从而可绘出以温度和 pSO2、pO2、pH2和 pH2O的分压为变化量的相图(图4),该热力学相图表示了可能的除硫条件.黄色区域表示吸附硫原子的中毒相,白色区域对应由O2或 H2O再生的干净表面.由图看出:在一个给定的温度下,O2或H2O的分压越高消除硫中毒就越有效,这相似于硫中毒的Ni表面的再生或去硫过程[20].
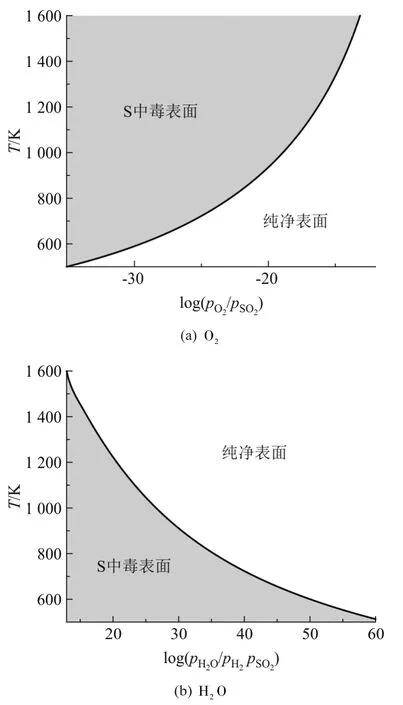
图4 按照反应式(8)和式(9)去除吸附 S原子的热力学相图.其中黄色区域和白色区域分别表示 S吸附的中毒和干净的 YSZ+O(111)表面.
4 结论
本文首先利用热力学相平衡原理推导出第一原理热力学方法,然后通过实例分析由 H2S造成的YSZ+O(111)表面的硫化过程和探测硫中毒的YSZ+O(111)面的再生机制.
在平时的授课过程中,为了丰富教学内容,在讲解完“基本热力学函数的确定”一节后,鼓励学生推导气-固界面反应的吉布斯函数,并将这些相图分析应用于“复相系的平衡性质”一节的学习中.这不仅提高了学生学习理论基础课的兴趣,更提高了他们理论联系实际的科学实践能力.让学生知道繁琐的计算和抽象的公式可以交由计算机软件处理,“公式与计算”并不是热力学与统计物理的本质,学习目的是为了理解其包含的物理思想.同时引导学生深化知识内容,掌握科学研究的方法,形成正确的科学观.

