L-茶氨酸改善来曲唑诱导的多囊卵巢综合征大鼠临床症状
黄秋萍,谢晨阳,李新宇,金斌,曾榛,2,钱波,3,戴玲,宋家乐,4,5,7*
-茶氨酸改善来曲唑诱导的多囊卵巢综合征大鼠临床症状
黄秋萍1,谢晨阳1,李新宇1,金斌1,曾榛1,2,钱波1,3,戴玲6*,宋家乐1,4,5,7*
1. 桂林医学院公共卫生学院,广西 桂林 541199;2. 中南大学湘雅公共卫生学院,湖南 长沙 410000;3. 厦门大学公共卫生学院,福建 厦门 361102;4. 广西卫生健康委员会全生命周期健康保健研究实验室,广西 桂林 541199;5. 广西环境暴露组学与全生命周期健康重点实验室,广西 桂林 541199;6. 桂林医学院大学生心理健康与咨询中心,广西 桂林 541199;7. 桂林医学院第二附属医院临床营养科,广西 桂林 541109
为探究-茶氨酸(-theanine,LTA)对来曲唑诱导的多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)大鼠临床症状的改善效果。将28只雌性SD大鼠按每组7只随机分为正常对照组、PCOS模型组、PCOS+低剂量LTA组和PCOS+高剂量LTA组。建模阶段,除正常对照组以生理盐水灌胃外,其余3组持续灌胃来曲唑28 d诱导PCOS模型。干预阶段,正常对照组和PCOS模型组以生理盐水持续灌胃,两个LTA干预组大鼠分别持续灌胃对应剂量LTA干预30 d。结果显示,与PCOS模型组相比,LTA干预组大鼠血清中睾酮(Testosterone,T)、黄体生成素(Luteinizing hormone,LH)、胰岛素(Insulin,INS)、甘油三酯(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、低密度脂蛋白(Low-density lipoprotein cholesterol,LDL-C)、脂多糖(Lipopolysaccharide,LPS)水平及胰岛素抵抗指数(HOMA-IR)均显著降低(<0.05),高密度脂蛋白(High-density lipoprotein cholesterol,HDL-C)水平均显著升高(<0.05),黄体生成素与卵泡刺激素的比值(LH/FSH)、空腹血糖(Fasting plasma glucose,FPG)和体重均有所下降(>0.05);低剂量LTA干预组大鼠血清雌二醇(Estradiol,E2)显著升高(<0.05);高剂量LTA干预组大鼠卵泡刺激素(Follicle stimulating hormone,FSH)显著升高(<0.05);LTA干预组大鼠的发情周期紊乱、卵巢组织多囊样病变较PCOS模型组均有一定程度的改善。结果表明,LTA干预能有效调节PCOS大鼠性激素分泌、恢复发情周期规律变化和改善其卵巢多囊样病变,同时显著改善PCOS大鼠胰岛素抵抗(Insulin resistance,IR)、血脂代谢紊乱并抑制异常水平的脂多糖(Lipopolysaccharide,LPS)分泌。
-茶氨酸;多囊卵巢综合征;高雄激素血症;胰岛素抵抗
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)是一种育龄期女性常见的内分泌紊乱疾病,发生率为5%~10%[1]。PCOS以高雄激素血症(Hyperandrogenemia,HA)、胰岛素抵抗(Insulin resistance,IR)、不孕不育、肥胖、多毛和多囊性卵巢等为主要临床表现[2]。此外,PCOS患者普遍存在血脂代谢异常、氧化应激及糖代谢异常所引起的代谢综合征[2-3]。目前,使用化学合成药物仍然是PCOS较为主流的治疗方案之一,但这些主要的治疗药物如抗高雄激素血症药物、促排卵药物和胰岛素增敏剂在服用过程中易出现潮热、头晕、视力模糊、自限性的胃肠道不适和受精卵不易着床等不良反应[4-5]。因此,寻找安全、有效且副作用小的天然植物基产品来代替化学合成药物很可能是未来治疗和管理PCOS的重要发展方向。-茶氨酸(-theanine,LTA)作为绿茶中一种非蛋白质氨基酸成分,具有抗氧化、抗应激、抗炎、抗肿瘤、降血压、降脂、降低毒性和提高免疫力的作用[6-7]。LTA通过增加大鼠脑内单胺类递质分泌浓度和减少下丘脑-垂体-肾上腺轴上促肾上腺皮质激素和皮质醇的分泌而起到抗抑郁的作用[8]。有研究表明LTA可改善肠道形态结构促进肠道对氨基酸的吸收[9],增加肠道有益菌属的比例,促进短链脂肪酸(Short chain fatty acid,SCFA)的产生[10]。LTA对产肠毒性大肠杆菌引起的免疫应激小鼠的肝脏和肠道具有保护作用[11-12]。此外,Lin等[13]研究表明,LTA可通过胰岛素和磷酸腺苷(Adenosine monophosphate,AMP)激活的蛋白激酶信号通路,调节葡萄糖、脂质和蛋白质代谢。然而目前国内外尚未有关于LTA对PCOS大鼠干预效果的研究报道,本研究旨在探讨LTA对来曲唑诱导的PCOS大鼠发情周期、体重、腹腔脂肪、血脂、血清性激素、血清脂多糖(Lipopolysaccharide,LPS)、血清胰岛素(Insulin,INS)及胰岛素抵抗指数(HOMA-IR)和卵巢组织学的影响。
1 材料与方法
1.1 材料与试剂
来曲唑(L833525,纯度大于98%),购于上海麦克林生化科技有限公司;羧甲基纤维素钠(Carboxymethylcellulose sodium,CMC,纯度大于99%),购于西陇科学股份有限公司;-茶氨酸(T106216,纯度大于98%),购于上海阿拉丁生化科技股份有限公司。总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、低密度脂蛋白(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白(High-density lipoprotein cholesterol,HDL-C)、脂多糖测定试剂盒均购于南京建成生物工程研究所;胰岛素、雌二醇(Estradiol,E2)、睾酮(Testosterone,T)、黄体生成素(Luteinizing hormone,LH)、卵泡刺激素(Follicle stimulating hormone,FSH)ELISA试剂盒均购于江苏酶免实业有限公司。普通啮齿类维持饲料(AIN-93M),购自常州鼠一鼠二生物科技有限公司。
1.2 主要仪器设备
FA2004电子分析天平,上海舜宇恒平科学仪器有限公司;Eppendorf 5424R型冷冻离心机,德国Eppendorf公司;Varioskan LUX多功能酶标仪,美国Thermo Scientific科技公司;Leica DM4B正置显微镜,德国Leica光学仪器有限公司。
1.3 实验动物
28只6周龄、体重(173.82±9.33) g的健康雌性SD大鼠,购于湖南斯莱克景达实验动物有限公司[生产许可证号:SCXK(湘)2016-0002],饲养于桂林医学院公共卫生学院SPF级动物房[实验单位许可证号:SYXK(桂)2020-0005]。所有大鼠均在标准环境内[室温:(22±1)℃,相对湿度:60%,每日明暗周期:12 h/12 h]合笼饲养(每笼2~3只)。试验期间所有大鼠均饲喂AIN-93M标准饲料,自由摄食及清洁饮水。本试验研究方案经桂林医学院实验动物伦理委员会批准审核(许可号:GLMC201806003)。
1.4 试验方法
1.4.1 PCOS大鼠模型建立及LTA干预分组
所有大鼠适应性饲养1周后,依随机法将其分成正常对照组、PCOS模型组、PCOS+低剂量LTA(PCOS+LTA-L)组和PCOS+高剂量LTA(PCOS+LTA-H)组,每组7只。正常对照组在整个试验过程中每日灌胃生理盐水(1 mL·100 g-1·d-1)。
PCOS模型建立:参照Kafali等[14]的方法,除正常对照组持续灌胃生理盐水外,其余组均28 d持续灌胃来曲唑(1 mg·kg-1·d-1)建立PCOS模型。随后进行30 d的干预试验。
干预方案如表1所示,正常对照组和PCOS模型组大鼠持续灌胃生理盐水;低、高剂量LTA干预组大鼠在停止灌胃来曲唑的同时,分别持续灌胃50 mg·kg-1·d-1和200 mg·kg-1·d-1的LTA。LTA干预剂量的选择参考宋玉欣等[15]和曾立等[16]的方法。在58 d的实验期间内,每3 d称量大鼠体重,并维持大鼠自由摄食和清洁饮水。
1.4.2 大鼠发情周期检测
雌性SD大鼠正常发情周期为4~5 d,从LTA干预第10天开始,采集大鼠阴道脱落细胞涂片并进行巴氏染色法连续观察10 d阴道涂片以判断大鼠发情周期规律变化,即:发情前期以扁平上皮细胞为主;发情期以角质化细胞为主;发情期后期白细胞、角质化细胞、扁平上皮细胞3种细胞比例相当;发情间期以白细胞为主[17]。
1.4.3 实验动物处理及取材方法
末次LTA干预后,大鼠禁食12 h但自由饮水。CO2麻醉处死大鼠后,取腹主动脉血约5 mL,静置0.5 h后,冷冻离心机4℃,1 200 r·min-1离心15 min,分离的血清用于各项指标检测。置冰上快速分离大鼠脏器和肾周、子宫及腹部等处脂肪组织,使用电子分析天平称重并记录质量(肾周、子宫周及腹部脂肪质量之和为腹腔脂肪质量)。取一边卵巢放入4%(体积分数)多聚甲醛固定备用,其余取出的各个材料无菌包装后均及时放置–80℃冰箱备用。
1.4.4 大鼠卵巢组织学形态观察
取固定好的卵巢组织,由桂林医学院附属医院病理科进行石蜡包埋并行H&E染色,中性树脂封片后于显微镜下观察各组大鼠卵巢组织学形态。
1.4.5 血脂相关指标及血清LPS水平检测
按照试剂盒说明书操作要求检测大鼠血清中TG、TC、LDL-C、HDL-C、FPG及LPS水平。
1.4.6 激素相关指标检测
按照试剂盒说明书操作要求检测大鼠血清中E2、T、LH、FSH及INS水平,计算HOMA-IR公式如下:
HOMA-IR=(胰岛素×空腹血糖)÷22.5
式中,胰岛素和空腹单位分别为mU·L-1和mmol·L-1。
1.5 数据的统计学分析
2 结果与分析
2.1 LTA干预对PCOS大鼠发情周期的影响
正常对照组大鼠以发情前期、发情期、发情后期、发情间期依次循环出现规律性的发情周期,而PCOS模型组发情周期呈不规律变化。PCOS+LTA-L组和PCOS+LTA-H组在干预过程中发情周期变化得到明显改善(图1)。其中,PCOS+LTA-L组于第三天发情周期逐渐恢复正常,PCOS+LTA-H组于第四天发情周期逐渐恢复正常。结果表明,LTA干预能使PCOS大鼠发情周期规律变化,低剂量和高剂量的LTA对PCOS引起的发情周期不规律均有明显改善作用,且低剂量的LTA改善效果更好。
2.2 LTA干预对PCOS大鼠卵巢的影响
卵巢中出现多个扩张性囊状卵泡是PCOS的典型特征。如图2所示,肉眼观察发现,PCOS模型组大鼠卵巢的表面比正常对照组粗糙苍白,且卵巢体积较大。而不同LTA干预处理后的PCOS大鼠的卵巢表面比PCOS模型组红润有光泽,且体积也较小。而各组大鼠卵巢标本经H&E染色后镜下观察发现,正常对照组大鼠卵巢中有多个黄体整齐排列,形态完整,颗粒细胞层较厚。而PCOS模型组大鼠卵巢中黄体体积较小且数目少,颗粒细胞层变薄,多见囊状扩张卵泡和闭锁卵泡。与PCOS模型组相比,PCOS+LTA-L组和PCOS+LTA-H组大鼠卵巢黄体数目增多,少见囊性扩张卵泡,颗粒细胞层较厚。以上结果表明,两种剂量LTA均能有效改善PCOS大鼠的卵巢病变。
2.3 LTA干预对PCOS大鼠体重和腹腔脂肪相对质量的影响
如表2所示,在体重方面,开始造模前各组大鼠的体重之间相比均无显著性差异(>0.05)。而连续灌胃来曲唑建模后,PCOS模型组、PCOS+LTA-L组和PCOS+LTA-H组的体重均比正常对照组显著升高(<0.05),且PCOS模型组、PCOS+LTA-L组和PCOS+LTA-H组之间无显著性差异(>0.05)。经LTA干预后,与PCOS模型组相比,PCOS+LTA-L组和PCOS+LTA-H组的体重均有所减轻,但无显著性差异(>0.05)。在腹腔脂肪方面,与正常对照组相比,PCOS模型组大鼠的腹腔脂肪相对质量显著上升了42.41%(<0.05)。与PCOS模型组相比,PCOS+LTA-L组和PCOS+LTA-H组的腹腔脂肪相对质量分别下降了29.75%和26.63%(<0.05),但PCOS+LTA-L组和PCOS+LTA-H组之间并无显著性差异(>0.05)。以上结果表明,两种剂量的LTA干预对PCOS大鼠体重均有一定程度的减轻作用,且显著降低了PCOS大鼠的腹腔脂肪相对质量。
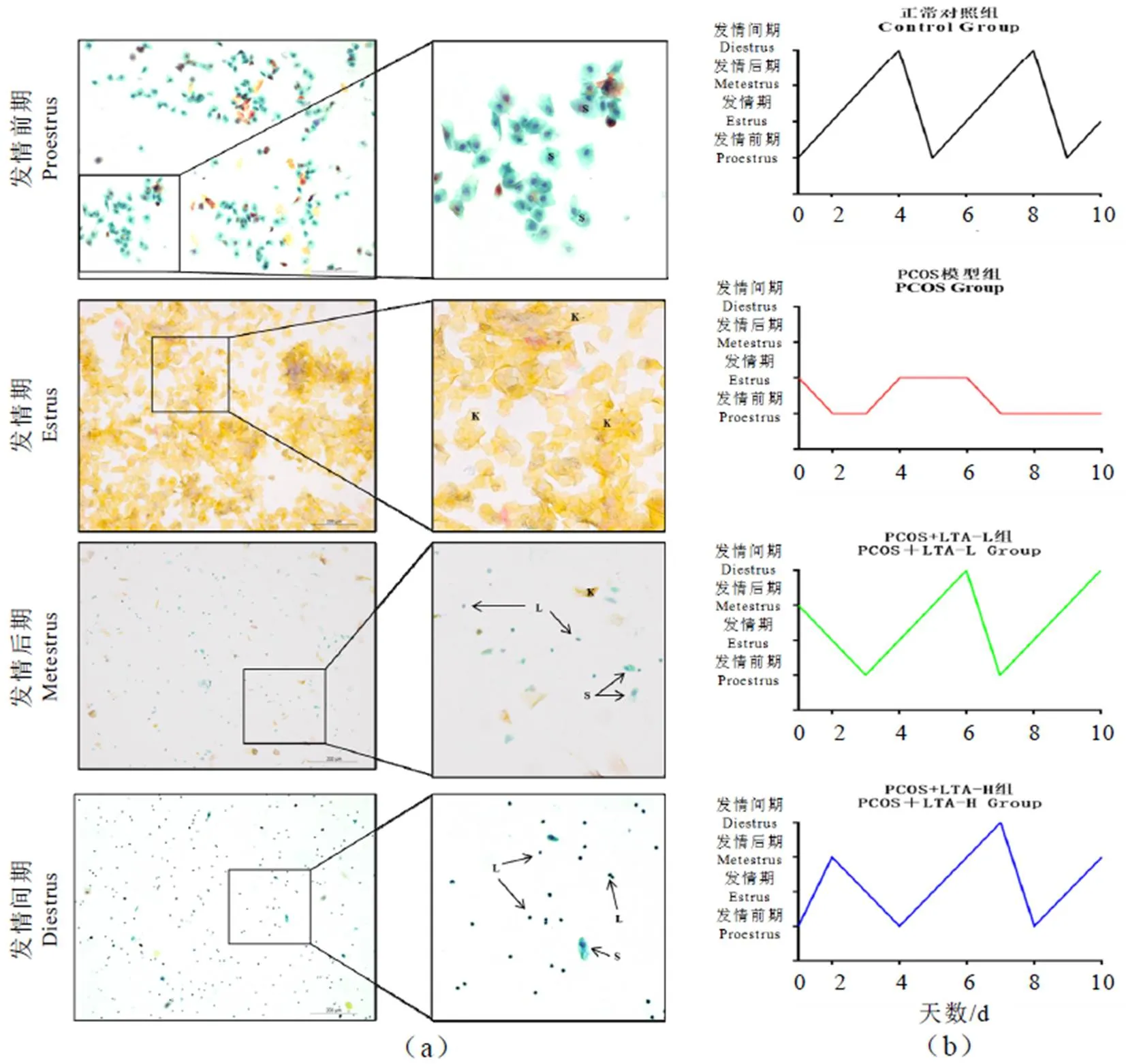
注:S:扁平上皮细胞;K:角质化细胞;L:白细胞
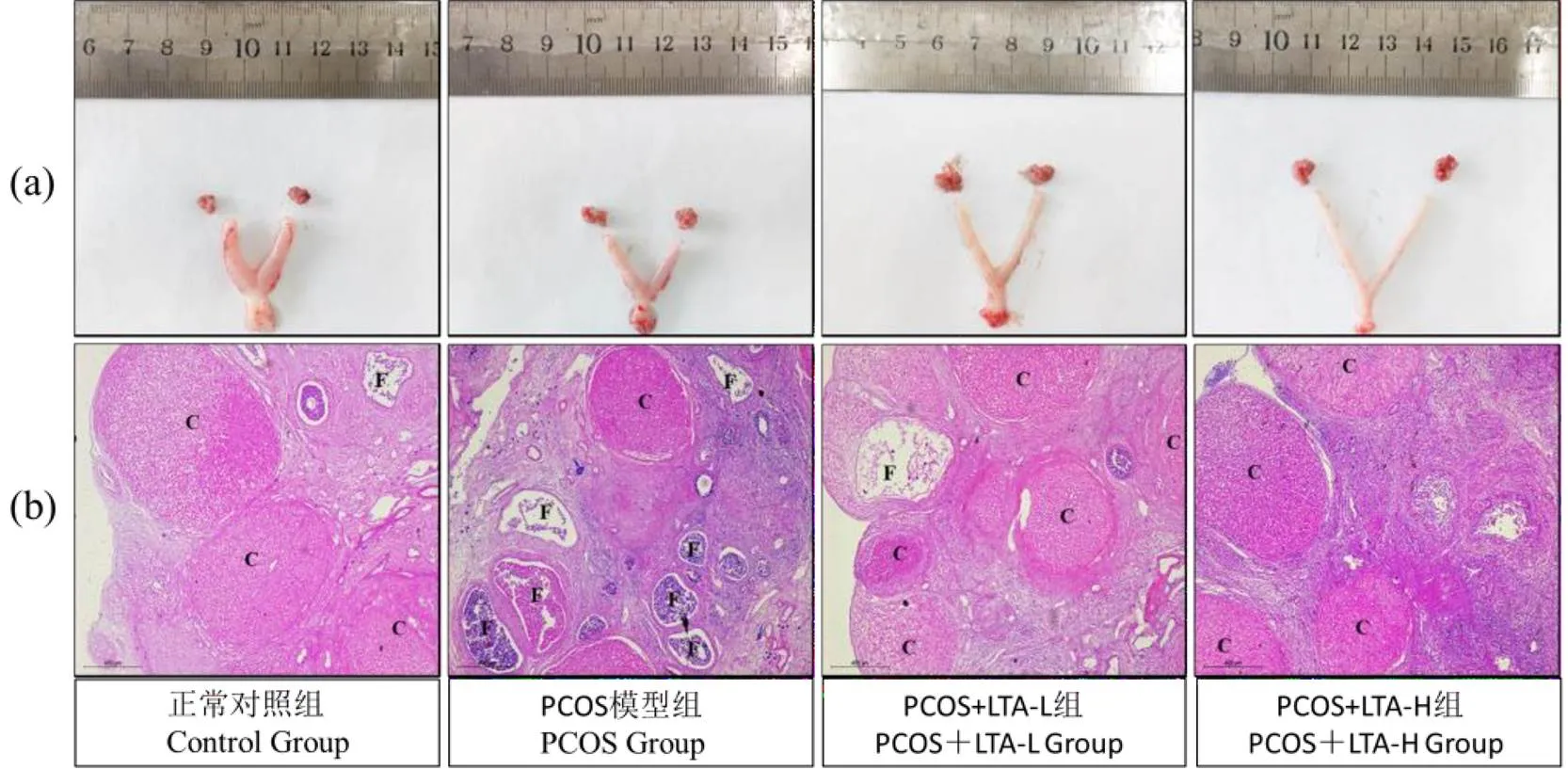
注:C:黄体;F:卵泡
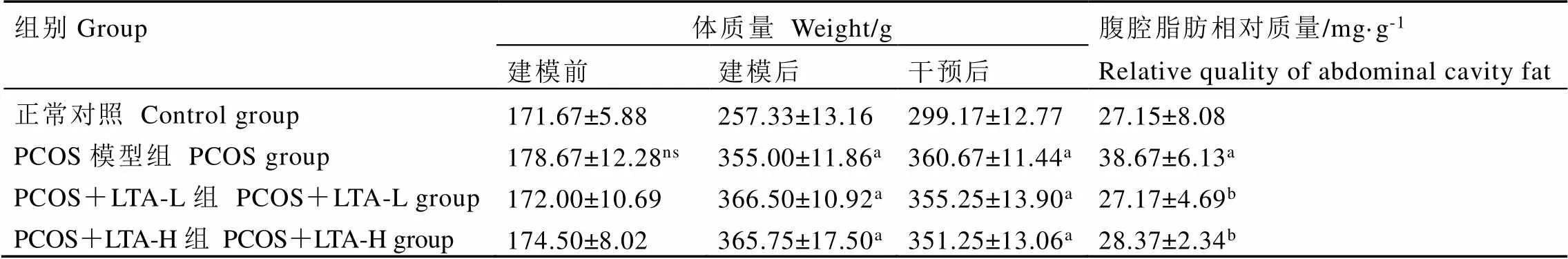
表2 LTA对PCOS大鼠体重和腹腔脂肪相对质量的影响
注:a:与正常组比较,<0.05;b:与PCOS组比较,<0.05;ns:表示无统计学差异
Note: a: compared with the normal group,<0.05. b: compared with the PCOS group,<0.05. ns: indicates no statistical difference
2.4 LTA干预对PCOS大鼠血糖、血清胰岛素水平及胰岛素抵抗的影响
如图3所示,与正常对照组相比,PCOS模型组FPG仅上升了4.66%(>0.05),而血清INS水平和HOMA-IR分别显著上升了22.34%和20.58%(<0.05)。而与PCOS模型组相比,PCOS+LTA-L组和PCOS+LTA-H组FPG分别下降了4.97%和2.03%(>0.05),血清INS水平下降了26.89%和22.49%(<0.05),HOMA-IR下降了23.37%和19.45%(<0.05),但PCOS+LTA-L组和PCOS+LTA-H组之间的FPG、血清INS和HOMA-IR均无显著性差异(>0.05)。结果提示两种剂量的LTA均能显著降低了PCOS大鼠的血清INS水平,改善大鼠IR程度。
2.5 LTA干预对PCOS大鼠血清性激素水平的影响
如图4所示,较正常对照组大鼠而言,PCOS模型组大鼠血清T和LH水平以及LH/FSH分别升高了19.37%、20.44%和41.35%(<0.05),E2和FSH水平分别显著降低了28.56%和29.24%(<0.05)。而与PCOS模型组相比,PCOS+LTA-L组和PCOS+LTA-H组大鼠血清T水平均分别下降了16.08%和21.14%(<0.05),血清LH水平降低了21.88%和25.74%(<0.05),血清LH/FSH虽分别下降了9.24%和9.65%但两者间无统计学意义(>0.05)。在E2水平方面,PCOS+LTA-L组升高了24.38%(<0.05),而PCOS+LTA-H组升高了9.80%(>0.05)。在FSH水平方面,PCOS+LTA-L组升高了10.32%(>0.05),而PCOS+LTA-H组升高了19.78%(<0.05)。以上结果表明,两种剂量的LTA能够显著调节PCOS大鼠体内性激素的分泌水平,且高剂量的改善效果要优于低剂量LTA。
2.6 LTA干预对PCOS大鼠血脂及LPS水平的影响
如图5所示,在血脂方面,与正常对照组相比,PCOS组大鼠血清TG、TC和LDL-C水平显著升高了25.98%、68.46%和72.14%(<0.05),而血清HDL-C水平则降低了33.58%(<0.05)。与PCOS模型组大鼠相比,PCOS+LTA-L组和PCOS+LTA-H组大鼠血清TG水平分别降低了20.88%和21.38%(<0.05),血清TC水平分别降低了30.95%和40.39%(<0.05),血清LDL-C水平分别降低了34.01%和31.44%(<0.05),血清HDL-C水平分别升高了37.30%和50.46%(<0.05)。PCOS+LTA-L组和PCOS+LTA-H组之间对PCOS大鼠血清中TG、TC、LDL-C、HDL-C和LPS的作用差异均无统计学意义(>0.05)。在LPS方面,与正常对照组相比,PCOS组大鼠血清LPS水平升高了66.90%(<0.05)。而与PCOS模型组大鼠相比,PCOS+LTA-L组和PCOS+LTA-H组大鼠血清LPS水平降低了58.42%和70.16%(<0.05)。上述结果显示,两种剂量的LTA均能显著改善PCOS大鼠的血脂紊乱及升高的LPS水平。
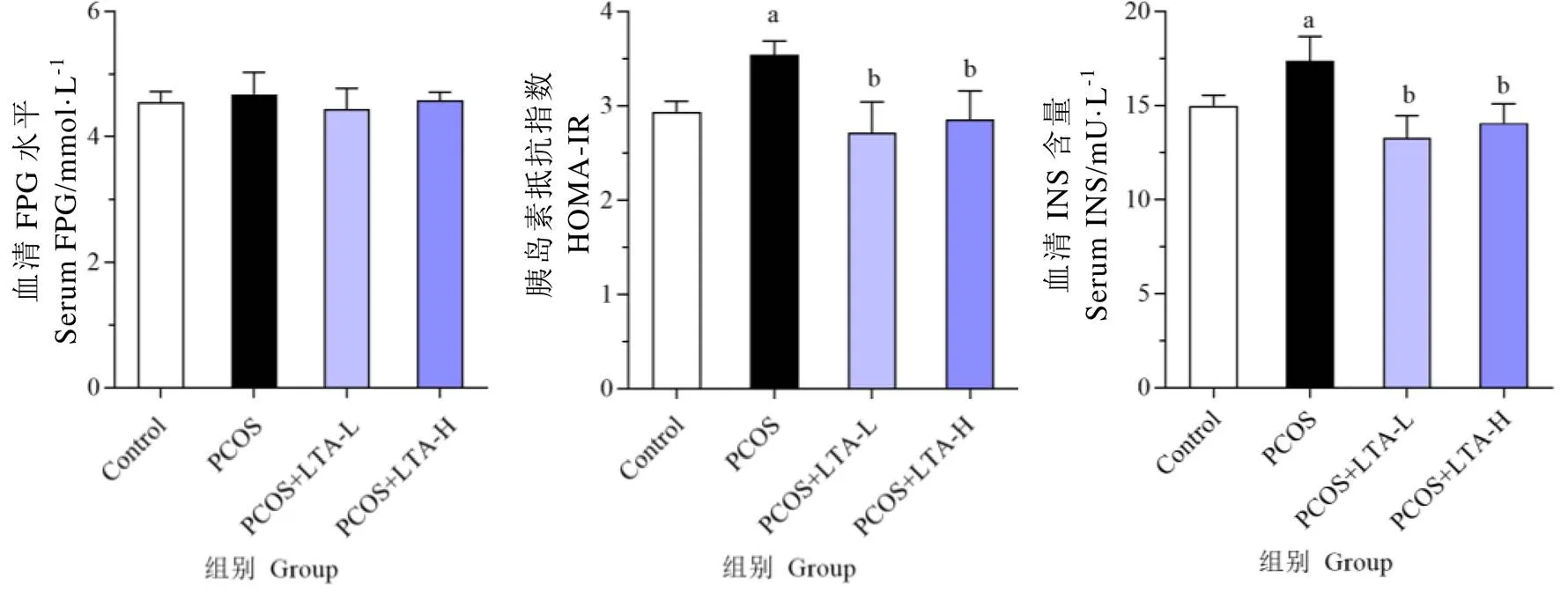
注:a:与正常组比较,P<0.05;b:与PCOS组比较,P<0.05
注:a:与正常组比较,<0.05;b:与PCOS组比较,<0.05
Note: a: compared with the normal group,<0.05. b: compared with the PCOS group,<0.05
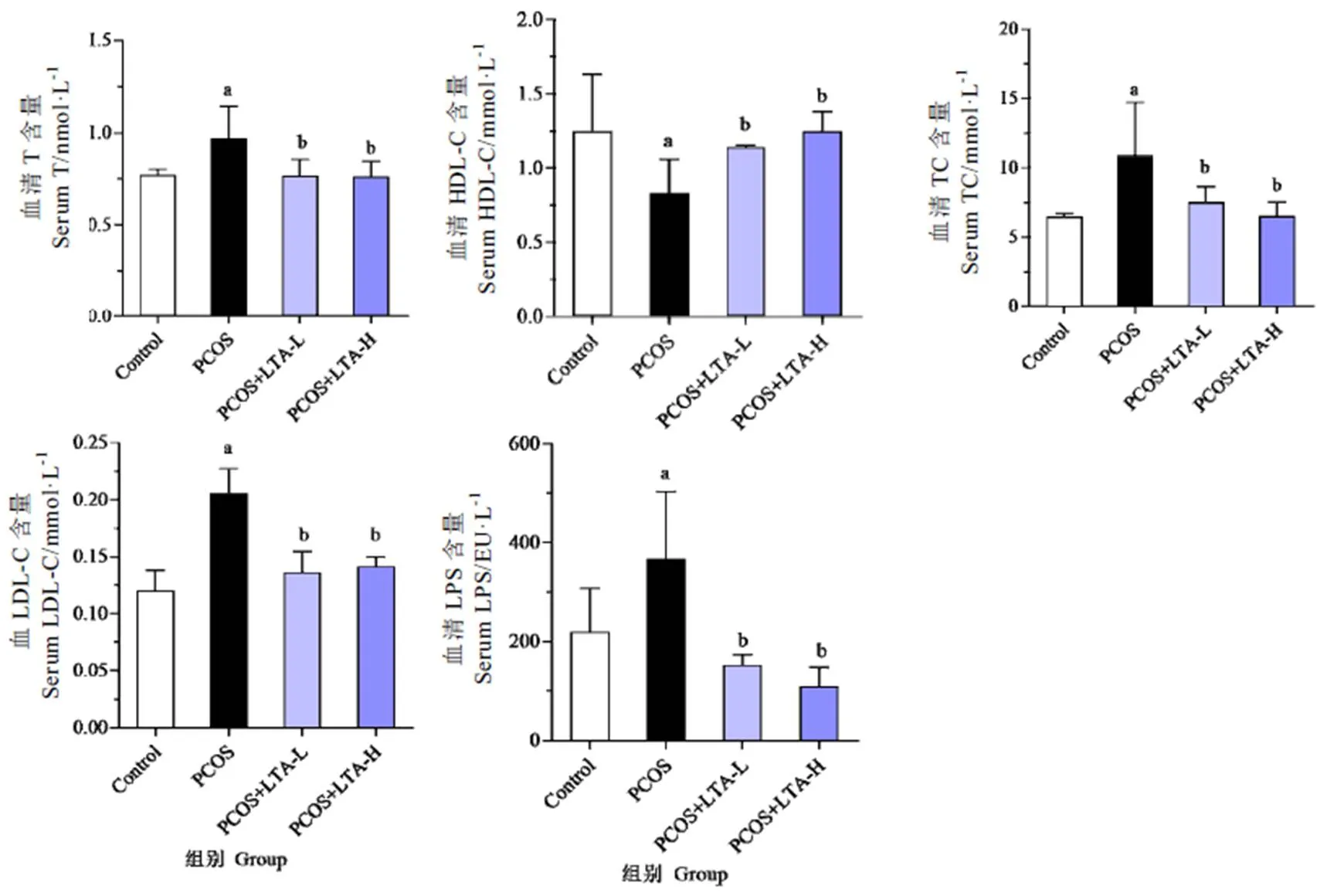
注:a:与正常组比较,P<0.05;b:与PCOS组比较,P<0.05
3 讨论与结论
PCOS作为一种青春期及育龄期妇女常见的代谢紊乱性生殖内分泌疾病,不仅影响女性的生殖功能,同时伴有胰岛素抵抗、高脂血症等代谢疾病。因而对PCOS患者的治疗,需要从不同途径作用于PCOS患者的内分泌异常和代谢紊乱,使其得到改善。LTA作为一种存在于茶树中的非蛋白质氨基酸,在抗氧化、抗应激、抗炎、调节肠道菌群结构、纠正代谢紊乱上均有一定的功效。本试验使用不同剂量的LTA干预来曲唑诱导的PCOS大鼠,分析其干预效果及机制。
本研究通过对大鼠灌胃来曲唑构造PCOS大鼠模型。来曲唑是一种非甾体芳香酶抑制剂,几乎不溶于水,而CMC作为一种理想的食品添加剂,也常添加于饲料中作为粘合剂,在一定剂量范围内对大鼠无特殊影响,故选用性质稳定低浓度的1%CMC充当悬浮剂[18]。干预结束后,H&E染色结果显示PCOS组大鼠卵巢出现了病理损伤,表现为颗粒细胞层变薄,囊状扩张卵泡和闭锁卵泡增多,而PCOS组大鼠的发情周期未恢复正常,提示PCOS大鼠模型建造成功。同时本研究结果表明两种剂量LTA均能有效改善PCOS大鼠卵巢的病理损伤。
PCOS患者中肥胖或超重的发生率约为40%~70%[19],腹腔脂肪的过度堆积则会增加患者发生代谢综合征的风险[20],其中以糖脂代谢紊乱最为显著。本研究的数据显示,PCOS模型组大鼠体重及腹部脂肪相对质量显著上升。说明PCOS也同样能导致大鼠体重增加以及腹部脂肪堆积。经过LTA干预之后,PCOS大鼠体重增长均受到抑制,且腹腔脂肪相对质量显著降低。虞希冲等[21]研究发现,茶氨酸能抑制雌性小鼠体重增长,所得的结论与本研究类似。研究表明,LTA可能通过影响PPAR/CPT-1、PPARα/LXRα及SREBP-1c/ACC1通路,进而促进大鼠脂肪酸氧化并抑制脂肪积累[22],最终减少大鼠腹腔脂肪的堆积并抑制大鼠体重的增长。
糖代谢异常是PCOS最为显著的代谢紊乱之一,而糖代谢异常的根本原因是IR的发生,也是PCOS重要的临床特征之一。IR使机体组织对INS的敏感性下降,导致胰岛细胞代偿性分泌更多INS以维持正常葡萄糖水平,进一步加重IR[23]。本研究结果显示,PCOS模型组大鼠的INS水平均显著上升,FPG水平未显著升高,这符合IR的表现。HOMA-IR是衡量胰岛素抵抗的指标。一项人群调查研究[24]显示,PCOS患者的INS和HOMA-IR水平均显著高于与其年龄和BMI匹配的正常对照组。本研究发现,PCOS+LTA-L组和PCOS+LTA-H组大鼠的INS水平和HOMA-IR均显著降低,说明LTA可改善PCOS大鼠的糖代谢紊乱。一项体外细胞实验[25]发现,LH在使卵泡膜细胞产生雄激素的同时,还激活了INS生长因子(Insulin growth factor,IGF),促进INS分泌。林玲[22]的研究也指出,LTA对大鼠IGF1及其受体的表达有抑制作用,能够通过促进胰岛素与胰岛素受体结合从而激活了胰岛素通路。以上的研究提示LTA可能通过抑制大鼠IGF1及其受体的表达,进而增强了PCOS大鼠组织对胰岛素的敏感性,并减少了PCOS大鼠胰岛素的分泌,最终改善机体IR情况。
除了糖代谢,血脂代谢异常也是PCOS患者中另一个常见代谢异常途径,其主要表现为TG、TC、LDL-C升高和HDL-C降低[26]。血脂代谢异常的发生发展与HA和IR关系密切,其可能机制是由于PCOS患者体内的高雄激素环境能够使机体循环中非酯化脂肪酸释放增加,而非酯化脂肪酸在肝脏内合成TG和TC增多,使得血清中的TG和TC升高。此外,高雄激素环境还通过增强脂肪细胞中的肾上腺素能受体和腺苷酸环化酶在脂代谢中的作用降低血清中HDL水平。同时,IR也能使肝脏内非酯化脂肪酸堆积,导致LDL和TG合成增加[27]。此外,有研究证实PCOS与肠道菌群紊乱具有密切联系。与正常女性组相比,PCOS患者组粪便中有益菌属、、和丰度显著降低,而拟杆菌属及埃希菌属等部分革兰阴性菌丰度显著增加[28-29]。而肠道中革兰阴性菌细胞壁的主要组分LPS,可穿过肠壁进入血循环后,引起全身持续性低水平炎性反应,导致机体血脂代谢紊乱[30]。研究结果显示,LTA干预使PCOS大鼠血清中TG、TC、LDL-C水平显著降低,HDL-C水平显著升高。同时,我们检测并分析了PCOS+LTA-L组和PCOS+LTA-H组大鼠血清中T、INS以及LPS水平,结果显示T、INS、LPS水平均显著低于PCOS模型组大鼠(<0.05)。说明LTA通过改善HA和IR进一步影响了大鼠血脂代谢;同时降低血清中LPS水平,使肠道菌群的结构得到改善,最终达到调节血脂紊乱的作用。此外,Xu等[10]的研究发现,LTA可增加大鼠粪便中,和等产SCFA菌属的比例,从而增加了肠道中SCFA的总量,而SCFA可以增强IL-22的产生,保护肠道免受炎症的侵害[31]。这提示LTA也可能通过调节SCFA改善血脂代谢紊乱,后续可做进一步研究。
性激素紊乱是PCOS的主要症状和关键诊断特征。性激素分泌紊乱使PCOS大鼠发情周期呈不规律变化,而长期性激素分泌失调可导致卵巢中出现多个扩张性囊状卵泡和闭锁卵泡等PCOS典型特征改变。有研究报道,雌性小鼠长期处于雄激素过多的状态,会导致卵泡发育异常,即使恢复到正常的雄激素水平,正常卵泡发育轨迹仍受到干扰[32]。正常情况下,LH和卵泡膜细胞上的LH受体结合产生T及雄烯二酮为主的雄激素,T可芳香化后转化为E2,而PCOS患者的LH分泌过多引起颗粒细胞的过早黄体化,不利于卵泡生长和排卵,雄激素水平也随之增高。此外,PCOS患者的FSH分泌被抑制,由FSH介导的芳香化酶也受到抑制,使得E2水平下降而T水平持续升高,性激素水平紊乱形成恶性循环,从而加速HA的发展[33-34]。研究结果显示,PCOS+LTA-L组和PCOS+LTA-H组大鼠性激素水平较PCOS组均有显著改善。阴道涂片一般用于观察大鼠的发情周期情况。结果显示,PCOS+LTA-L组和PCOS+LTA-H组大鼠的发情周期均恢复正常。相比于PCOS+LTA-L组,PCOS+LTA-H组大鼠的发情周期恢复时间较长,而本研究结果中LH/FSH比值与此结果趋势一致,提示LH和FSH可能是影响PCOS大鼠发情周期的主要指标。此外,有研究也发现高水平的雄激素与胰岛素抵抗之间存在双向关系,当机体处于高胰岛素环境下时,PCOS患者体内肝性激素结合球蛋白的产生水平也较正常人群升高,且同时也增加了游离睾丸激素的分泌量[35]。而较高的胰岛素水平会刺激卵泡膜细胞的雄激素合成,同时胰岛素抵抗会上调黄体生成素的分泌水平[27,36]。因此,LTA改善PCOS大鼠性激素水平紊乱的机制可能与其降低了胰岛素抵抗水平有一定的关系。
综上所述,本研究结果显示LTA处理可抑制PCOS大鼠体重的增长,改善IR、脂代谢紊乱并有效调控性激素和LPS的异常分泌,使PCOS大鼠卵巢多囊性病变得到改善及发情周期正常化,这为LTA应用于PCOS的辅助治疗和进一步开发提供了一定的科学依据。但是LTA对PCOS大鼠氧化应激指标及肠道菌群结构的具体影响尚不明确,后续应针对氧化应激水平及肠道菌群分布展开研究,以便探明其具体作用机制。
[1] Rao P, Bhide P. Controversies in the diagnosis of polycystic ovary syndrome [J]. Therapeutic Advances in Reproductive Health, 2020, 14: 1-11. doi: 10.1177/2633494120913032.
[2] Yang R, Yang S, Li R, et al. Effects of hyperandrogenism on metabolic abnormalities in patients with polycystic ovary syndrome: a meta-analysis [J]. Reprod Biol Endocrinol, 2016, 14(1): 67. doi: 10.1186/s12958-016-0203-8.
[3] Liu Q, Xie Y J, Qu L H, et al. Dyslipidemia involvement in the development of polycystic ovary syndrome [J]. Taiwanese Journal of Obstetrics & Gynecology, 2019, 58(4): 447-453.
[4] Jin P P, Xie Y Y. Treatment strategies for women with polycystic ovary syndrome [J]. Gynecol Endocrinol, 2018, 34(4): 272-277.
[5] Cunha A, Póvoa A M. Infertility management in women with polycystic ovary syndrome: a review [J]. Porto Biomed Journal, 2021, 6(1): e116. doi: 10.1097/j.pbj.0000000000000116.
[6] 刘杉, 李炜. L-茶氨酸药理作用的研究进展[J]. 神经药理学报, 2020, 10(2): 24-32.
Liu S, Li W. Research progress on pharmacological effects of L-theanine [J]. Acta Neuropharmacologica, 2020, 10(2): 24-32.
[7] 杨洲. 茶氨酸保健作用研究进展[J]. 茶叶通讯, 2018, 45(2): 3-7. Yang Z. Research progress in the healthy functions of theanine [J]. Journal of Tea Communication, 2018, 45(2): 3-7.
[8] 彭彬, 刘仲华, 林勇, 等.-茶氨酸改善慢性应激大鼠抑郁行为作用研究[J]. 茶叶科学, 2014, 34(4): 355-363.
Peng B, Liu Z H, Lin Y, et al. The ameliorative effect of-theanine on chronic unpredictable mild stress-induced depression in rats [J]. Journal of Tea Science, 2014, 34 (4): 355-363.
[9] 彭影琦, 肖文军, 张盛, 等.-茶氨酸对小鼠肠道形态结构及游离氨基酸的影响[J]. 茶叶科学, 2019, 39(1): 43-54.
Peng Y Q, Xiao W J, Zhang S, et al. Effects of-theanine on intestinal morphology and free amino acids in mice [J]. Journal of Tea Science, 2019, 39(1): 43-54.
[10] Xu W, Lin L, Liu A, et al. L-theanine affects intestinal mucosal immunity by regulating short-chain fatty acid metabolism under dietary fiber feeding [J]. Food & Function, 2020, 11(9): 8369-8379.
[11] 刘秋玲, 龚志华, 陈凌, 等.-茶氨酸对产肠毒性大肠杆菌引起的免疫应激小鼠肝脏的保护作用研究[J]. 茶叶科学, 2016, 36(5): 484-490.
Liu Q L, Gong Z H, Chen L, et al. Study on the protective effect of-theanine on the liver of mice with immune stress induced by ETEC [J]. Journal of Tea Science, 2016, 36(5): 484-490.
[12] 刘遵莹, 刘秋玲, 邓燕莉, 等.-茶氨酸对产肠毒素大肠杆菌引起的免疫应激小鼠肠道的保护作用研究[J]. 茶叶科学, 2016, 36(5): 469-476.
Liu Z Y, Liu Q L, Deng Y L, et al. Study on the protective effect of-Theanine on the intestinal in mice with immune stress induced by ETEC [J]. Journal of Tea Science, 2016, 36(5): 469-476.
[13] Lin L, Zeng L, Liu A, et al. L-Theanine regulates glucose, lipid, and protein metabolisminsulin and AMP-activated protein kinase signaling pathways [J]. Food & Function, 2020, 11(2): 1798-1809.
[14] Kafali H, Iriadam M, Ozardali I, et al. Letrozole-induced polycystic ovaries in the rat: a new model for cystic ovarian disease [J]. Archives of Medical Research, 2004, 35(2): 103-108.
[15] 宋玉欣, 张娇, 贺麟, 等.-茶氨酸对高蛋白饮食诱导大鼠行为变化的干预作用[J]. 食品科学, 2021, 42(5): 187-192.
Song Y X, Zhang J, He L, et al. Intervention effect of L-theanine on behavioral changes induced by high protein diet in rats [J]. Food Science, 2021, 42(5): 187-192.
[16] 曾立, 林玲, 彭影琦, 等.-茶氨酸对D-半乳糖诱导衰老大鼠肝脏的晚期糖基化终末产物和炎性介质的影响[J]. 湖南农业大学学报(自然科学版), 2019, 45(6): 641-649.
Zeng L, Lin L, Peng Y Q, et al. Effect of-theanine on AGEs and inflammatory mediators in the liver of-galactose-induced senescence rats [J]. Journal of Hunan Agricultural University (Natural Sciences), 2019, 45(6): 641-649.
[17] 闫丽, 温和, 唐桂毅, 等. 大鼠阴道细胞涂片不同染色方法在动情周期判定中的价值[J]. 药物评价研究, 2020, 43(1): 72-76.
Yan L, Wen H, Tang G Y, et al. Diagnostic value of three staining methods for rat vaginal cell smears in determination of estrous cycle [J]. Drug Evaluation Research, 2020, 43(1): 72-76.
[18] 杨金姝. 羧甲基纤维素钠在食品工业中的应用研究[J]. 农产品加工, 2014(11): 76-78.
Yang J S. Application of sodium carboxymethyl cellulose in food industry [J]. Farm Products Processing, 2014(11): 76-78.
[19] Beydoun H A, Beydoun M A, Hossain S, et al. Patterns of bariatric surgeries among US women diagnosed with polycystic ovarian syndrome [J]. Journal of Women's Health, 2020, 29(4): 585-595.
[20] Dumesic D A, Akopians A L, Madrigal V K, et al. Hyperandrogenism accompanies increased Intra-abdominal fat storage in normal weight polycystic ovary syndrome women [J]. The Journal of Clinical Endocrinology & Metabolism, 2016, 101(11): 4178-4188.
[21] 虞希冲, 杨伟, 吴波拉. 茶氨酸经下丘脑腹外侧核抑制雌性小鼠摄食与胃排空作用研究[J]. 茶叶科学, 2013, 33(5): 429-435.
Yu X C, Yang W, Wu B L. Theanine depressed the food intake and gastric emptying in female mice via lateral hypothalamic AMPA and NMDA receptor [J]. Journal of Tea Science, 2013, 33(5): 429-435.
[22] 林玲. L-茶氨酸对糖、脂肪和蛋白质代谢的影响及机制[D]. 长沙: 湖南农业大学, 2019.
Lin L. Effects and mechanisms of L-theanine on metabolism of glucose, lipid and protein [D]. Changsha: Hunan Agricultural University, 2019.
[23] 胡伟. PCOS患者糖脂代谢异常及其与胰岛素抵抗的相关性分析[D]. 新乡: 新乡医学院, 2017.
Hu W. Abnormal glucose and lipid metabolism in PCOS patients and its correlation with insulin resistance [D]. Xinxiang : Xinxiang Medical College, 2017.
[24] Alissa E M, Algarni S A, Khaffji A J, et al. Role of inflammatory markers in polycystic ovaries syndrome: in relation to insulin resistance [J]. Journal of Obstetrics and Gynaecology Research, 2021, 47(4):1409-1415.
[25] Hattori K, Orisaka M, Fukuda S, et al. Luteinizing hormone facilitates antral follicular maturation and survival via thecal paracrine signaling in cattle [J]. Endocrinology, 2018, 159(6): 2337-2347.
[26] Gourgari E, Lodish M, Shamburek R, et al. Lipoprotein particles in adolescents and young women with PCOS provide insights into their cardiovascular risk [J]. The Journal of Clinical Endocrinology & Metabolism, 2015, 100(11): 4291-4298.
[27] 张美微, 侯丽辉, 李妍. 高雄激素血症与胰岛素抵抗对PCOS患者脂代谢的影响[J]. 河北医学, 2019, 25(10): 1690-1694.
Zhang M W, Hou L H, Li Y. Effects of hyperandrogenemia and insulin resistance on lipid metabolism in patients with PCOS [J]. Hebei Medicine, 2019, 25(10): 1690-1694.
[28] Liu R, Zhang C, Shi Y, et al. Dysbiosis of gut microbiota associated with clinical parameters in polycystic ovary syndrome [J]. Frontiers in Microbiology, 2017, 8: 324. doi: 10.3389/fmicb.2017.00324.
[29] Zhang J, Sun Z, Jiang S, et al. Probiotic bifidobacterium lactis V9regulates the secretion of sex hormones in polycystic ovary syndrome patients through the gut-brain Axis [J]. mSystems, 2019, 4(2): e00017- e00019. doi: 10.1128/mSystems.00017-19.
[30] Hersoug L G, Møller P, Loft S. Gut microbiota-derived lipopolysaccharide uptake and trafficking to adipose tissue: implications for inflammation and obesity [J]. Obesity Reviews, 2016, 17(4): 297-312.
[31] Yang W, Yu T, Huang X, et al. Intestinal microbiota-derived short-chain fatty acids regulation of immune cell IL-22 production and gut immunity [J]. Nature Communications, 2020, 11(1): 4457. doi: 10.1038/s41467-020-18262-6.
[32] Bertoldo M J, Caldwell A S L, Riepsamen A H, et al. A Hyperandrogenic environment causes Intrinsic defects that are detrimental to follicular dynamics in a PCOS mouse model [J]. Endocrinology, 2019, 160(3): 699-715.
[33] Dumesic D A, Oberfield S E, Stener-Victorin E, et al. Scientific statement on the diagnostic criteria, epidemiology, pathophysiology, and molecular genetics of polycystic ovary syndrome [J]. Endocrine Reviews, 2015, 36(5): 487-525.
[34] Dewailly D, Robin G, Peigne M, et al. Interactions between androgens, FSH, anti-Müllerian hormone and estradiol during folliculogenesis in the human normal and polycystic ovary [J]. Human Reproduction Update, 2016, 22(6): 709-724.
[35] Cassar S, Misso M L, Hopkins W G, et al. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic-hyperinsulinaemic clamp studies [J]. Human Reproduction, 2016, 31(11): 2619-2631.
[36] Moghetti P, Tosi F. Insulin resistance and PCOS: chicken or egg? [J]. Journal of Endocrinological Investigation, 2021, 44(2): 233-244.
-Theanine Ameliorated Clinical Symptoms in Letrozole-Induced Polycystic Ovary Syndrome Rats
HUANG Qiuping1, XIE Chenyang1, LI Xinyu1, JIN Bin1, ZENG Zhen1,2, QIAN Bo1,3, DAI Ling6*, SONG Jiale1,4,5,7*
1. School of Public Health, Guilin Medical University, Guilin 541199, China; 2. Xiangya School of Public Health, Central South University, Changsha 410000, Hunan; 3. School of Public Health, Xiamen University, Xiamen 361102, China; 4.Guangxi Health Commission Key Laboratory of Entire Lifecycle Health and Care, Guilin 541199, China; 5. Guangxi Key Laboratory of Enviromental Exposomics and Entire Lifecycle Health, Guilin 541199, China; 6. Center of Mental Health Education and Counseling, Guilin Medical University, Guilin 541199, China; 7. Department of Clinical Nutrition, The Second Affiliated Hospital of Guilin Medical College, Guilin 541109, China
To explore the improvement effect of-theanine (LTA) on the clinical symptoms of letrozole-induced polycystic ovary syndrome (PCOS) rats, twenty-eight female SD rats were randomly divided into control group, PCOS group, PCOS+low-dose LTA group, and PCOS+high-dose LTA group with 7 rats in each group. In the modeling stage, except for the control group, the other three groups were administered letrozole continuously for 28 days to induce the PCOS model. During the intervention phase, the normal control group and the PCOS group were given continuous gastric administration with normal saline, and the rats in the two LTA groups were given continuous gastric administration with the corresponding dose of LTA intervention for 30 days. The results show that compared with the PCOS group, the serum testosterone (T), luteinizing hormone (LH), insulin (INS), triglyceride (TG), total cholesterol (TC), low-density lipoprotein cholesterol (LDL-C), lipopolysaccharide (LPS) levels and homeostasis model assessment-insulin resistance (HOMA-IR) index in the LTA intervention group were significantly reduced (<0.05), high-density lipoprotein cholesterol (HDL-C) was significantly increased (<0.05), ratio of luteinizing hormone to follicle stimulating hormone (LH/FSH), fasting plasma glucose (FPG) and body weight were decreased (>0.05). The serum estradiol (E2) of rats in the low-dose LTA intervention group was significantly increased (<0.05). Follicle stimulating hormone (FSH) of mice in the high-dose LTA intervention group was significantly increased (<0.05). At the same time, rat estrous cycle disorder and polycystic lesions of ovarian tissue were improved to a certain extent compared with PCOS group. The results show that LTA intervention can effectively regulate the secretion of sex hormones in PCOS rats, restore the regular changes of the estrus cycle, improve their ovarian polycystic lesions, and significantly improve insulin resistance (IR) and blood lipid metabolism disorders in PCOS rats and inhibit abnormal levels of lipopolysaccharide (LPS) secretion.
-theanine, polycystic ovary syndrome, hyperandrogenemia, insulin resistance
S571.1;R373
A
1000-369X(2021)06-831-12
2021-03-25
2021-06-22
人社部“高层次留学人才回国资助计划”(人社厅函[2019]160号)、广西高等学校千名中青年骨干教师培育计划资助(桂教人[2018]18号)、广西高校中青年教师科研基础能力提升项目(2018KY0401)、桂林医学院引进人才科研启动基金(04010150001)、2020年国家级大学生创新创业训练计划项目(202010601031)
黄秋萍,女,本科,主要从事营养与食品卫生学方面的研究。*通信作者:305743680@qq.com;songjiale@glmc.edu.cn
(责任编辑:赵锋)

