茶树CsMGTs基因的克隆及其镁转运功能分析
唐磊,肖罗丹,黄伊凡,肖斌,龚春梅
茶树基因的克隆及其镁转运功能分析
唐磊,肖罗丹,黄伊凡,肖斌,龚春梅*
西北农林科技大学园艺学院,陕西 杨凌 712100
镁离子(Mg2+)作为叶绿素的中心成分,是植物细胞中含量最丰富的二价阳离子,也是多种酶的激活剂,特别是茶氨酸合成酶的活性依赖Mg2+,常被作为茶树专用肥的特征成分,因此对茶树的生长发育和茶叶的品质形成至关重要。MRS2/MGT家族镁转运蛋白在维持植物体内Mg2+的吸收转运、胞内平衡和耐逆性等方面起着重要的作用。为探究茶树MRS2/MGT家族镁转运蛋白基因的功能,以茶树品种陕茶1号为材料,克隆了4条镁转运蛋白基因,分别命名为、、和。生物信息学分析表明,这4个转运蛋白在C末端均含有2个跨膜结构域和1个保守的GMN三肽基序;系统发育分析显示,属于Clade C成员,而、和属于Clade B成员,所编码蛋白与木本植物柑橘MGT家族的亲缘关系最近。实时荧光定量PCR(qRT-PCR)分析表明,、、和在茶树的根、茎、叶、花中呈组成型表达,且根和叶对Mg2+浓度均表现出不同程度的响应。鼠伤寒沙门氏菌镁转运缺失突变株MM281功能互补试验表明,CsMGT1和CsMGT2均具有Mg2+转运功能,且CsMGT1的Mg2+转运功能优于CsMGT2,而CsMGT2.1和CsMGT3几乎没有镁离子转运功能。本研究结果丰富了茶树CsMGTs家族的生物学功能,为进一步阐明茶树通过镁转运功能机制实现对镁离子的利用奠定了前期研究基础。
茶树;MRS2/MGT;基因克隆;表达模式;功能分析
镁离子(Mg2+)是一种重要的营养元素,对植物生长发育和生殖具有重要影响[1]。Mg2+对于核酸、蛋白质、细胞膜和细胞壁等大分子的构象稳定至关重要;作为植物体内多种酶的激活剂或辅因子,维持H+-ATP酶、激酶和聚合酶等酶活性[2];Mg2+还是叶绿素分子的中心组分,可促进光合作用的碳同化,参与类囊体膜垛叠形成基粒,调节叶绿体不同光系统之间激发能的分配,稳定叶绿体结构[1]。Mg2+还参与跨膜电子梯度的建立,作为细胞中阴阳离子平衡的调节因子,与K+一起作为渗透活性离子调节细胞膨压[2]。此外,Mg2+在植物抗病[3]、耐重金属胁迫[4-5]和提高作物产量及品质[6-8]中发挥作用。
CorA蛋白是研究最广泛的Mg2+转运系统,其家族成员广泛分布于细菌、真菌、动物和植物中,平衡着细胞内Mg2+的流入和流出[9]。在细菌中的研究结果表明,编码一种漏斗状的同源五聚体蛋白结构,其N端具有一个酸性周质结构域,C端拥有两个跨膜区[10-12]。植物中已鉴定出质子依赖型Mg2+/H+交换体和CorA类Mg2+转运体(MRS2/MGT)两类镁离子转运蛋白[11,13]。MRS2/MGT镁转运蛋白家族已在拟南芥[11]、水稻[14]、玉米[15]、油菜[16]、梨[17]、柑橘[18]等植物中被鉴定;在橡胶树[19]和铁皮石斛[20]中也鉴定出MRS2/MGT镁转运蛋白的存在。在拟南芥中,参与了根系对Mg2+的吸收,并提高了植物对铝的耐受性[11,21-22];、和参与了Mg2+的稳态调节,并且提高了拟南芥在低镁和高镁环境下的耐受性[9,23-24];、和对正常花粉的发育尤为重要,突变会引起花粉发育异常或败育[25-27];在响应低镁胁迫的同时,还参与拟南芥对高钙环境的适应[28-29];而影响镁离子转运、叶绿体发育、光合作用和叶脉黄化表型的发育[30-32]。此外,玉米和柑橘已被证明受缺镁诱导,并具有低镁或缺镁耐受性[18,33]。
茶树[(L.)O. Kuntze]是全世界重要的经济作物之一,富含茶多酚、茶氨酸、咖啡碱、茶多糖等功能成分,经常饮茶有利于人的身心健康。近年来,由于气候、成土母质及氮、磷、钾化学肥料的大量施用等原因,我国部分茶园土壤存在着有效镁含量缺乏的现象[34-37],从而导致茶叶的产量和品质下降[35,37-39]。研究表明,影响茶氨酸合成的茶氨酸合成酶对Mg2+浓度有依赖性,施镁增加了茶叶中游离氨基酸和咖啡碱的含量,使酚氨比趋于合理[39-40]。在生产实践中,常需要在茶树专用肥中添加一定比例的镁元素以满足茶树对镁元素的需求[41-42]。为了适应不同茶园土壤的Mg2+含量,茶树可以通过MGT等镁转运蛋白调节体内Mg2+浓度以维持其生长发育,并提高产量和品质。因此,探究茶树MGT镁转运蛋白的功能对理解茶树的镁离子转运吸收机制具有重要意义。本研究利用RT-PCR技术从茶树中克隆了4个镁转运蛋白基因,进行了生物信息学分析及不同镁离子处理下的表达模式分析,并在鼠伤寒沙门氏菌镁转运缺陷突变株MM281中验证了其镁转运功能,为进一步阐明茶树通过镁转运功能实现对镁离子的利用奠定了分子生物学基础。
1 材料与方法
1.1 试验材料与处理方法
试验材料为长势和质量基本一致的两年生陕茶1号扦插苗,用清水洗净茶苗根部泥土,采用小西茂毅营养液[43]配方(含0.1 mmol∙L-1Mg2+),将其水培于西北农林科技大学人工气候室内,保持培养温度25℃白天/20℃晚上,光周期12 h光照/12 h黑暗,空气相对湿度(75±5)%。每周更换1次营养液,24 h连续通气。待茶苗培养4个月后,选取长出大量白色幼根、长势一致的茶苗,对其分别进行0 mmol∙L-1Mg2+(缺镁)和2 mmol∙L-1Mg2+(高镁)处理,然后在处理后0、2、6、12、24、48 h分别收集茶树的幼嫩白根和芽下一、二叶。另外,在西北农林科技大学科研温室进行两年生陕茶1号土培处理(保持自然光照和空气相对湿度,控制夏季温度不超过30℃,冬季温度不低于5℃),采集春季新梢生长至一芽四、五叶茶苗的幼嫩白根,芽下第一、二叶对应的嫩茎,芽下第二叶及秋季盛花期的全花分别作为根、茎、叶、花样品。每个处理设置3次生物学重复,所有样品采集后立即液氮速冻,然后保存于–80℃备用。
1.2 总RNA提取和cDNA的合成
采用CTAB法提取茶树样品的总RNA,用NanoDrop 2000c(Thermo Scientific,美国)超微量分光光度计测定RNA的浓度和质量,RNA的完整性用1.0%琼脂糖凝胶电泳检测。按照5×All-In-One RT MasterMix试剂盒(ABM,加拿大)说明书进行cDNA第一链合成,保存于–20℃备用。
1.3 CsMGTs基因的克隆
参照已经发表的云抗10号茶树基因组[44]数据,使用在线软件IDT(http://sg.idtdna.com/ calc/analyzer)设计基因特异性引物(表1)。以茶树样品cDNA第一链为模板,进行PCR扩增。扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 90 s,35个循环;72℃延伸7 min。采用Gel Extraction Kit(OMEGA,美国)纯化试剂盒回收PCR产物,然后将其连接至pMD19-T载体上转化大肠杆菌DH5感受态细胞,筛选阳性单克隆送至北京奥科鼎盛生物科技有限公司完成测序。
1.4 生物信息学分析
通过ProtParam工具(https://web.expasy.org/protparam)计算CsMGTs的理论等电点(pI)、分子量(Mw)和总平均亲水性(GRAVY)等特征;使用ProtScale(https://web.expasy.org/protscale)预测CsMGTs蛋白的亲/疏水性;跨膜结构(TM)由TMHMM Server v. 2.0 (www.cbs.dtu.dk/services/TMHMM)预测;磷酸化位点采用NetPhos 3.1 Server(www.cbs.dtu.dk/services/NetPhos)预测;采用Gene Structure Display Server 2.0工具(http://gsds.gao-lab.org/index.php)对基因结构进行评估;保守基序通过MEME(http://meme-suite.org/tools/meme)分析。根据WoLF PSORT程序(https://wolfpsort.hgc.jp)进行CsMGTs的亚细胞定位预测。利用DNAMAN 7.0进行氨基酸多序列比对;系统发育分析采用MEGA 7.0软件的邻接法(Neighbor-Joining tree)完成(Bootstrap检验值为1 000)。
1.5 实时荧光定量PCR(qRT-PCR)分析
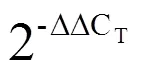
1.6 鼠伤寒沙门氏菌镁转运缺陷突变株MM281功能互补分析
为了阐明CsMGT1、CsMGT2、CsMGT2.1和CsMGT3的Mg2+转运活性,用带有酶切位点的基因特异性引物(表2)扩增目标基因,然后使用NovoRec®Plus PCR(Novoprotein Scientific Inc,中国上海)试剂盒将其插入到经过酶切的pTrc99A载体中,热激转化MM281感受态细胞,测序进行阳性验证。以MM1927作为阳性对照,MM281和转空pTrc99A载体的MM281作为阴性对照。功能互补试验参照Mao等[9]方法并稍作改进。具体步骤为:取各菌液接种于含0.05 mmol∙L-1IPTG和10 mmol∙L-1MgSO4的LB培养基(含100 mg∙L-1Amp,34 mg∙L-1Chl),37℃振荡培养至OD600=1.0,分别将其稀释为1×10-1、1×10-2、1×10-3、1×10-4等4个浓度梯度,吸取3 μL不同浓度的菌液点于N-minimal固体平板(Mg2+浓度依次为:0.01、0.5、1、2、5、10 mmol∙L-1),37℃恒温培养2 d后观察菌株生长情况并拍照。为了检测各菌株在液体培养基中的生长率,将各菌株于37℃振荡培养至OD600=0.6~0.8,然后6 000 r∙min-1离心2 min,重悬后接种于不同Mg2+浓度(0.01、0.5、1、10 mmol∙L-1)的液体培养基,调整初始OD600=0.001~0.002,37℃ 200 r∙min-1振荡培养,每3 h测定细菌OD600直至24 h,绘制生长曲线。
2 结果与分析
2.1 茶树CsMGTs基因的克隆
以两年生陕茶1号茶树样品的cDNA为模板,使用特异性引物(表1)进行、、和的PCR扩增,分别获得长度为1 373、1 335、1 335、1 328 bp的条带(图1);测序分析表明,、、和的序列与云抗10号茶树基因组中的候选序列较为一致,其ORF长度分别为1 320、1 335、1 335 bp和1 269 bp,分别编码439、444、444、422个氨基酸(表3);将4条序列与舒茶早和龙井43基因组进行比对(表3)并将其登录至GenBank,登录号分别为MN623276、MN623277、MN623278和MN623279。

表1 基因克隆及荧光定量PCR引物序列

表2 鼠伤寒沙门式菌MM281互补试验引物序列
注:下划线部分表示酶切位点,GGATCC表示BamHI酶切位点,TCTAGA表示XbaI酶切位点
Note: The underlined parts represent the restriction sites, GGATCC and TCTAGA represent BamHI and XbaI restriction sites, respectively
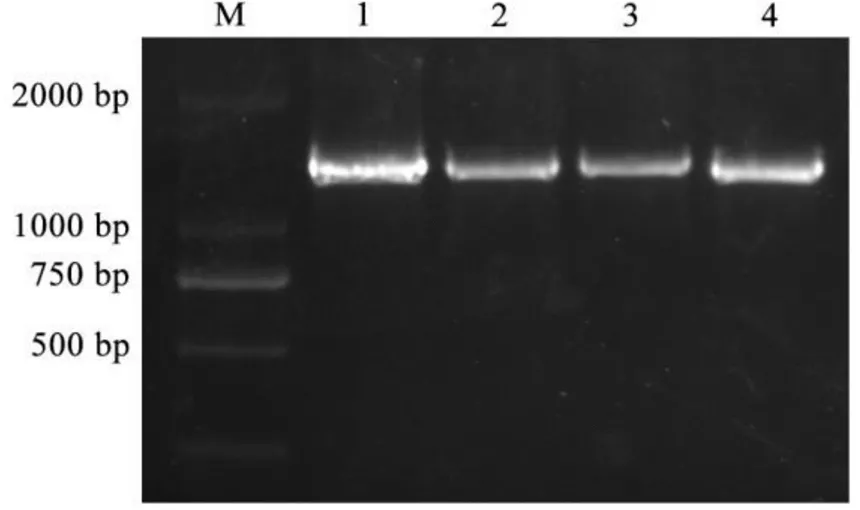
注:M:D 2 000 bp Marker;1:CsMGT1;2:CsMGT2;3:CsMGT2.1;4:CsMGT3
2.2 编码蛋白质理化性质分析
运用ProtParam tool预测氨基酸组成与理化性质的结果表明,CsMGT1、CsMGT2、CsMGT2.1和CsMGT3的化学分子式分别为C2130H3401N589O683S26、C2245H3598N606O672S19、C2241H3565N601O672S18和C2107H3330N562O630S20,编码蛋白的分子量分别为49.02、50.44、50.26、47.26 kDa,脂肪族氨基酸指数分别为86.83、99.66、96.60和97.70;理论等电点(pI)最大值为5.59,最小值为4.97,表明这4个蛋白质均为酸性蛋白;不稳定系数分别为43.15、60.21、56.95和40.29,表明其均为不稳定蛋白(表3)。负电荷残基(Asp+Glu)的最大值为CsMGT1的66个,最小值为CsMGT3的51个;而正电荷残基(Arg+Lys)的最大值为CsMGT2的55个,最小值为CsMGT1和CsMGT3的40个。
亲疏水性分析的结果显示,CsMGT1、CsMGT2、CsMGT2.1和CsMGT3的总平均亲水性分别为–0.331、–0.113、–0.096和–0.034(表3),表明其均为亲水性蛋白,这与ProtScale的分析结果较为一致(图2)。
蛋白磷酸化位点预测结果表明,CsMGT1含有45个磷酸化位点,其中21个苏氨酸(T)位点,21个丝氨酸(S)位点和3个酪氨酸(Y)位点(图3-A);CsMGT2含有48个磷酸化位点,其中14个苏氨酸(T)位点,30个丝氨酸(S)位点和4个酪氨酸(Y)位点(图3-B);CsMGT2.1和CsMGT3分别含有56个和41个磷酸化位点,其中苏氨酸(T)位点分别有17个和8个,丝氨酸(S)位点分别有34个和29个,酪氨酸(Y)位点分别有5个和4个(图3-C和图3-D)。
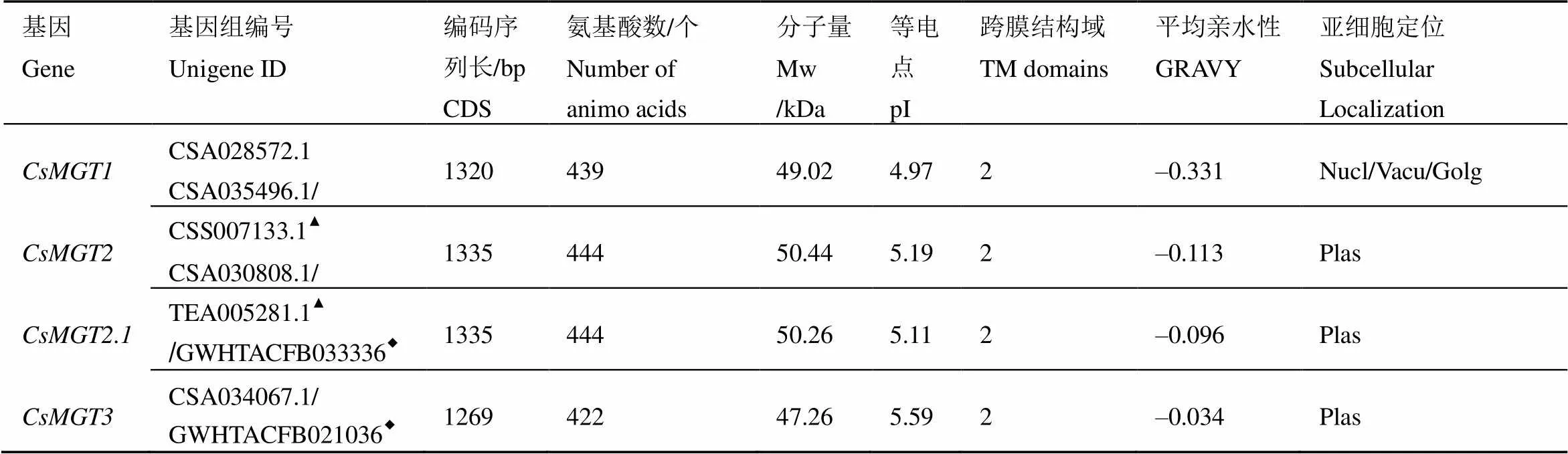
表3 CsMGT基因及其预测蛋白的基本信息
注:基因组编号中标注菱形的来源于龙井43基因组[45],三角形来源于舒茶早基因组[46],其余来自云抗10号基因组[44]。Nucl:细胞核;Vacu:液泡;Golg:高尔基体;Plas:质膜
Note: Unigene IDs marked with diamonds are from the ‘Longjing 43’ genome[45], the triangles are from the ’Shuchazao’ genome[46], and others are from the ’Yunkang 10’ genome[44]. Nucl: nucleus; Vacu: vacuole; Golg: golgi apparatus. Plas: plasma membrane
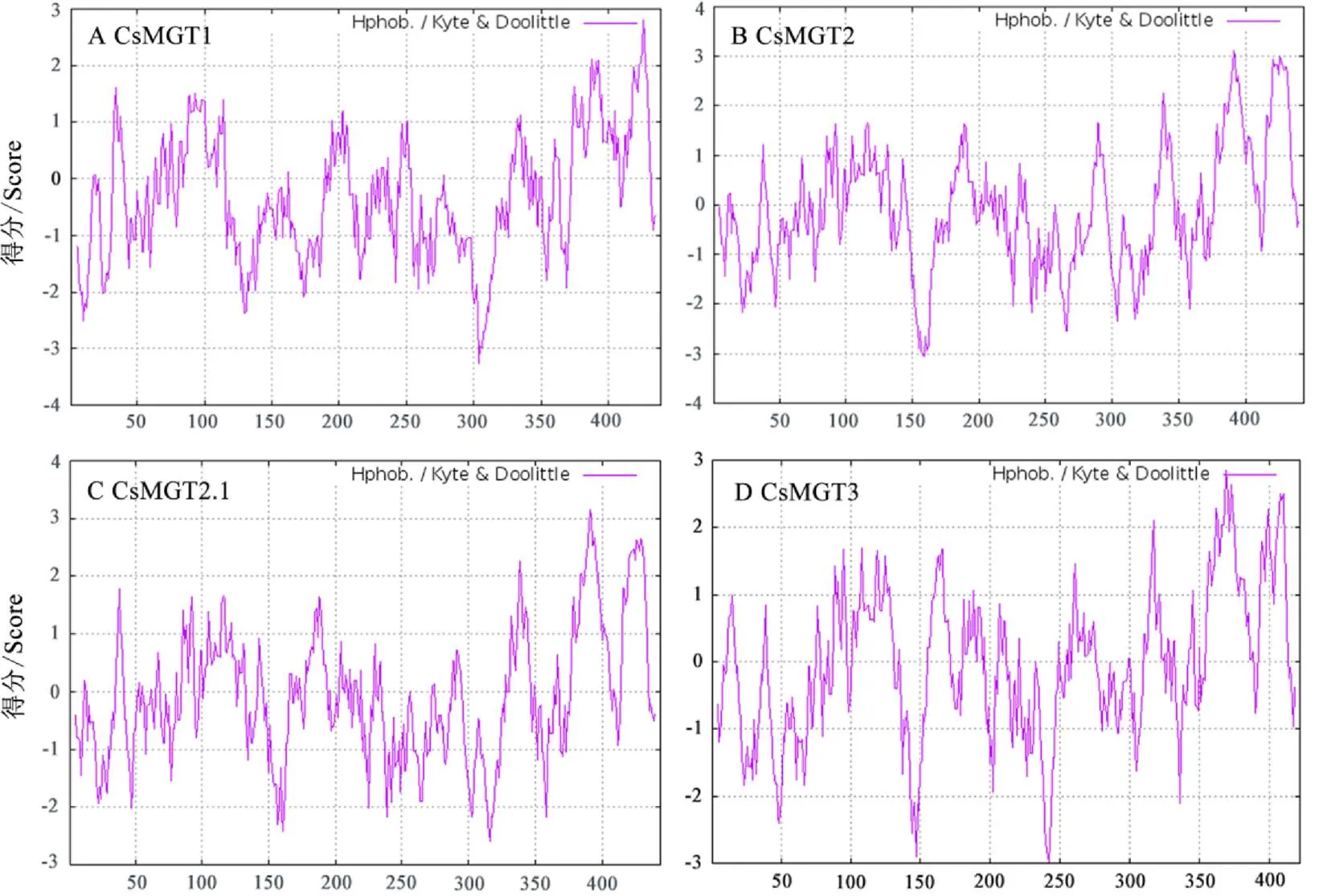
图2 茶树CsMGTs的亲/疏水性分析
另外,跨膜结构预测发现CsMGT1、CsMGT2、CsMGT2.1和CsMGT3在C端均含两个保守的跨膜结构域。WoLF PSORT的亚细胞定位预测表明CsMGT1可能定位于细胞核、液泡和(或)高尔基体,而CsMGT2、CsMGT2.1和CsMGT3均定位于质膜(表3)。
2.3 基因结构和保守基序分析
使用GSDS工具进行的基因结构分析表明,和均含有5个长度不同的内含子,而和均只有4个内含子(图4-A)。为了研究4个CsMGT蛋白的保守基序,使用MEME工具完成了10个Motif的预测。结果表明,在所有的CsMGTs中均发现了Motif 1、Motif 2、Motif 3、Motif 4和Motif 5,Motif 6和Motif 8只存在于CsMGT2和CsMGT2.1中,Motif 10只在CsMGT1和CsMGT3中预测到,而Motif 7和Motif 9特异性存在于CsMGT2、CsMGT2.1和CsMGT3中(图4-B和表4)。
2.4 氨基酸序列比对和系统发育分析
为探究茶树CsMGT1、CsMGT2、CsMGT2.1和CsMGT3与拟南芥、水稻和柑橘的MRS2/MGT家族的进化关系,选取它们的氨基酸序列并使用MEGA 7.0的邻接法进行了系统发育分析。结果表明,CsMGT1与柑橘PtrMGT4的亲缘关系最近,与水稻OsMRS2-2、OsMRS2-3及OsMRS2-8同属于Clade C成员;CsMGT2、CsMGT2.1和CsMGT3均属于Clade B成员,CsMGT2和CsMGT2.1聚在一起,它们与PtrMGT1的亲缘关系最近,其次为AtMGT1、AtMGT2、OsMRS2-1及OsMRS2-9,而CsMGT3与PtrMGT2的亲缘关系最近,其次为AtMGT3(图5)。这些结果表明茶树CsMGT1、CsMGT2、CsMGT2.1和CsMGT3与木本植物的MRS2/MGT成员具有较近的亲缘关系。另外,拟南芥、水稻和柑橘的MRS2/MGT家族蛋白均分布于5个分支中,这表明MRS2/MGT家族成员在单子叶植物和双子叶植物分开之前就已经存在。
选取拟南芥、水稻和柑橘等亲缘关系较近的MRS2/MGT成员的氨基酸序列与茶树CsMGT1、CsMGT2、CsMGT3和CsMGT4进行氨基酸多序列比对,发现它们的相似性为56.96%,特别是在C末端均含有两个跨膜结构,在第一个跨膜结构末尾均含有MRS2/MGT家族保守的GMN三肽基序(图6)。
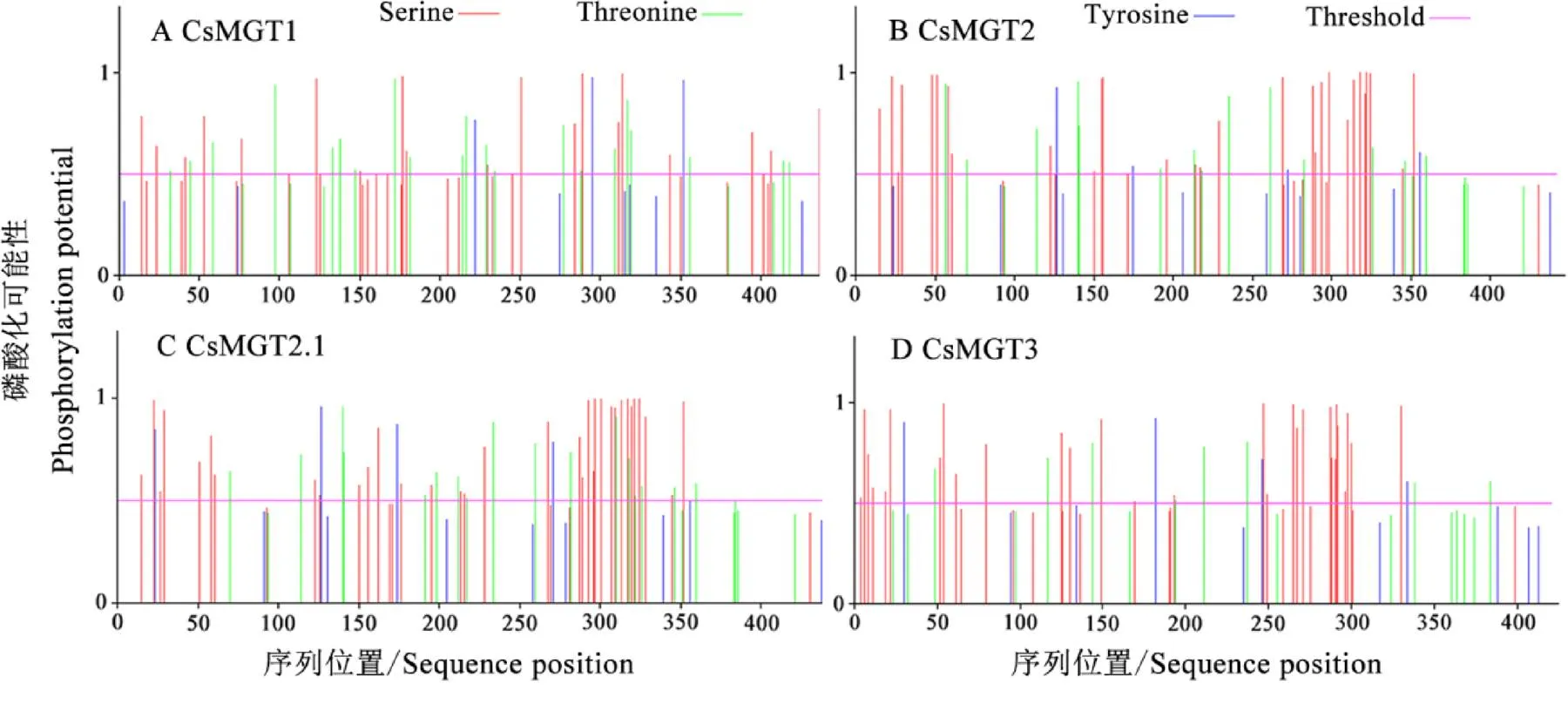
图3 茶树CsMGTs的磷酸化位点预测
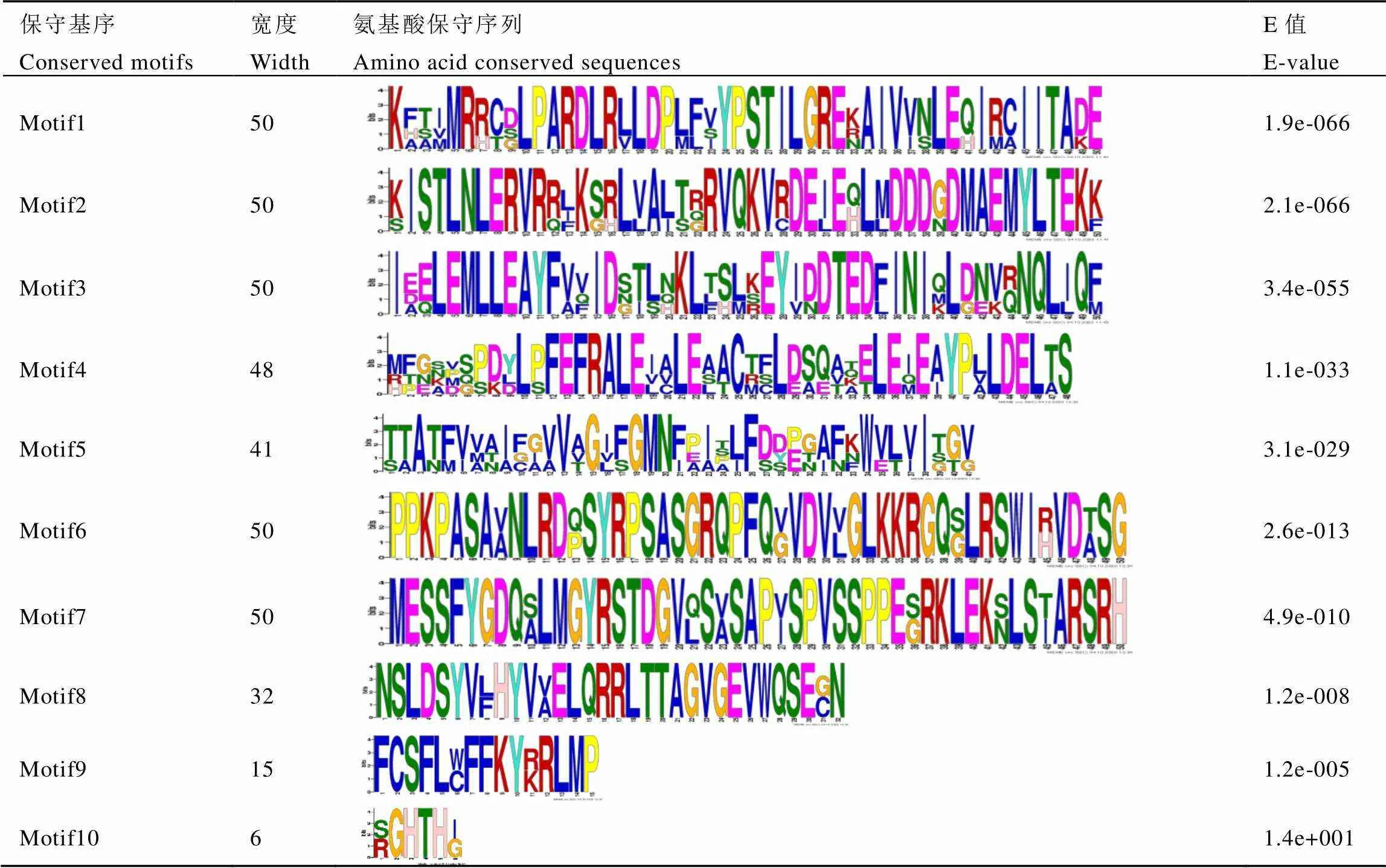
表4 茶树CsMGTs的蛋白保守序列
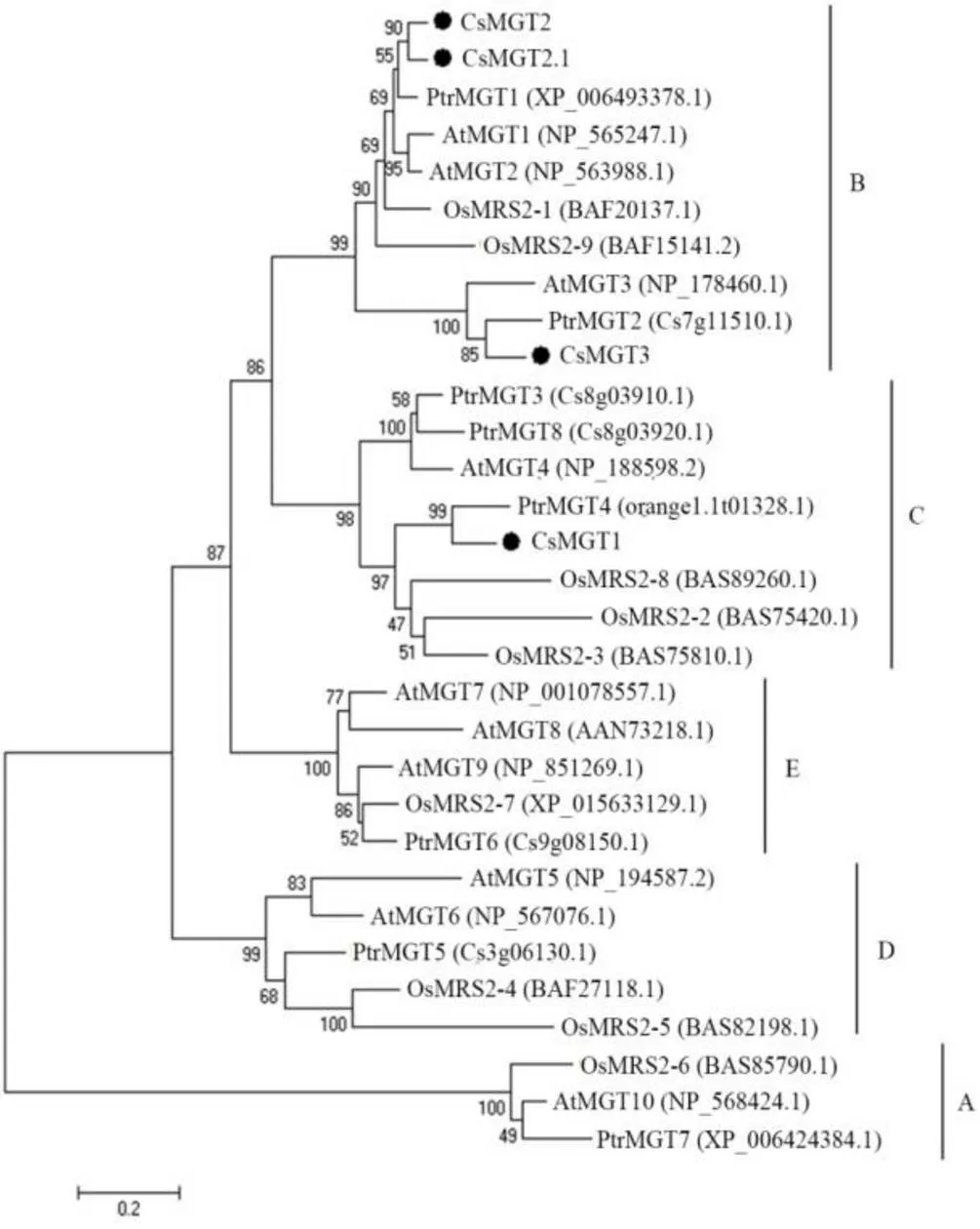
注:Cs:茶树;At:拟南芥;Os:水稻;Ptr:柑橘;A、B、C、D和E表示MRS2/MGT家族的5个分支
2.5 茶树CsMGTs基因的表达模式分析
2.5.1 组织表达模式
组织特异性表达分析表明,茶树、、和在根、茎、叶和花中均呈组成型表达。和均在茎中表达量最高,在花中表达量最低(图7-A,C);而和均在根中表达量最高,其次为茎和叶,在花中表达量最低(图7-B,D)。
2.5.2 不同浓度Mg2+处理下的表达分析
通过荧光定量PCR,分析了在0 mmol∙L-1Mg2+(缺镁)和2 mmol∙L-1Mg2+(高镁)处理下陕茶1号根和叶中、、和的表达情况(图8和图9)。结果表明,4个基因在根和叶中均响应不同浓度的Mg2+处理,但其表达量在不同处理时间下存在差异。在缺镁处理的根中,先上调后下调,在6 h急剧上升达到最大值,是0 h的4.51倍(图8-A);和则表现为波动的变化趋势,在2 h和24 h上调表达,而在6 h和24 h上调,在12 h和48 h下调(图8-B,C);在2 h达到峰值,是0 h的2.30倍(图8-D)。在高镁处理的根中,在2 h和48 h上调表达且达到峰值,分别是0 h的3.69倍和2.77倍(图8-A);呈现先下调后上调再下调的趋势,在24 h表达量最高(图8-B);和则总体表现为波动的变化趋势,分别在6 h和2 h达到最大值(图8-C,D)。在缺镁处理的叶中,、和呈下调的表达趋势(图9-A,C,D),而呈先下调后上调再下调的表达趋势,在24 h达到峰值,是0 h的1.23倍(图9-B)。在高镁处理的叶中,和先下调后上调(图9-A和9-D),而和呈现先下调再恢复到0 h水平的趋势(图9-B和9-C)。

注:蓝色直线区域代表跨膜区,红色方框区域代表保守的GMN基序

注:不同小写字母表示差异显著,P<0.05
2.6 茶树CsMGTs基因的MM281功能互补分析
鼠伤寒沙门氏菌突变体MM281因缺乏镁转运基因、和而没有Mg2+的摄取和转运能力,通常被用作Mg2+功能互补分析系统[11,17,26-27,47]。为了确定CsMGT1、CsMGT2、CsMGT2.1和CsMGT3的Mg2+转运能力,我们将其分别构建到pTrc99A载体上并转入MM281中进行功能互补分析。结果表明,在10 mmol∙L-1Mg2+培养基中,所有菌株均能正常生长。阴性对照MM281和转pTrc99A空载体的MM281在5 mmol∙L-1Mg2+培养基中生长不良,而阳性对照MM1927在0.01 mmol∙L-1Mg2+培养基中仍能生长正常。向MM281中转入后,突变株也能在0.01 mmol∙L-1Mg2+的培养基中生长,但其生长能力明显差于MM1927;而转的MM281最低只能在1 mmol∙L-1Mg2+的培养基上生长。另外,CsMGT2.1和CsMGT3的互补分析发现,转和的MM281的生长趋势比较一致,其生长能力均弱于转的MM281,和阴性对照类似(图10)。由此可见,CsMGT1的镁离子转运能力最强,其次为CsMGT2,而CsMGT2.1和CsMGT3的镁离子转运能力极弱,几乎没有互补功能。
为了进一步确认CsMGT1、CsMGT2、CsMGT2.1和CsMGT3的互补能力,本研究检测了7个菌株在0.01、0.5、1、10 mmol∙L-1Mg2+的液体培养基中24 h内的生长曲线,结果与平板试验一致(图11)。
3 讨论
植物MRS2/MGT蛋白具有高度保守的序列结构和进化保守性。跨膜区预测结果表明,CsMGT1、CsMGT2、CsMGT2.1和CsMGT3在C末端均含两个保守的跨膜结构区域,这与拟南芥[11, 48],水稻[14],梨[17],甘蔗[49],油菜[16]等植物的MRS2/MGT家族成员的研究结果一致。此外,这4个CsMGT蛋白均具有高度保守的GMN基序,这与拟南芥[11]、柑橘[18]的MRS2/MGT成员一致。系统发育分析的结果表明,MRS2/MGT家族成员被分为Clade A-E共5个分支,CsMGT1属于Clade C成员,而CsMGT2、CsMGT2.1和CsMGT3属于CladeB成员。同时,Blast分析表明CsMGT2和CsMGT2.1与AtMGT2的相似度高于AtMGT1,因此将其分别命名为CsMGT2和CsMGT2.1,由此证明CsMGT2和CsMGT2.1为并系同源序列。在Clade C中,CsMGT1由于在茶树对Al3+的响应方面[50]可能与水稻OsMRS2-2/OsMGT1对铝的耐受性[51]相同而得名。这些结果表明,CsMGT1、CsMGT2、CsMGT2.1和CsMGT3属于茶树MGT镁离子转运家族成员,与拟南芥、水稻、柑橘MRS2/MGT家族成员表现出高度的进化保守性,可能行使茶树体内的Mg2+运输功能。
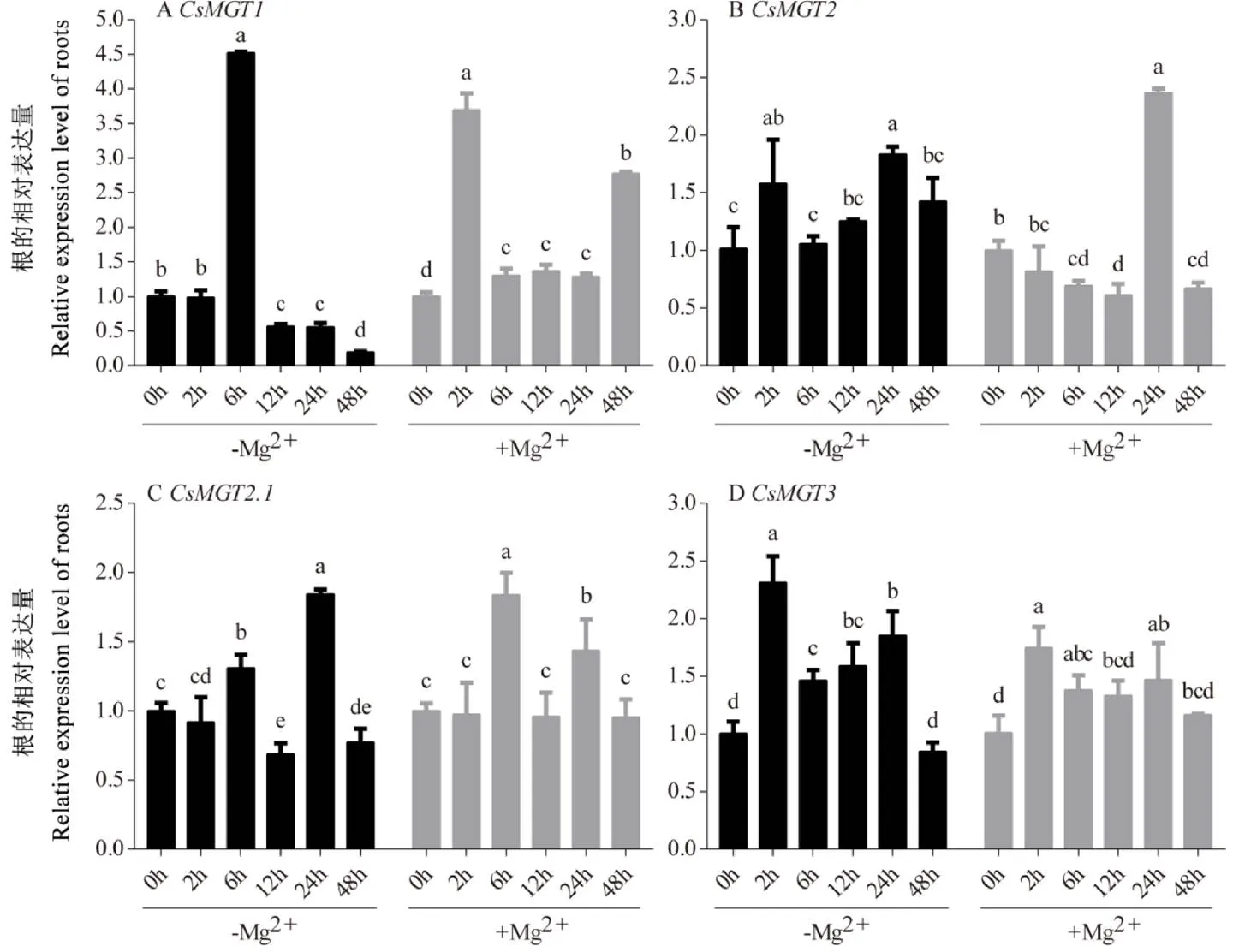
注:–Mg:0 mmol∙L-1 Mg2+处理;+Mg:2 mmol∙L-1 Mg2+处理。不同小写字母表示处理间差异显著,P<0.05。下同
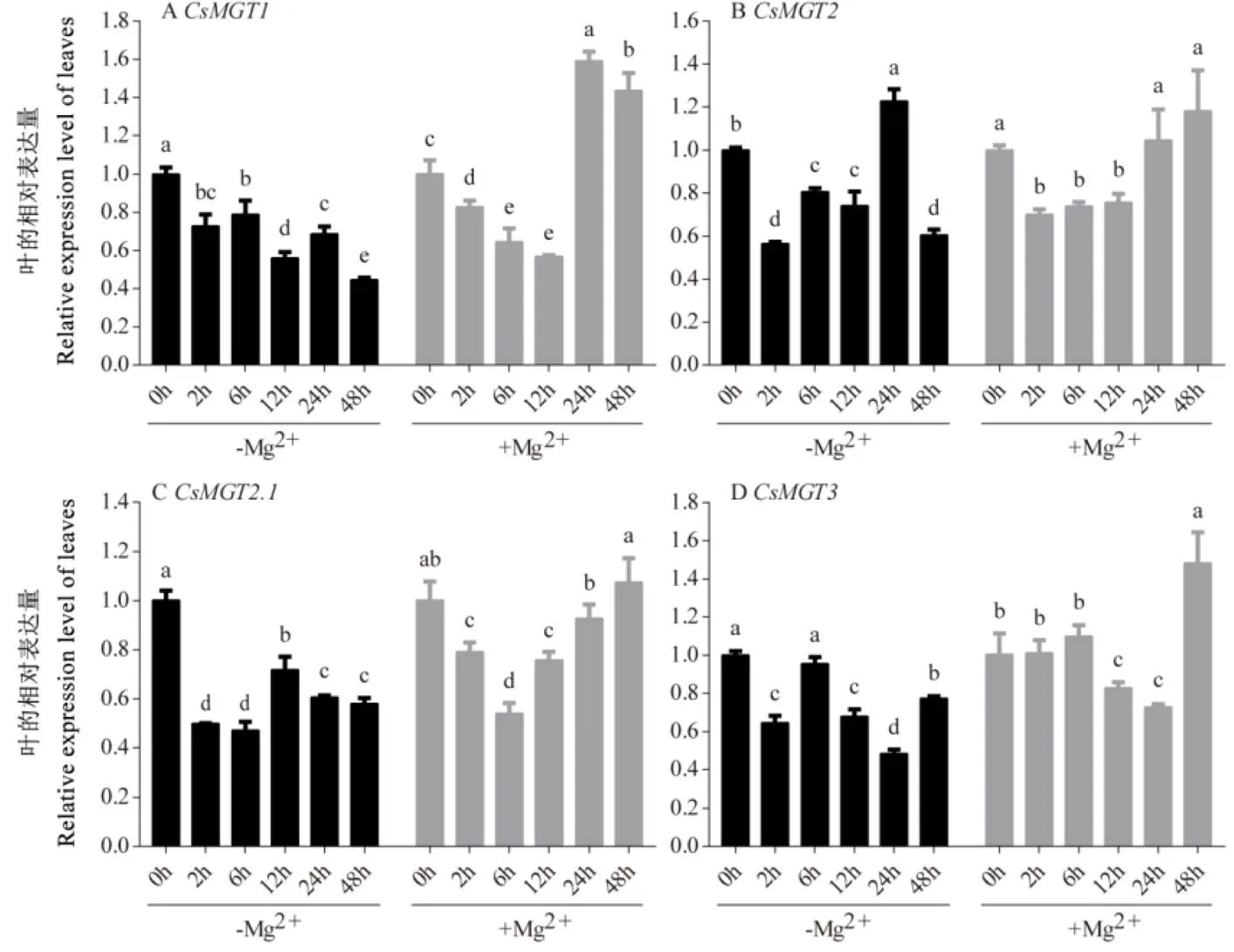
图9 Mg2+处理下茶树CsMGTs在叶中的表达分析

注:每排菌株从左到右依次稀释10倍
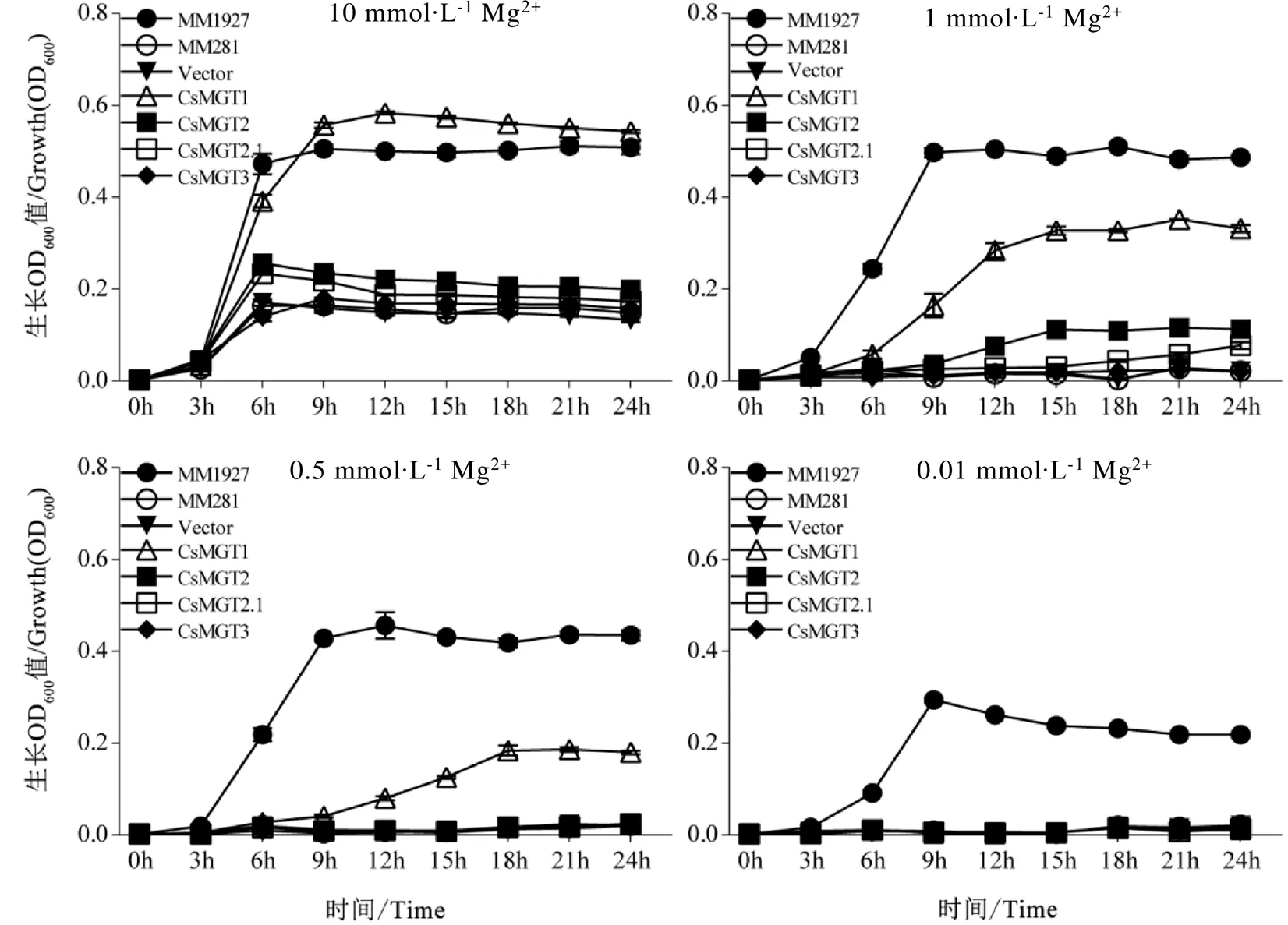
图11 CsMGTs在液体培养基上的MM281功能互补分析
已有的研究表明,植物基因具有明显的组织表达模式。水稻、柑橘和几乎所有的拟南芥基因(除外)在研究的组织中均呈组成型表达[11,14,18]。然而,玉米在根中特异表达,而Clade C成员和在被检测的组织[15]中均未表达,这说明基因是否呈组成型表达在不同物种中存在差异。在柑橘中,与亲缘关系最近的在根中表达量最高,其次为茎,在果实中表达量最低;与和同源的在茎和叶中表达量最高,在花中表达量最低;而与亲缘关系最近的在根和叶中表达量最高,在花和果实中表达量最低[18]。本研究结果显示、、和也呈组成型表达,它们均在花中表达量最低,在茎或根中表达量最高。研究表明茶树、、和在生长发育过程中起着不同的作用,同一个基因在不同物种的生长发育过程中也可能行使不同的功能,相似的研究结果在甘蔗[49]和油菜[16]等植物中也被证明。
成员在植物中还参与了对环境中Mg2+的响应。玉米Clade B成员在缺镁12 h的新梢中被显著诱导,而Clade C成员和在缺镁6 h和24 h的根中上调表达[15]。在柑橘中,Clade B成员在缺镁处理24 h的根中呈上调表达而在叶中无显著变化,而在缺镁处理的根和叶中均无明显变化;Clade C成员在缺镁处理的根中持续上调表达,而在叶中无显著改变[18]。在缺镁条件下,水稻在叶片和叶鞘中显著上调表达,在缺镁的5~7 d其表达量在新梢中急剧升高,显著高于0~4 d处理,进一步研究发现其增强了水稻的缺镁耐受性[52]。本研究中,在缺镁处理的6 h根中显著上调,在叶中则呈下调表达;而在高镁处理2 h的根中急剧上调,在叶中先下调后上调。和在缺镁处理和高镁处理的根中波动变化,在缺镁处理的叶中下调,而在高镁处理的叶中和呈现先下调再恢复到初始水平的趋势。随着处理时间延长在缺镁处理的根中先上调后恢复到0 h水平,在高镁处理的根和叶中总体呈波动趋势,而在缺镁处理的叶中呈下调的趋势(图8和图9)。这些结果表明,、、和响应环境Mg2+胁迫,可能在茶树中行使Mg2+的吸收和转运功能。
通过镁转运功能缺失的鼠伤寒沙门氏菌突变体MM281互补分析也证明了MRS2/MGT的Mg2+转运功能。在拟南芥中,MM281互补试验表明AtMGT1和AtMGT10为高亲和蛋白[11,53],AtMGT6、AtMGT7和AtMGT9为低亲和蛋白[9,27,47],而AtMGT5为双功能蛋白[26]。在玉米中,Clade B成员ZmMGT1和Clade C成员ZmMGT8均显示明显的MM281功能互补,均能在0.1 mmol∙L-1Mg2+的培养基上生长,但ZmMGT1的互补功能明显优于ZmMGT8,表明它们拥有Mg2+的吸收转运功能[15],这与梨[17]、甘蔗[49]和油菜[16]的试验结果一致。本研究结果表明,CsMGT1的MM281互补能力高于CsMGT2,且转的MM281能在0.01 mmol∙L-1Mg2+的培养基中生长,而CsMGT2.1和CsMGT3的镁离子转运能力极弱,几乎不能互补MM281的镁离子转运功能,这表明CsMGT1可能是茶树中的高亲和Mg2+转运蛋白,而CsMGT2是低亲和Mg2+转运蛋白。
玉米、和柑橘、在铝胁迫的根中均不同程度的上调表达,而则呈现下调趋势[15,18]。在拟南芥中,过表达本氏烟草后提高了植株的耐铝性[21]。水稻根中也受铝胁迫和NaCl胁迫的诱导,并提高了水稻的耐铝性和耐盐性[51,54]。这些结果表明植物基因不仅响应环境Mg2+水平,也受铝离子和NaCl胁迫因子的诱导,会增强植物的耐逆性。本研究初步解析了茶树MRS2/MGT家族、、和的组织表达模式和对Mg2+的响应情况,明确了其在MM281中的Mg2+转运能力,为阐明茶树基因响应环境中Mg2+营养水平进而通过镁转运功能实现对Mg2+的利用奠定了前期基础。另外,茶树CsMGT1、CsMGT2、CsMGT2.1和CsMGT3是否像其他植物一样能够增强植物的耐铝性和耐盐性,仍需深入研究。
[1] Williams L, Salt D E. The plant ionome coming into focus [J]. Current Opinion in Plant Biology, 2009, 12(3): 247-249.
[2] Guo W, Nazim H, Liang Z, et al. Magnesium deficiency in plants: an urgent problem [J]. The Crop Journal, 2016, 4(2): 83-91.
[3] Tatagiba S D, Damatta F M, Rodrigues F A. Magnesium decreases leaf scald symptoms on rice leaves and preserves their photosynthetic performance [J]. Plant Physiology and Biochemistry, 2016, 108: 49-56.
[4] Shen J, Song L, Muller K, et al. Magnesium alleviates adverse effects of lead on growth, photosynthesis, and ultrastructural alterations ofseedlings [J]. Frontiers in Plant Science, 2016, 7: 1-11.
[5] Hermans C, Chen J, Coppens F, et al. Low magnesium status in plants enhances tolerance to cadmium exposure [J]. New Phytologist, 2011, 192(2): 428-436.
[6] Jezek M, Geilfus C M, Bayer A, et al. Photosynthetic capacity, nutrient status, and growth of maize (L.) upon MgSO4leaf-application [J]. Frontiers in Plant Science, 2015, 5: 1-10.
[7] Koch M, Busse M, Naumann M, et al. Differential effects of varied potassium and magnesium nutrition on production and partitioning of photoassimilates in potato plants [J]. Physiologia Plantarum, 2019, 166(4): 921-935.
[8] Kwon M C, Kim Y X, Lee S, et al. Comparative metabolomics unravel the effect of magnesium oversupply on tomato fruit quality and associated plant metabolism [J]. Metabolites, 2019, 9: 1-13.
[9] Mao D, Chen J, Tian L, et al. Arabidopsis transporter MGT6 mediates magnesium uptake and is required for growth under magnesium limitation [J]. Plant Cell, 2014, 26(5): 2234-2248.
[10] Smith R L, Banks J L, Snavely M D, et al. Sequence and topology of the CorA magnesium transport systems ofand. Identification of a new class of transport protein [J]. Journal of Biological Chemistry, 1993, 268(19): 14071-14080.
[11] Li L, Tutone A F, Drummond R S M, et al. A novel family of magnesium transport genes in[J]. Plant Cell, 2001, 13(12): 2761-2775.
[12] Lunin V V, Dobrovetsky E, Khutoreskaya G, et al. Crystal structure of the CorA Mg2+transporter [J]. Nature, 2006, 440(7085): 833-837.
[13] 丛悦玺, 骆东峰, 陈坤明, 等. 生物镁离子转运体研究进展 [J]. 农业生物技术学报, 2012, 20(7): 837-848.
Cong Y X, Luo D F, Chen K M, et al. The development of magnesium transport systems in organisms [J]. Journal of Agricultural Biotechnology, 2012, 20(7): 837-848.
[14] Saito T, Kobayashi N I, Tanoi K, et al. Expression and functional analysis of the CorA-MRS2-ALR-type magnesium transporter family in rice [J]. Plant and Cell Physiology, 2013, 54(10): 1673-1683.
[15] Li H, Du H, Huang K, et al. Identification, and functional and expression analyses of the CorA/MRS2/MGT-type magnesium transporter family in maize [J]. Plant and Cell Physiology, 2016, 57(6): 1153-1168.
[16] Zhang L, Wen A, Wu X, et al. Molecular identification of the magnesium transport gene family in[J]. Plant Physiology and Biochemistry, 2019, 136: 204-214.
[17] Zhao Z, Wang P, Jiao H, et al. Phylogenetic and expression analysis of the magnesium transporter family in pear, and functional verification of PbrMGT7 in pear pollen [J]. The Journal of Horticultural Science and Biotechnology, 2017, 93(1): 51-63.
[18] Liu X, Guo L X, Luo L J, et al. Identification of the magnesium transport (MGT) family inand functional characterization of PtrMGT5 in magnesium deficiency stress [J]. Plant Molecular Biology, 2019, 101: 551-560.
[19] 阳江华, 秦云霞, 方永军, 等. 巴西橡胶树镁离子转运蛋白基因HbMGT10的克隆及表达分析[J]. 热带作物学报, 2016, 37(12): 2353-2358.
Yang J H, Qin Y X, Fang Y J, et al. Molecular cloning and expression analysis of HbMGT10 from[J]. Chinese Journal of Tropical Crops, 2016, 37(12): 2353-2358.
[20] 张岗, 翟清华, 张大为, 等. 铁皮石斛镁离子转运蛋白基因的克隆及表达分析[J]. 中草药, 2014, 45(23): 3443-3448.
Zhang G, Zhai Q H, Zhang D W, et al. Cloning and expression analysis of a magnesium transporter gene in[J]. Chinese Traditional and Herbal Drugs, 2014, 45(23): 3443-3448.
[21] Deng W, Luo K, Li D, et al. Overexpression of anmagnesium transport gene,, inconfers Al tolerance [J]. Journal of Experimental Botany, 2006, 57(15): 4235-4243.
[22] Ishijima S, Uda M, Hirata T, et al. Magnesium uptake oftransporters,and, expressed inmutants: Complementation and growth inhibition by aluminum [J]. Biochimica et Biophysica Acta, 2015, 1848(6): 1376-1382.
[23] Yan Y W, Mao D D, Yang L, et al. Magnesium transporter MGT6 plays an essential role in maintaining magnesium homeostasis and regulating high magnesium tolerance in[J]. Frontiers in Plant Science, 2018, 9: 1-13.
[24] Conn S J, Conn V, Tyerman S D, et al. Magnesium transporters, MGT2/MRS2-1 and MGT3/MRS2-5, are important for magnesium partitioning withinmesophyll vacuoles [J]. New Phytologist, 2011, 190(3): 583-594.
[25] Li J, Huang Y, Tan H, et al. An endoplasmic reticulum magnesium transporter is essential for pollen development in[J]. Plant Science, 2015, 231: 212-220.
[26] Li L G, Sokolov L N, Yang Y H, et al. A mitochondrial magnesium transporter functions inpollen development [J]. Molecular Plant, 2008, 1(4): 675-685.
[27] Chen J, Li L G, Liu Z H, et al. Magnesium transporter AtMGT9 is essential for pollen development in[J]. Cell Research, 2009, 19(7): 887-898.
[28] Gebert M, Meschenmoser K, Svidova S, et al. A root-expressed magnesium transporter of the MRS2/MGT gene family inallows for growth in low-Mg2+environments [J]. Plant Cell, 2009, 21(12): 4018-4030.
[29] 马春丽, 和硕特麦丽斯, 祁智, 等. 镁转运体MGT7参与拟南芥对高钙环境的适应[J]. 植物学报, 2016, 51(4): 496-503.
Ma C L, HeShuote M, Qi Z, et al. Mg2+transporter MGT7 mediatesadapting to high calcium environment [J]. Chinese Bulletin of Botany, 2016, 51(4): 496-503.
[30] Sun Y, Yang R, Li L, et al. The magnesium transporter MGT10 is essential for chloroplast development and photosynthesis in[J]. Molecular Plant, 2017, 10(12): 1584-1587.
[31] Drummond R S M, Tutone A, Li Y C, et al. A putative magnesium transporter AtMRS2-11 is localized to the plant chloroplast envelope membrane system [J]. Plant Science, 2006, 170(1): 78-89.
[32] Liang S, Qi Y, Zhao J, et al. Mutations in the Arabidopsisgene cause leaf reticulation [J]. Frontiers in Plant Science, 2017, 8: 1-12.
[33] Li H, Wang N, Ding J, et al. The maize CorA/MRS2/MGT-type Mg transporter, ZmMGT10, responses to magnesium deficiency and confers low magnesium tolerance in transgenic[J]. Plant Molecular Biology, 2017, 95(3): 269-278.
[34] 侯玲利, 陈磊, 郭雅玲, 等. 福建省铁观音茶园土壤镁素状况研究[J]. 植物营养与肥料学报, 2009, 15(1): 133-138.
Hou L L, Chen L, Guo Y L, et al. Study on soil magnesium in the Tieguanyin tea plantations of Fujian province [J]. Plant Nutrition and Fertilizer Science, 2009, 15(1): 133-138.
[35] 潘住财. 施用硼镁肥对红壤茶园茶叶产量、品质及土壤肥力的影响[J]. 福建农业学报, 2015, 30(9): 877-883.
Pan Z C. Effect of boron and magnesium fertilization on tea yield, quality and soil fertility of red-soil tea plantations [J]. Fujian Journal of Agricultural Sciences, 2015, 30(9): 877-883.
[36] 田景涛, 陈玲, 徐代华, 等. 贵州铜仁茶园土壤钙、镁、硫含量调查分析[J]. 黑龙江农业科学, 2018(2): 47-52.
Tian J T, Chen L, Xu D H, et al. Investigation and analysis on content of calcium, magnesium and sulfur in tea garden soil of Guizhou tongren [J]. Heilongjiang Agricultural Sciences, 2018(2): 47-52.
[37] 朱永兴, 陈福兴. 红壤丘陵茶园镁营养调控研究[J]. 茶叶科学, 2003, 23(s1): 34-37.
Zhu Y X, Chen F X. Improvement of magnesium nutrition for tea gardens on hilly red soil in the southern Hunan Province [J]. Journal of Tea Science, 2003, 23(s1): 34-37.
[38] 阮建云, 吴洵. 钾、镁营养供应对茶叶品质和产量的影响[J]. 茶叶科学, 2003, 23(s1): 21-26.
Ruan J Y, Wu X. Productivity and quality response of tea to balanced nutrient management including K and Mg [J]. Journal of Tea Science, 2003, 23(s1): 21-26.
[39] 阮建云, 管彦良, 吴洵. 茶园土壤镁供应状况及镁肥施用效果研究[J]. 中国农业科学, 2002, 35(7): 815-820.
Ruan J Y, Guan Y L, Wu X. Status of Mg availability and the effects of Mg application in tea fields of red soil area in China [J]. Scientia Agricultura Sinica, 2002, 35(7): 815-820.
[40] 阮建云, 吴洵, Hardter R. 钾和镁对乌龙茶产量和品质的影响[J]. 茶叶科学, 1997, 17(1): 11-15.
Ruan J Y, Wu X, Hardter R. Effects of potassium and magnesium on the yield and quality of Oolong tea [J]. Journal of Tea Science, 1997, 17(1): 11-15.
[41] 伊晓云, 马立锋, 石元值, 等. 茶叶专用肥减肥增产增收效果研究[J]. 中国茶叶, 2017, 39(4): 26-27.
Yi X Y, Ma L F, Shi Y Z, et al. Study on effect of tea special fertilizer on reducing weight, increasing yield and income [J]. China Tea, 2017, 39(4): 26-27.
[42] 阮建云, 马立锋, 伊晓云, 等. 茶树养分综合管理与减肥增效技术研究[J]. 茶叶科学, 2020, 40(1): 85-95.
Ruan J Y, Ma L F, Yi X Y, et al. Integrated nutrient management in tea plantation to reduce chemical fertilizer and increase nutrient use efficiency [J]. Journal of Tea Science, 2020, 40(1): 85-95.
[43] Konishi S, Miyamoto S, Taki T. Stimulatory effects of aluminum on tea plants grown under low and high phosphorus supply [J]. Soil Science and Plant nutrition, 1985, 31(3): 361-368.
[44] Xia E H, Zhang H B, Sheng J, et al. The tea tree genome provides insights into tea flavor and independent evolution of caffeine biosynthesis [J]. Molecular Plant, 2017, 10(6): 866-877.
[45] Wang X, Feng H, Chang Y, et al. Population sequencing enhances understanding of tea plant evolution [J]. Nature Communications, 2020, 11: 1-10.
[46] Wei C, Yang H, Wang S, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(18): E4151-E4158.
[47] Mao D D, Tian L F, Li L G, et al.: angene encoding a low-affinity magnesium transporter [J]. Journal of Integrative Plant Biology, 2008, 50(12): 1530-1538.
[48] Schock I, Gregan J, Steinhauser S, et al. A member of a novelgene family of candidate Mg2+ion transporters complements a yeast mitochondrial group II intron-splicing mutant [J]. Plant Journal, 2000, 24(4): 489-501.
[49] Wang Y, Hua X, Xu J, et al. Comparative genomics revealed the gene evolution and functional divergence of magnesium transporter families in[J]. BMC Genomics, 2019, 20(1): 1-18.
[50] Li Y, Huang J, Song X, et al. An RNA-Seq transcriptome analysis revealing novel insights into aluminum tolerance and accumulation in tea plant [J]. Planta, 2017, 246(1): 91-103.
[51] Chen Z C, Yamaji N, Motoyama R, et al. Up-regulation of a magnesium transporter geneis required for conferring aluminum tolerance in rice [J]. Plant Physiology, 2012, 159(4): 1624-1633.
[52] Zhang L, Peng Y, Li J, et al. OsMGT1 confers resistance to magnesium deficiency by enhancing the import of Mg in rice [J]. International Journal of Molecular Sciences, 2019, 20(1): 1-13.
[53] Zhang C, Li H, Wang J, et al. The rice high-affinity K+transporter OsHKT2;4 mediates Mg2+homeostasis under high-Mg2+conditions in transgenic[J]. Frontiers in Plant Science, 2017, 8: 1-13.
[54] Chen Z C, Yamaji N, Horie T, et al. A magnesium transporter OsMGT1 plays a critical role in salt tolerance in rice [J]. Plant Physiology, 2017, 174(3): 1837-1849.
Cloning and Magnesium Transport Function Analysis ofGenes in Tea Plants ()
TANG Lei, XIAO Luodan, HUANG Yifan, XIAO Bin, GONG Chunmei*
College of Horticulture, Northwest Agriculture and Forestry University, Yangling 712100, China
Magnesium (Mg2+), as the central atom of chlorophyll, is the most abundant divalent cation in plant cells. Magnesium is also an activator of various enzymes, especially theanine synthase, whose activity depends on Mg2+concentration and is often used as a characteristic component of special fertilizer for tea plants. Therefore, it is very important for both the growth and development of tea plants and the formation of tea quality. The MRS2/MGT magnesium transporter family plays an important role in maintaining the absorption and transport of Mg2+, intracellular balance and stress tolerance in plants. In order to explore the functions of themagnesium transport genes in tea plants, this study cloned fourmagnesium transporter genes (namely,,and, respectively) from tea cultivar ‘Shaancha 1’. Bioinformatics analysis shows that the four proteins all contain two transmembrane domains and a conserved GMN tripeptide motif at the C-terminal. Phylogenetic analysis shows that CsMGT1 is a member of Clade C, while CsMGT2, CsMGT2.1 and CsMGT3 belong to Clade B, and the four encoded proteins are most closely related to the woodyMGT family. Real-time fluorescence quantitative PCR (RT-qPCR) shows that,,andwere constitutively expressed in the roots, stems, leaves and flowers of tea plants, and the roots and leaves all showed different degrees of response to Mg2+. Functional complementation tests in a magnesium deletion mutant strain MM281 ofshow that both CsMGT1 and CsMGT2 possessed Mg2+transport function, and the Mg2+transport function of CsMGT1 was superior to that of CsMGT2, while CsMGT2.1 and CsMGT3 had almost no Mg2+transport function. The results of this study enriched the biological functions of tea plant CsMGTs family, and laid a foundation for further utilization of magnesium through magnesium transporters in tea plants.
tea plant, MRS2/MGT, gene cloning, expression pattern, function analysis
S571.1;Q946.91+2
A
1000-369X(2021)06-761-16
2020-12-07
2021-05-05
陕西省重点研发计划项目(2020NY-190)
唐磊,男,博士研究生,主要从事茶树生理与分子生物学研究,1938170872@qq.com。*通信作者:gcm228@nwafu.edu.cn
(责任编辑:赵锋)

