茶黄素-3,3'-O-双没食子酸酯对糖尿病大鼠血管内皮损伤及炎症反应的保护作用
邓志慧,曾洁,付红娟,常徽
茶黄素-3,3'--双没食子酸酯对糖尿病大鼠血管内皮损伤及炎症反应的保护作用
邓志慧,曾洁,付红娟,常徽*
西南大学食品科学学院,重庆 400715
探讨茶黄素-3,3'--双没食子酸酯(TFDG)对糖尿病大鼠血管内皮损伤及炎症反应的保护作用及相关机制。以高脂饲料喂养加链脲佐菌素注射制造糖尿病大鼠,将其分为模型组(CON)、5 mg·kg-1和10 mg·kg-1TFDG干预组(TFDG5和TFDG10),另取正常大鼠为对照组(NC),分组处理8周,监测体重和空腹血糖变化,观察大鼠腹主动脉病理形态学变化,ELISA检测血浆IL-6、IL-1和TNF-水平,Western blot检测蛋白表达水平。结果表明,与CON组相比,TFDG干预对体重和血糖无显著影响,病理切片观察显示TFDG干预组大鼠腹主动脉组织损伤较CON组有所改善,同时TFDG干预组大鼠血浆炎症因子水平显著降低,血浆NO水平显著升高,腹主动脉组织MDA水平降低。进一步研究显示,TFDG下调了糖尿病大鼠腹主动脉组织NLRP3、caspase-1和IL-1的表达,抑制NLRP3炎症通路激活。TFDG能够有效保护糖尿病大鼠血管内皮损伤并抑制炎症反应,其机制可能是通过下调NLRP3炎症通路实现的。
茶黄素;糖尿病;血管内皮损伤;炎症反应
糖尿病是危害人类健康的常见疾病,随着居民生活水平的提高,国民饮食结构逐渐向“高糖、高脂、高能量”转变,同时机械化和自动化的普及,体力劳动减少,人们的活动量大大降低,由此导致超重、肥胖人群不断扩大,而与之密切相关的疾病包括糖尿病,其发病率和发病人数不断上升。据统计,中国已成为全球糖尿病第一大国,成人糖尿病患病率为12.8%,成人糖尿病前期比例为35.2%,糖尿病患者总人数估计为1.298亿,居世界首位[1]。糖尿病并发症可累及人体眼、肾、神经、血管等多种器官,导致其功能不全甚至衰竭[2],其中2型糖尿病多伴有心血管并发症,严重影响病人的治疗及预后。众所周知,高血糖会诱发血管病变,目前心血管病死亡率居我国居民疾病总死亡原因首位,如何有效减轻高血糖对血管组织造成的损害是重要的研究课题。
红茶是国际市场消费的主要茶类[3]。红茶在发酵制作过程中会产生特征性成分茶黄素(Theaflavin,TF),其含量约占干重的0.3%~1.5%[4],目前已从红茶中分离鉴定出20多种TF类化合物(TFs),其中主要有茶黄素(TF1)、茶黄素-3--没食子酸酯(Theaflavin-3--gallate,TF2A)、茶黄素-3'--没食子酸酯(Theaflavin-3'--gallate,TF2B)以及茶黄素-3,3'--双没食子酸酯(Theaflavin-3,3'--digallate,TFDG)等4种,约占总茶黄素的96%[5]。研究显示,TFs不仅赋予红茶独特的感官品质,更具有抗氧化、抗肿瘤、抗炎等生物活性功能[6-7],其中尤以TFDG最为显著。本课题前期研究发现,TF1可减轻H2O2诱导的血管内皮细胞氧化应激损伤,保护血管内皮细胞。TFs对糖尿病诱发的血管损伤是否具有保护效应,尚未见报道。本研究构建体内和体外试验模型,观察TFDG对糖尿病大鼠血管损伤和高糖条件下内皮细胞损伤及炎症反应的影响,并探讨相关作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂
TFDG(纯度98%)购自南京草本源生物科技有限公司,用DMSO溶解–20℃避光分装保存备用。链脲佐菌素(STZ)、二甲基亚砜(DMSO)购自Sigma公司。一氧化氮(NO)和丙二醛(MDA)检测试剂盒均购自南京建成生物工程研究所。蛋白抽提试剂盒、BCA蛋白含量测定试剂盒、兔抗鼠单克隆抗体(一抗)NLRP3(含NLR家族Pyrin域蛋白3)、caspase-1(半胱氨酸-天冬氨酸蛋白酶1)、IL-1(白细胞介素-1)、-actin(肌动蛋白)、辣根过氧化物酶标记山羊抗兔IgG(二抗)、DAB显色试剂盒、IL-6(白细胞介素-6)、IL-1和TNF-(肿瘤坏死因子-)ELISA检测试剂盒均购自上海碧云天生物技术研究所。一抗cleaved-caspase-1(裂解半胱氨酸-天冬氨酸蛋白酶1)和cleaved-IL-1(裂解白细胞介素-1)购自Cell Signaling公司。
1.1.2 实验动物
6周龄雄性SPF级SD大鼠50只,体质量160~200 g,购自北京华阜康生物科技股份有限公司[SCXK (京) 2019-0008]。实验动物饲养和操作均遵照西南大学实验动物福利伦理规范进行,昼夜光照节律,自由饮水,水质为Ⅲ级水,每周更换3次垫料,定期对笼具及水瓶进行消毒。本研究所用SD大鼠已经过西南大学实验动物伦理审查委员会批准。
1.1.3 动物饲料
普通饲料由北京华阜康生物科技股份有限公司提供,具体配方:玉米淀粉、麦芽糖糊精、奶粉、玉米油、无水奶油、纤维素、酪蛋白、蛋氨酸、矿物质混合物、维生素混合物。蛋白质含量约22%,总脂肪含量约5%,水分含量约9%,粗纤维含量约2%。高糖高脂饲料:对普通饲料添加20%蔗糖和10%猪油。
1.2 试验方法
1.2.1 构建糖尿病大鼠模型
50只SD大鼠适应性喂养3 d后,随机取10只作为正常对照组(NC),其余40只用于构建实验模型(高糖高脂组)。NC组喂食普通饲料,高糖高脂组喂食高糖高脂饲料,喂食4周后,除NC组外给予STZ(40 mg·kg-1)腹腔注射,注射前夜禁食不禁水12 h以上,STZ以0.1 mol·L-1柠檬酸钠缓冲液配制成1% STZ溶液用于注射。注射后第三天和第五天检测血糖,以两次检测随机血糖值均>16.7 mmol·L-1或空腹血糖值均>11.1 mmol·L-1为造模成功的标准。
1.2.2 动物分组及处理
取30只造模成功的大鼠,随机分为3组:模型组(CON)、5 mg·kg-1TFDG干预组(TFDG5)和10 mg·kg-1TFDG干预组(TFDG10),每组10只。NC组继续喂食普通饲料,其余3组继续喂食高糖高脂饲料,TFDG5组和TFDG10组分别按照5 mg·kg-1和10 mg·kg-1剂量灌胃TFDG溶液,NC组和CON组灌胃等量生理盐水,分组处理8周后,处死大鼠,腹主动脉取血,置于肝素抗凝管中,静置2 h后,3 000 r·min-1离20 min,取血浆置–80℃冰箱备用。
1.2.3 体质量和空腹血糖测定
大鼠体质量和空腹血糖每周测定1次,测定前大鼠需禁食12 h,但不禁饮水。测定时间为10:00,先用电子秤称量大鼠体质量,然后在大鼠尾静脉处穿刺取血,浸润血糖检测试纸,以快速血糖仪测定空腹血糖值,大鼠测定完成后恢复自由饮食。
1.2.4 动脉病理学观察
剪取大鼠腹主动脉组织,于4%多聚甲醛中固定,常规石蜡包埋、切片、脱蜡脱水;Harris苏木素染色,去离子水洗,分化液分化,伊红染色,自来水冲洗浸泡;脱水、透明、风干,中性树脂封片,显微镜下观察血管病理形态学变化。
1.2.5 大鼠血浆NO和炎症因子水平测定
取各组大鼠血浆,严格依照试剂盒说明书测定NO含量和炎症因子IL-6、IL-1和TNF-水平。
1.2.6 Western blot检测蛋白表达水平
取腹主动脉组织样本,利用RIPA裂解液提取总蛋白,采用BCA法进行蛋白浓度测定;根据蛋白浓度,以12%分离胶、5%浓缩胶SDS-PAGE电泳,上样量为20 μL。用半干性转膜法将蛋白转移至PVDF膜上。5%的脱脂奶粉(TBST配制)封闭2 h。加入一抗NLRP3、caspase-1、cleaved-caspase-1、IL-1、cleaved-IL-1和-actin(均1∶1 000稀释),4℃孵育过夜,TBST振摇洗膜3次,每次10 min,然后加入辣根过氧化酶标记的二抗(1∶2 000),室温振荡孵育1 h,再以TBST振摇洗膜3次后,DAB显色,采用VILBER FUSION FX7成像系统自动曝光。利用Quantity One软件进行条带分析。
1.2.7 统计分析
2 结果与分析
2.1 TFDG膳食干预对糖尿病大鼠体重和血糖的影响
对大鼠体重的监测数据(表1和表2)表明,造模前高糖高脂组大鼠体重高于NC组,但两组间未出现显著性差异;造模后,CON、TFDG5和TFDG10组糖尿病大鼠体重均出现逐渐下降状况,且分别在造模后第四、第四和第六周显著低于NC组。大鼠空腹血糖浓度监测数据表明,造模前高糖高脂组大鼠空腹血糖浓度与NC组相比无显著性差异,造模后CON、TFDG5和TFDG10组糖尿病大鼠血糖浓度显著升高,显著高于NC组;TFDG5和TFDG10组血糖略低于CON组,但3组间无显著性差异。
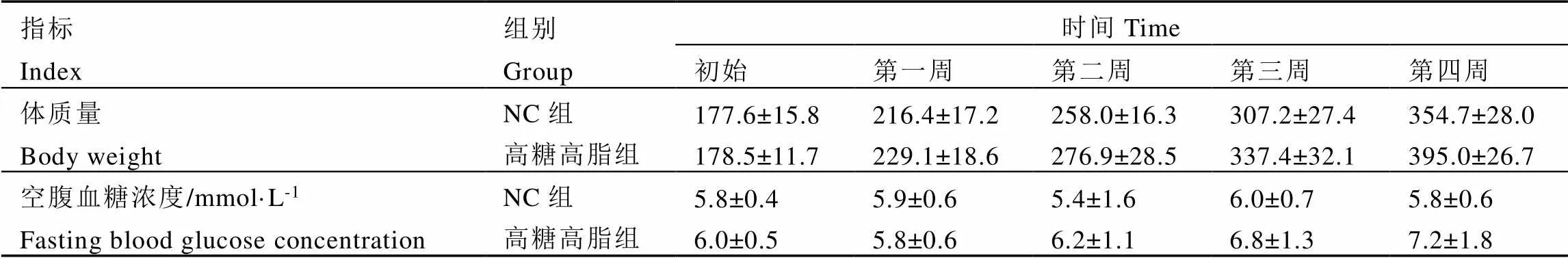
表1 造模前大鼠体重和空腹血糖浓度变化

表2 造模后各组大鼠体重和空腹血糖浓度变化
注:*<0.05,与NC组比较;**<0.01,与NC组比较
Note: *<0.05, compared with NC group. **<0.01, compared with NC group
2.2 TFDG膳食干预对糖尿病大鼠腹主动脉形态的影响
图1中腹主动脉组织切片HE染色结果显示,NC组大鼠腹主动脉内膜光滑平坦,内皮细胞排列整齐,无断裂;CON组大鼠腹主动脉内膜不平整,内皮细胞肿胀脱落,且有炎性细胞附着,排列紊乱,血管平滑肌肥大,中膜厚度增加;与CON组比较,TFDG5和TFDG10组大鼠腹主动脉病理损伤程度有所改善。
2.3 TFDG对糖尿病大鼠血浆炎症因子水平的影响
图2中炎症因子水平检测结果显示,相比于NC组,CON组大鼠血浆中IL-6、IL-1和TNF-水平均显著升高;与CON组相比,TFDG5和TFDG10组大鼠血浆中IL-6、IL-1和TNF-水平均显著降低,表明TFDG膳食干预可有效降低糖尿病大鼠炎症反应。
2.4 TFDG对糖尿病大鼠血浆NO和腹主动脉组织MDA的影响
血浆NO水平检测结果显示(图3-A),与NC组相比,CON组糖尿病大鼠血浆中NO的水平显著降低;相较于CON组,TFDG5和TFDG10组大鼠血浆中NO的水平显著提高。腹主动脉组织MDA水平检测结果显示,CON组大鼠腹主动脉组织中过氧化产物MDA水平较高,TFDG干预组MDA水平显著降低(图3-B)。
2.5 TFDG对糖尿病大鼠腹主动脉组织NLRP3炎症通路的影响
Western blot检测大鼠腹主动脉组织NLRP3炎症通路蛋白的表达情况,如图4所示,CON组糖尿病大鼠NLRP3的表达水平较NC组显著升高,且Cleaved caspase-1、Pro-caspase-1、Cleaved IL-1和IL-1的表达均显著增高;与CON组相比,TFDG5和TFDG10组大鼠NLRP3的表达水平显著降低,且Cleaved caspase-1、Cleaved IL-1和IL-1的水平均显著下降,表明TFDG膳食干预可有效抑制糖尿病大鼠腹主动脉组织NLRP3/IL-1炎症通路的激活。
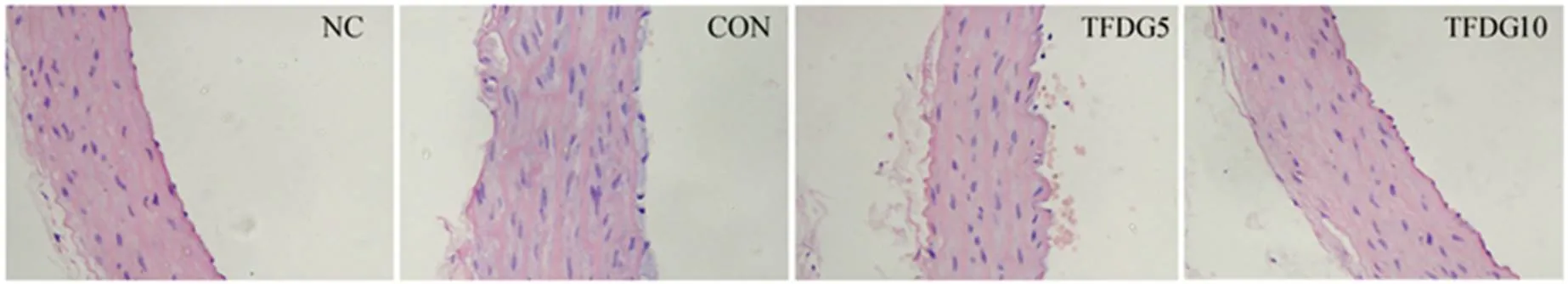
图1 各组大鼠腹主动脉切片形态学观察(HE染色,×400)
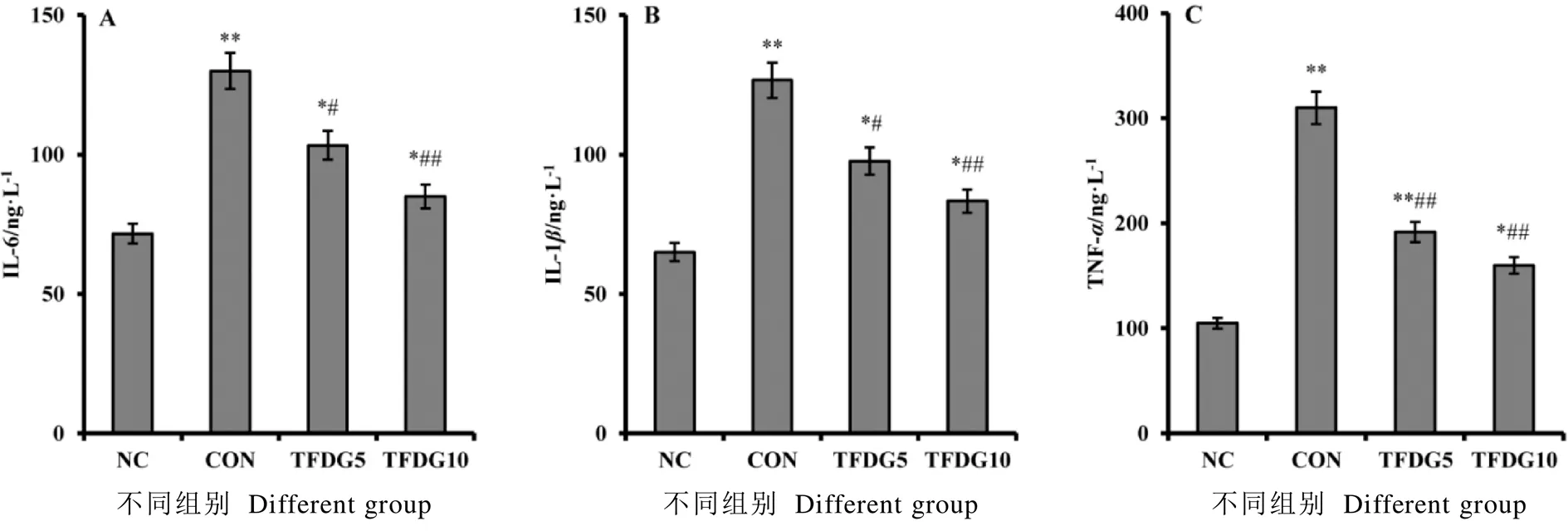
注:*P<0.05,**P<0.01,与NC组比较;#P<0.05,##P<0.01,与CON组比较
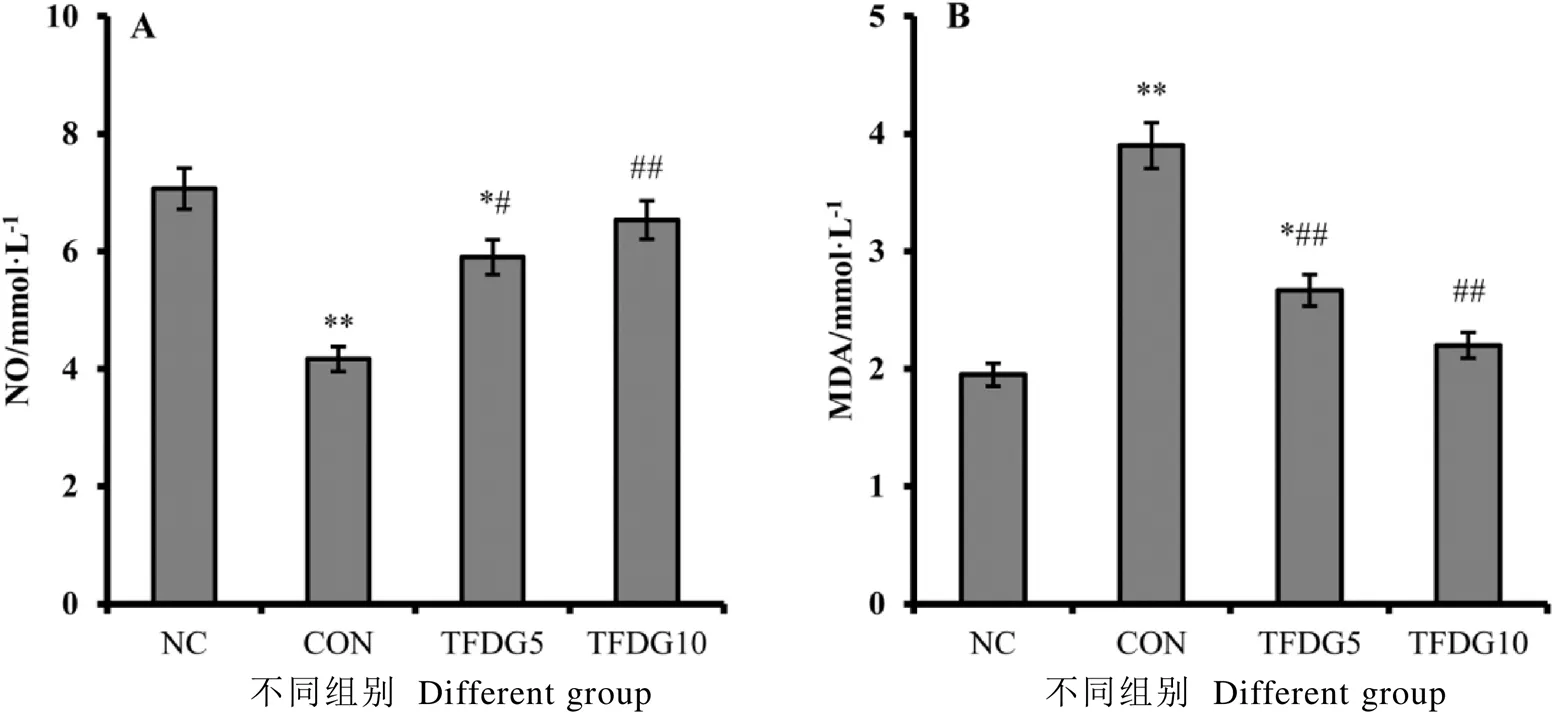
注:*P<0.05,**P<0.01,与NC组比较;#P<0.05,##P<0.01,与CON组比较
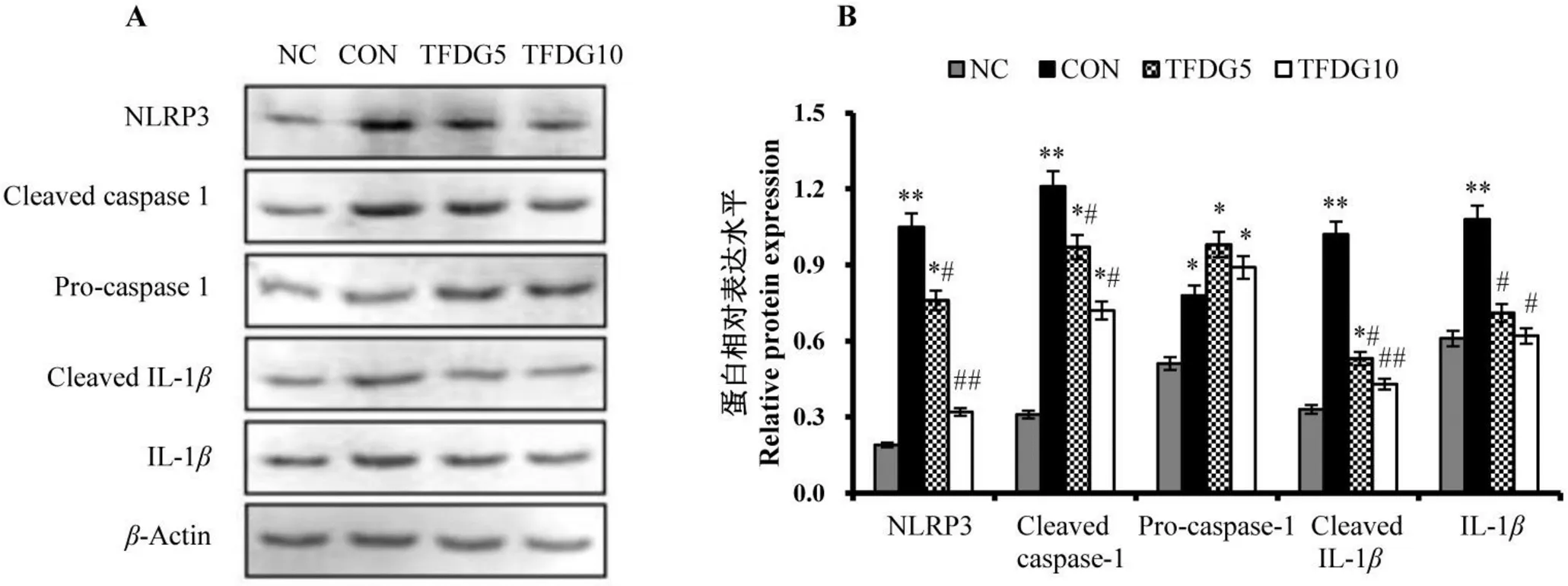
注:*P<0.05,**P<0.01,与NC组比较;#P<0.05,##P<0.01,与CON组比较
3 讨论
2型糖尿病是以糖代谢紊乱为主要临床表现的代谢综合征,其发病人数约占全球人口的8.5%[8]。2型糖尿病患者比非糖尿病患者发生心血管疾病和死亡的风险要高2~3倍,预计寿命平均缩短8年[9],而高血糖诱发的血管并发症是导致患者致死致残的主要原因[10]。本研究结果表明,红茶中的活性成分茶黄素能够有效减轻糖尿病大鼠腹主动脉血管损伤,并降低炎症反应,保护高糖条件下内皮细胞活力和功能,其机制可能涉及对NLRP3/IL-1炎症通路的抑制。血管内皮能够调整血管紧张度,改变血管结构,作为血管内感知血液动力学变化和血液中成分信号变化的第一道屏障。在高血糖条件下,血管内皮细胞最早受到损害。血管内皮细胞功能障碍是2型糖尿病心血管功能改变的始动因素和中心环节[11]。血管紧张度的维持有赖于内皮细胞释放各种血管扩张因子和紧张因子,其中NO是一种典型的血管扩张因子,血管内皮细胞NO释放量在一定程度上反映了血管内皮的损伤程度。长期的高血糖作用会限制NO的合成,并引起大量活性氧簇ROS的产生,损害血管的扩张功能。ROS的过量产生会导致机体自身氧化与抗氧化防御系统的不平衡,从而形成氧化应激状态[12]。TF作为一种天然膳食活性成分,因具有特定的分子结构和空间构象使得具有优良的抗氧化、抑菌、抑癌及抗炎等生物学特性[13-14]。本研究表明,TFDG能够降低糖尿病大鼠腹主动脉组织MDA水平,且有效保护血管内皮细胞,降低高糖诱导的细胞损伤,增加NO的释放水平,维护内皮细胞功能。可见,糖尿病患者长期饮用红茶可能有利于预防心血管疾病。
除了氧化应激以外,炎症反应同样是导致血管内皮损伤和动脉粥样硬化发生发展的一个关键因素。炎症小体是一种多蛋白复合物,在动脉粥样硬化演化和动脉粥样硬化斑块不稳定中十分重要,其对调节先天免疫和炎症反应至关重要。在众多类型的炎症小体中,NLRP3炎症小体是动脉粥样硬化进程所必需的,因此引起了广泛关注[15]。NLRP3炎性小体由NOD样受体家族、ASC适配体和procaspase-1组成[16]。很多刺激因素都可以激活NLRP3炎症小体,包括钙内流、胆固醇、脂多糖、钾外流、溶酶体受损、活性氧(ROS)等,NLRP3激活后会促进caspase-1的裂解,进而导致促炎因子IL-1和IL-18的释放,显著增强炎症反应[17]。
NLRP3炎症小体的激活可能是由细胞内各种因素共同触发,而不是直接与某一激动剂相互作用[18]。NLRP3炎症小体的激活和成熟IL-1的大量释放,决定了局部炎症的加剧和炎症因子上调导致的广泛组织损伤,其在动脉粥样硬化进程中扮演重要角色。例如NLRP3炎症小体激活会大量释放TNF-、IL-6、VCAM-1和ICAM-1,而这些炎症因子正是动脉粥样硬化的分子标记物和亚临床冠心病的预测因子[19]。试验研究和临床试验表明,抑制NLRP3炎症小体的激活、降低IL-1的释放,可有效抑制动脉粥样硬化的发展[20],这也是预防心血管病的一个有效策略,一些NLRP3炎症小体抑制剂已经被鉴定和验证,其中一些抑制剂也正在临床实践中使用或正在进行Ⅱ期临床试验研究[21]。本研究结果表明,糖尿病会诱导腹主动脉组织NLRP3炎症小体的激活,增强细胞炎症反应,TFDG能够有效抑制NLRP3/IL-1炎症通路,降低IL-1的释放和细胞炎症反应。NLRP3是如何被多种因素激活,其具体的调节机制怎样,目前均尚不清楚,阐明NLRP3炎症小体激活的机制并开发其特异性抑制剂,对于治疗众多炎症相关疾病包括心血管病具有十分重要的意义。TFDG如何抑制NLRP3/IL-1炎症通路,其详细分子机制值得深入探究。
[1] Li Y Z, Teng D, Shi X G, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study [J]. British Medical Journal,2020, 369: m997. doi: 10.1136/bmj.m997.
[2] Calvo-Maroto A M, Esteve-Taboada J J, Pérez-Cambrodí RJ, et al. Pilot study on visual function and fundus autofluorescence assessment in diabetic patients [J]. Journal of Ophthalmology, 2016, 2016: 1287847. doi:10.1155/2016/1287847.
[3] 许咏梅, 施云峰. 中国红茶出口“一带一路”沿线国家贸易及其影响因素实证分析[J]. 茶叶科学, 2019, 39(5): 602-610.
Xu Y M, Shi Y F. An empirical analysis of the trade and influencing factors of China's black tea export to countries along the Belt and Road [J]. Journal of Tea Science, 2019, 39(5): 602-610.
[4] 王洪新, 孙军涛, 吕文平, 等. 茶黄素的制备、分析、分离及功能活性研究进展[J]. 食品与生物技术学报, 2011, 30(1): 12-19.
Wang H X, Sun J T, Lv W P, et al. Research progress on preparation, analysis, separation and funtion of theaflavins [J]. Journal of Food Science and Biotechnology, 2011, 30(1): 12-19.
[5] He H F. Research progress on theaflavins: efficacy, formation, and preparation [J]. Food & Nutrition Research, 2017, 61(1): 1344521. doi: 10.1080/16546628.2017.1344521.
[6] Lin Y L, Tsai S H, Lin-Shiau S Y, et al. Theaflavin-3,3'-digallate from black tea blocks the nitric oxide synthase by down-regulating the activation of NF-B in macrophages [J]. European Journal of Pharmacology, 1999, 367(2/3): 379-388.
[7] 雷时成, 孙大利, 王亚洁, 等. 茶黄素双没食子酸酯的生物活性及其作用机制[J]. 食品与机械, 2020, 36(2): 229-236.
Lei S C, Sun D L, Wang Y J, et al. Biological activities of theaflavin-3,3'-digallate and its mechanism of action [J]. Food & Machinery, 2020, 36(2): 229-236.
[8] Ogurtsova K, da Rocha Fernandes J D, Huang Y, et al. IDF Diabetes Atlas: global estimates for the prevalence of diabetes for 2015 and 2040 [J]. Diabetes Research and Clinical Practice, 2017, 128: 40-50.
[9] Simmons R K, Griffin S J, Lauritzen T, et al. Effect of screening for type 2 diabetes on risk of cardiovascular disease and mortality: a controlled trial among 139,075 individuals diagnosed with diabetes in Denmark between 2001 and 2009 [J]. Diabetologia, 2017, 60(11): 2192-2199.
[10] Tancredi M, Rosengren A, Svensson A M, et al. Excess mortality among persons with type 2 diabetes [J]. The New England Journal of Medicine, 2015, 373(18): 1720-1732.
[11] Cull C A, Jensen C C, Retnakaran R, et al. Impact of the metabolic syndrome on macrovascular and microvascular outcomes in type 2 diabetes mellitus: United Kingdom prospective diabetes study 78 [J]. Circulation, 2007, 116(19): 2119-2126.
[12] Zhang J, Chen J, Yang J, et al. Resveratrol attenuates oxidative stress induced by balloon injury in the rat carotid artery through actions on the ERK1/2 and NF-KappaB pathway [J]. Cellular Physiology & Biochemistry, 2013, 31(2/3): 230-241.
[13] Ben Lagha A, Grenier D. Black tea theaflavins attenuate porphyromonas gingivalis virulence properties, modulate gingival keratinocyte tight junction integrity and exert anti-inflammatory activity [J]. Journal of Periodontal Research, 2017, 52(3): 458-470.
[14] Tan Q, Peng L, Huang Y, et al. Structure-activity relationship analysis on antioxidant and anticancer actions of theaflavins on human colon cancer cells [J]. Journal of Agricultural and Food Chemistry, 2019, 67(1): 159-170.
[15] Duewell P, Kono H, Rayner K J, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals [J]. Nature, 2010, 464(7306): 1357-1361.
[16] Jin Y, Fu J. Novel insights into the NLRP3 inflammasome in atherosclerosis [J]. Journal of the American Heart Association, 2019, 8(12): e012219. doi: 10.1161/jaha.119.012219.
[17] Jin C, Flavell R A. Molecular mechanism of NLRP3 inflammasome activation [J]. Journal of Clinical Immunology, 2010, 30(5): 628-631.
[18] Eisenbarth S C, Colegio O R, O'Connor W, et al. Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminium adjuvants [J]. Nature, 2008, 453(7198): 1122-1126.
[19] Zhao J, Wang Z, Yuan Z, et al. Baicalin ameliorates atherosclerosis by inhibiting NLRP3 inflammasome in apolipoprotein E-deficient mice [J]. Diabetes & Vascular Disease Research, 2020, 17(6): 1479164120977441. doi: 10.1177/1479164120977441.
[20] Wang R, Wang Y, Mu N, et al. Activation of NLRP3 inflammasomes contributes to hyperhomocysteinemia-aggravated inflammation and atherosclerosis in apoE-deficient mice [J]. Laboratory Investigation, 2017, 97(8): 922-934.
[21] Du R H, Tan J, Sun X Y, et al. Fluoxetine inhibits NLRP3 inflammasome activation: implication in depression [J]. International Journal of Neuropsychopharmacology, 2016, 19(9): pyw037. doi: 10.1093/ijnp/pyw037.
Effects of Theaflavin-3,3'--Digallate on Vascular Endothelial Injury and Inflammation in Rats with Diabetes Mellitus
DENG Zhihui, ZENG Jie, FU Hongjuan, CHANG Hui*
College of Food Science, Southwest University, Chongqing 400715, China
To investigate the protective effect and mechanism of theaflavin-3,3'--digallate (TFDG) on vascular endothelial injury and inflammation in rats with diabetes mellitus,diabetic rats were made by high fat feed and streptozotocin injection and then divided into model group (CON), 5 mg·kg-1and 10 mg·kg-1TFDG intervention group (TFDG5 and TFDG10). The normal rats were taken as control group (NC). After 8 weeks of treatment, the pathological changes of abdominal aorta were observed. Plasma IL-6, IL-1and TNF-were detected by ELISA. The protein expression was detected by Western blot.Compared with CON, TFDG administration has no significant effects on body weight and fasting blood glucose. Pathological sections show that the injury of aorta tissue in TFDG group was improved compared with that in CON group. At the same time, the level of plasma inflammatory factors was significantly decreased, the level of plasma NO was significantly increased, and the level of MDA in aorta tissue was decreased in TFDG group. Further studies show that TFDG could down-regulate NLRP3, caspase-1 and IL-1expressions in the aorta of diabetic rats. TFDG effectively protected vascular endothelial injury and inhibit inflammatory response in diabetic rats, and its mechanism might be through down-regulation of NLRP3 inflammatory pathway.
theaflavin, diabetes mellitus, vascular endothelial injury, inflammatory response
S571.1;R735.2
A
1000-369X(2021)06-823-08
2021-05-19
2021-08-13
西南大学全面提升研究生教育质量工程项目(XYDS201905)
邓志慧,女,硕士研究生,主要从事植物化学物及其生物学效应的研究。*通信作者:changhui2017@swu.edu.cn
(责任编辑:赵锋)

