固体核磁共振技术研究金属氧化物类固体酸催化剂的酸碱性
陈 欣,付颖懿,岳 斌,贺鹤勇
固体核磁共振技术研究金属氧化物类固体酸催化剂的酸碱性
陈 欣,付颖懿,岳 斌,贺鹤勇*
复旦大学化学系 上海市分子催化和功能材料重点实验室,上海 200438
固体核磁共振技术是研究固体催化剂酸碱性的有效工具.本文主要介绍了本课题组利用固体核磁共振技术进行固体酸催化剂酸碱性研究的进展,包括吸附水分子对金属氧化物表面酸性质影响的研究,以及结合酸碱探针分子共吸附表征方法对金属氧化物表面酸碱性的研究,对固体核磁共振技术定性和定量分析固体催化剂的酸碱性提出了一些新的见解.
固体核磁共振;吸附水分子;酸碱探针分子;酸性质;碱性质
引 言
固体酸广泛应用于工业催化反应,深入研究固体酸催化剂的酸性质,对于理解催化反应的机理,以及设计、优化催化剂具有重要意义.一些常见的表征技术,如红外光谱[1,2]、程序升温脱附法[3,4]、核磁共振(NMR)波谱[5-8]等,被广泛用于研究催化剂的酸性质.各种技术均存在一些不足:如红外光谱不易实现定量分析;程序升温脱附法无法判别Brønsted酸与Lewis酸;NMR波谱是一种研究固体酸酸性的独特工具,可通过探针分子定量研究酸类型、密度和强度,但测量相对复杂,对仪器要求较高.
在酸性测定时,有两个方面的研究值得进一步关注.一是很多固体酸催化反应含水,水以反应物、产物或溶剂等形式存在于反应过程中.常用的表征方法(如NH3程序升温脱附和吡啶吸附红外光谱等)是在样品焙烧处理后的脱水条件下测得催化剂的酸性质,无法反映水等溶剂或参与反应的其他分子对催化剂酸性的影响,也难以反映催化剂在实际反应过程中真正的酸性质.二是酸性催化剂都具有其共轭的弱碱位点,在实际反应过程中,固体酸的酸性位点及其共轭弱碱性位点可能会同时与反应物分子的碱性和酸性部分发生相互作用,从而可能对其催化性能产生影响.虽然有屈指可数的文献[9,10]报道了利用程序升温脱附法和漫反射红外光谱等研究了酸碱双探针分子对酸碱性的表征,但目前普遍的酸性质表征技术还是采用单一碱性探针分子,难以完整准确地体现催化剂表面的酸性质.而借助探针分子,可同时表征催化剂表面的酸碱性,应该更能体现实际催化反应体系中催化剂表面的活性位点的状态.
在使用固体NMR技术研究固体酸催化剂时,易于引入酸碱探针分子在固体催化剂表面达成共吸附,实现固体催化剂酸碱性的同时定量表征,能更准确地了解实际催化反应中催化剂酸碱性位点的性质.另外,通过固体NMR技术,也较容易定量表征吸附不同含量水分子或其他溶剂分子的固体酸的酸性质,并研究水分子或其他溶剂分子吸附对酸性的影响.这些研究对了解催化反应机理和优化设计催化剂具有指导意义.
本课题组近年来利用固体NMR技术,实现了吸附水含量不同的金属氧化物表面酸性的研究;发展了同时吸附酸性和碱性探针分子表征金属氧化物酸碱性质的方法,相比单探针分子表征结果,共吸附表征与反应性能相关性更佳.本文主要介绍水分子对金属氧化物表面酸性的影响,以及酸碱探针分子共吸附表征金属氧化物的酸碱性的研究工作,突出了固体NMR技术可借助不止一种探针分子定量研究固体酸催化剂酸性的优点.
1 固体NMR技术表征固体酸催化剂的酸性
催化剂的酸碱性质包括酸的类型、密度和强度分布等,魔角旋转(MAS)固体NMR技术可以同时明确给出上述相关的定性和定量信息,在催化剂酸性表征中的应用越来越广泛[11].后续发展起来的二维(2D)MAS NMR波谱也常用来研究固体酸催化剂的酸性质,例如探测Brønsted酸和Lewis酸性位点的协同作用、化学交换以及酸性位点间的空间距离[12-14]等.固体NMR技术表征催化剂酸性质的方法包括直接表征法和探针分子吸附法.
直接表征法包括1H、27Al和29Si MAS NMR等[15,16].1H MAS NMR可用于测定固体酸中的各种羟基,包括桥联羟基M−OH−M和弱酸性的端羟基M−OH.根据Al和Si原子含量的不同,通过27Al MAS NMR和29Si MAS NMR可以得出沸石分子筛中Al和Si原子的配位情况,进一步获取相关的酸性信息.
探针分子吸附法比直接表征法的应用范围更为广泛,常用的探针分子有氘代吡啶、2-13C-丙酮、三甲基膦(TMP)和三烷基氧膦(R3PO)等.31P核的天然丰度为100%,且NMR灵敏度较高,因此TMP和R3PO被广泛用作探针分子表征固体酸的酸性质[17-19].TMP与Brønsted酸作用形成质子化的TMPH+,对应31P NMR化学位移在P0~−5;TMP与Lewis酸相互作用的特征峰通常位于P−20~−60;而气态TMP的31P NMR化学位移在P−62左右[20,21].由于化学位移分布较广,TMP探针分子对于表征不同强度的Lewis酸性位点非常灵敏;不过TMPH+的31P NMR化学位移范围较窄,区分Brønsted酸强度的难度相对高一些.TMP分子容易被具有氧化性的物种氧化为三甲基氧膦(TMPO).TMPO也是一种常用的探针分子,物理吸附的TMPO分子的特征峰通常位于P30~45;TMPO吸附在Lewis酸的化学位移普遍认为在P53~64;TMPO与Brønsted酸作用产生的特征峰通常位于P65~90,比TMP测得的化学位移范围更广,有利于区分Brønsted酸[7,22].TMP和TMPO不仅可以用来检测酸的类型,还可以用来区分酸强度,在31P MAS NMR谱图中,低场和高场的特征峰分别对应较强和较弱的酸性位点[23].此外,根据31P MAS NMR谱图中特征峰的积分面积,借助用于定量的外标物质(如NH4H2PO4等)还可以获取酸密度等信息.
2 水分子吸附对金属氧化物酸性质的影响
在酯化、水合/脱水、氢化/脱氢等很多催化反应中,水可以作为反应物、产物或溶剂等存在于反应体系中[24-30].一般而言,催化剂的Brønsted酸不易受水分子的影响,但具有Lewis酸性的金属离子等对水分子有更强的亲和力,导致Lewis酸在含水体系中部分失活[7].作为典型的耐水型固体酸催化剂,Nb2O5·H2O和Ta2O5·H2O在含水体系中表现出很强的酸性和稳定性[31-37].干燥条件下,通过吡啶吸附红外光谱表征得到Nb2O5·H2O表面主要为Lewis酸,Ta2O5·H2O表面仅检测到Lewis酸,然而Nb2O5·H2O和Ta2O5·H2O能在含水体系中促进Brønsted酸催化的反应发生,表现出很高的活性和选择性[32].可见,在干燥条件下表征得到的催化剂的酸性难以体现其在实际含水体系中的酸性质.因此,研究催化剂在含水条件下的酸性对于了解含水体系中固体酸的催化机理具有重要意义.Hara[38]提出与类似NbO4和TiO4等不饱和配位的多面体结合的水分子易被亲核反应物交换,能在水溶液中保持Lewis酸性.Buniazet等[39]通过吸附NH3和H2O研究了TiO2/SiO2的酸性,提出水分子在强Lewis酸性位点解离并与Si-O-Ti和Ti-O-Ti结合会导致Brønsted酸量增加.
我们[40]选取Nb2O5·H2O、Ta2O5·H2O以及不同温度(350 ℃和450 ℃)焙烧后得到的Nb2O5-350、Nb2O5-450、Ta2O5-350和Ta2O5-450,以TMP为探针分子,通过31P MAS NMR对水分子含量不同的样品的表面酸性质进行了研究.
2.1 水分子吸附对铌氧化物和钽氧化物表面酸性的影响
吸附TMP探针分子和50~150 μmol/g水分子的Nb2O5·H2O、Nb2O5-350和Nb2O5-450的31P MAS NMR谱图见图1,化学位移在P−4、P−30和P−50附近的特征峰分别对应铌氧化物的Brønsted酸、强Lewis酸和弱Lewis酸,P60附近的特征峰归属为TMPO吸附在Lewis酸性位点.吸附TMP探针分子和50~150 μmol/g水分子的Ta2O5·H2O、Ta2O5-350和Ta2O5-450的31P MAS NMR谱图(图2)中,化学位移在P−4、P−17和P−50附近的特征峰分别对应钽氧化物表面的Brønsted酸、强Lewis酸和弱Lewis酸,P65附近的特征峰亦归属为TMPO吸附在Brønsted酸性位点.定量计算所得的铌氧化物和钽氧化物的酸密度等信息如表1所示.
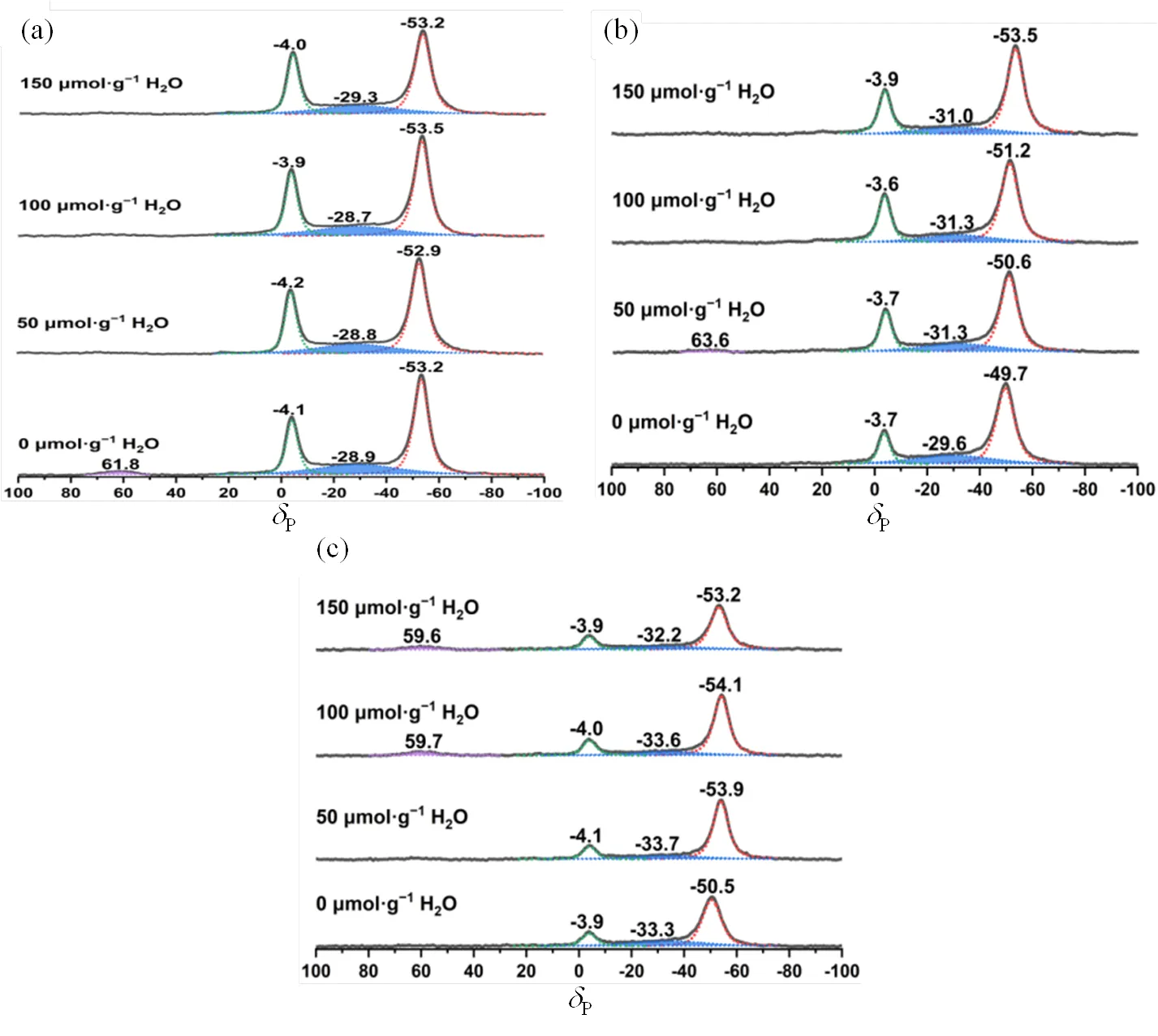
图1 吸附TMP探针分子和不同量水分子的(a) Nb2O5·nH2O、(b) Nb2O5-350和(c) Nb2O5-450的31P MAS NMR谱图(依据文献[40])
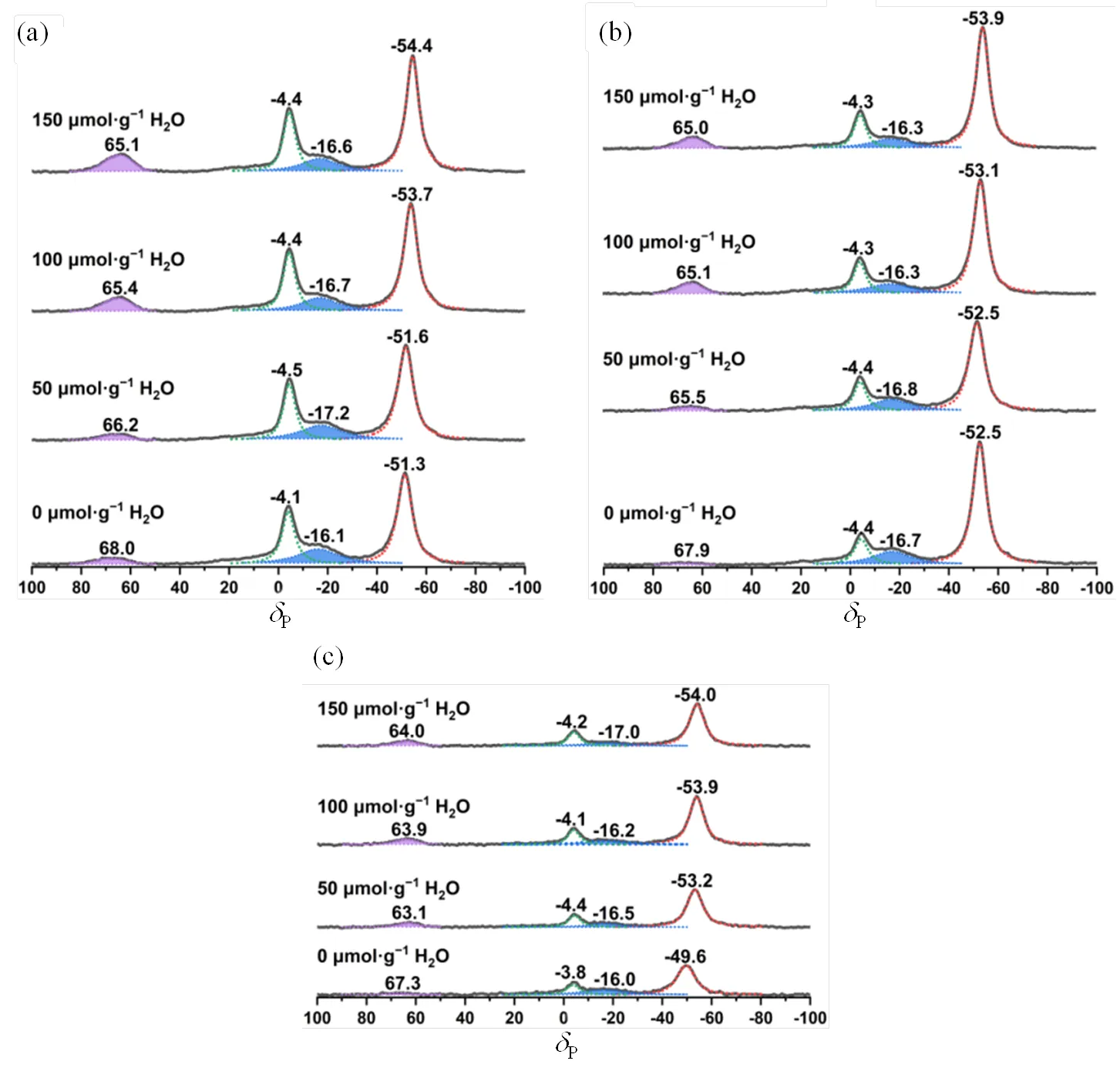
图2 吸附TMP探针分子和不同量水分子的(a) Ta2O5·nH2O、(b) Ta2O5-350和(c) Ta2O5-450 31P MAS NMR谱图(依据文献[40])
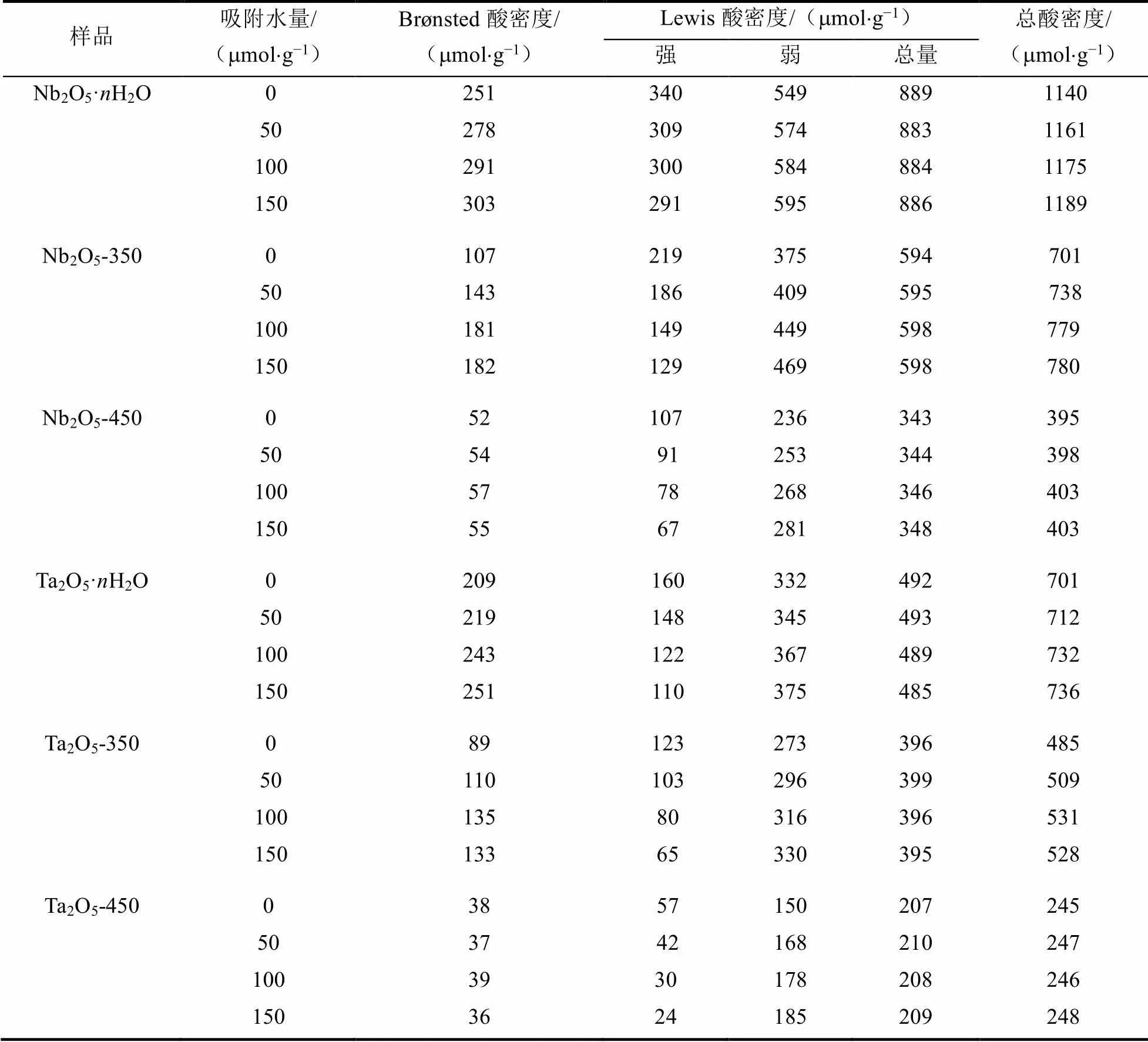
表1 吸附不同量水分子的铌氧化物和钽氧化物的酸性数据[40]
当Nb2O5·H2O吸附50mmol×g−1水分子时,对比干燥条件下的样品,Brønsted酸和弱Lewis酸的密度分别增加了27和25mmol×g−1,与强Lewis酸密度的减少量(31mmol×g−1)相当.当吸附水量达到150mmol×g−1时,对比未吸附水的样品,Brønsted酸和弱Lewis酸密度分别增加了52和46mmol×g−1,二者各自的增加量与强Lewis酸的减少量(49mmol×g−1)的比例接近1:1:1.对于吸附少量水分子(£100mmol×g−1)的Nb2O5-350而言,与Nb2O5·H2O的情况类似,样品表面的强Lewis酸密度减少,Brønsted酸和弱Lewis酸的密度分别增加,三者变化量的比例约为1:1:1.随着吸附水量进一步增加至150mmol×g−1,Brønsted酸维持稳定,强Lewis酸继续减少20mmol×g−1,而弱Lewis酸增加20mmol×g−1,两者的变化量近似相等.吸附不同量水分子的Nb2O5-450的酸性测量结果表明,随着吸附水分子增加,Brønsted酸未发生明显变化,强Lewis酸不断减少,弱Lewis酸不断增加,强Lewis酸的减少量与弱Lewis酸的增加量几乎相等.当吸附150mmol×g−1水分子时,与干燥的样品相比,强Lewis酸密度减少40mmol×g−1,同时弱Lewis酸密度增加45mmol×g−1.
与Nb2O5·H2O的结果类似,随着吸附水分子量的增加,Ta2O5·H2O的Brønsted酸和弱Lewis酸的密度也不断增加,对应强Lewis酸密度不断减少,且Brønsted酸和弱Lewis酸各自的增加量与强Lewis酸密度的减少量大致相当.Ta2O5-350的表征结果与Nb2O5-350的情况相似,吸附少量水分子(£100mmol×g−1)时,样品的强Lewis酸转化为弱Lewis酸并且诱导出相应数量的Brønsted酸.随着吸附水量进一步增大至150mmol×g−1,Brønsted酸几乎保持不变,强Lewis酸继续减少15mmol×g−1,而弱Lewis酸增加14mmol×g−1,说明减少的强Lewis酸转化为弱Lewis酸.与Nb2O5-450的结果一致,随着水分子的引入,Ta2O5-450的Brønsted酸几乎无明显变化,伴随强Lewis酸的减少,弱Lewis酸等量增加.吸附水量为150mmol×g−1时,相比未吸附水的样品,强Lewis酸减少33mmol×g−1,与弱Lewis酸的增加量(35mmol×g−1)相当.
2.2 水分子在金属氧化物表面酸性位点的吸附模型
根据31P MAS NMR表征得到的样品的酸性信息,对于Nb2O5·H2O、Ta2O5·H2O和吸附少量水分子的Nb2O5-350、Ta2O5-350而言,随着吸附水分子增加,样品的Brønsted酸和弱Lewis酸增加,强Lewis酸减少,且Brønsted酸和弱Lewis酸密度的增加量与强Lewis酸密度减少量的比例约为1:1:1.由此提出如图3(a)所示的吸附模型,水分子吸附在配位不饱和的MO4四面体的金属原子上,其强的吸电子作用导致水分子中的氧原子给出电子,诱导水分子的氢原子形成新的Brønsted酸.同时,由于金属原子配位数增加,强Lewis酸的密度和强度降低,转变为弱Lewis酸.对于Nb2O5-450、Ta2O5-450和吸附大量水分子(³100mmol×g−1)的Nb2O5-350、Ta2O5-350而言,样品表面的Brønsted酸几乎不随水分子的增加而变化,水分子的引入仅使强Lewis酸减少而弱Lewis酸增加,弱Lewis酸的增加量与强Lewis酸的减少量大致相当.如图3(b)所示,水分子与配位不饱和的MO5结构单元的金属原子作用,金属原子的吸电子能力不足以使水分子中的氢原子形成新的Brønsted酸,但吸附的水分子将改变金属原子的配位环境使其转变为弱Lewis酸.
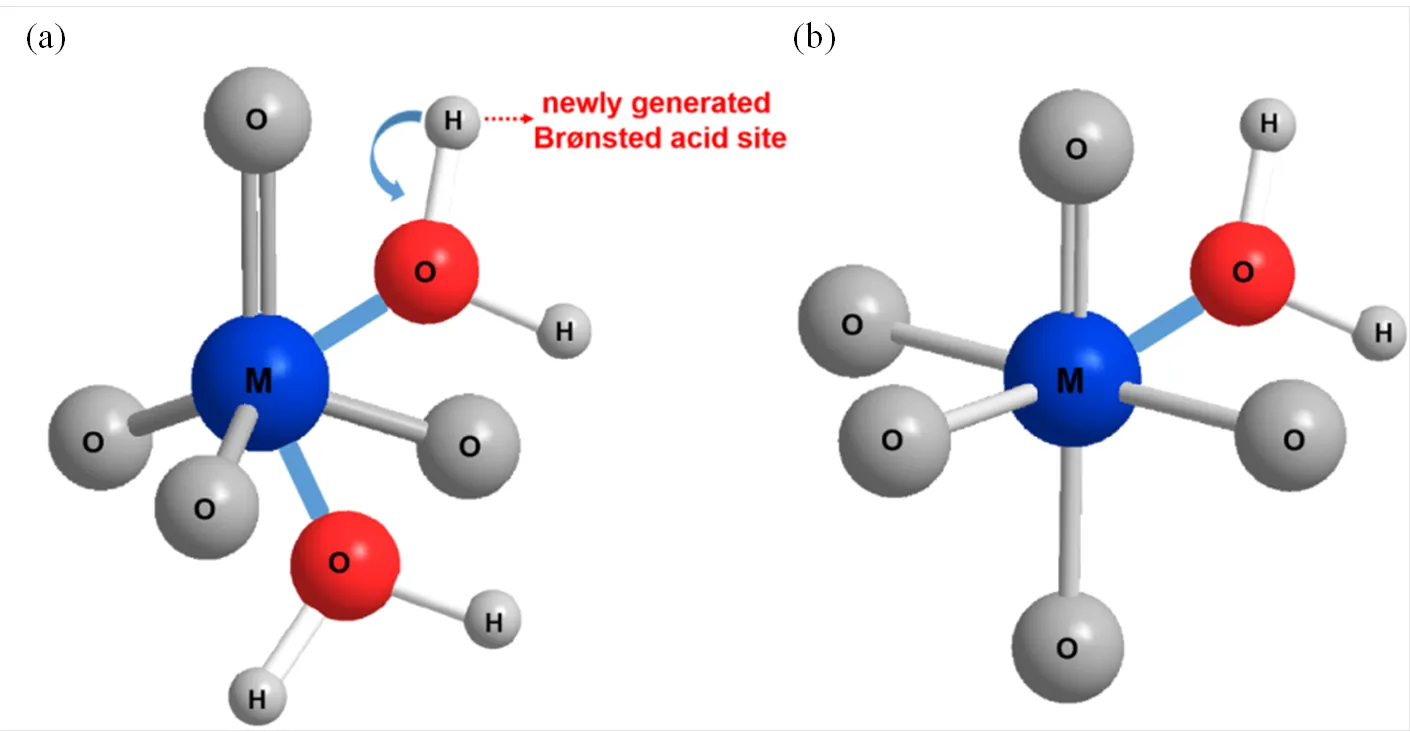
图3 水分子在(a) MO4和(b) MO5结构单元上的吸附模型[40]
以上研究显示,固体NMR技术可定量研究吸附水分子的固体酸催化剂表面的酸性质.在水分子存在的条件下,水分子吸附在金属氧化物表面,可诱导产生新的Brønsted酸,同时强Lewis酸转化为弱Lewis酸.此类结构变化的信息,是难以通过先焙烧处理后测定的常规NH3程序升温脱附和吡啶吸附红外光谱获得的.
3 固体NMR技术表征固体酸催化剂的酸碱性
理论上所有的固体酸都应存在与酸性位点共轭的碱性位点,实际反应过程中,固体酸的酸性位点及其共轭碱性位点可同时与反应物分子的碱性和酸性部分发生相互作用,从而对催化剂的催化性能产生影响[41].但目前常见的表征催化剂表面酸性的方法(如Hammett指示剂法[42]、微量热法[43,44]、NH3程序升温脱附法、吡啶吸附红外光谱和固体NMR技术等)通常结合单一的碱性探针分子研究固体酸的酸性.同时表征催化剂的酸性和碱性,得到的相关信息理论上应该比单一探针分子的表征结果更加丰富,其结果可能更能反映实际反应体系中催化剂的表面状态.固体碱亦应具有类似的性质.Hill等[9]采用两性分子乙炔和甘氨酸作为探针分子研究了MgO、ZrO2和羟基磷灰石等固体酸的酸性和碱性,提出甘氨酸能够有效地同时表征催化剂的酸碱性.徐柏庆等[10]采用同时吸附CO2和NH3的程序升温脱附法研究了ZrO2的酸性和碱性,发现ZrO2表面的酸碱位点存在相互影响,单独吸附NH3或CO2与同时吸附NH3和CO2的表征结果存在差异.可见,仅采用酸性探针分子以及使用具有两性的探针分子来表征催化剂的酸性难以准确地体现催化剂的酸碱性质.同时采用酸碱探针分子共吸附表征催化剂的酸碱性,应该更接近实际反应体系中催化剂表面活性位点的状态.
我们[45]采用固体NMR技术,分别以13CO2和TMP为表征碱性和酸性的探针分子,对三种典型的金属氧化物(ZrO2、Al2O3和MgO)进行了13C和31P MAS NMR表征,研究了酸碱性位点的类型、强度和密度,并在室温条件下采用固体NMR技术研究了ZrO2、Al2O3和MgO催化剂上的丙酮缩合反应,探讨了反应活性与酸碱性质的关系.
3.1 酸碱探针分子共吸附表征金属氧化物的酸碱性
13CO2是一种固体NMR常用的研究金属氧化物碱性的探针分子,弱碱性位点吸附13CO2形成碳酸氢盐,中等碱性位点吸附13CO2形成双齿碳酸盐,强碱位点吸附13CO2形成单齿碳酸盐.考虑13C−O键的极化作用,13CO2在弱、中强和强碱性位点吸附后的13C NMR化学位移分别在C158~162、C163~167和C167~171范围.
图4为Al2O3、ZrO2、MgO单吸附13CO2及共吸附TMP和13CO2后的13C MAS NMR谱图,图5为Al2O3、ZrO2、MgO单吸附TMP及共吸附TMP和13CO2后的31P MAS NMR谱图.定量计算得到的酸密度和碱密度等信息如表2所示.
MgO单独吸附13CO2以及共吸附TMP和13CO2的13C MAS NMR谱图如图4(a)所示,13CO2吸附在MgO表面时检测到中强碱性位点.当13CO2和TMP共同吸附时,中强碱性位点的特征峰均向低场移动,表明碱性强度增加,且部分属强碱位.共吸附表征时还出现对应在C161.4的弱碱性位点.这些变化可归结为表面键诱导作用,当TMP分子中的P原子接近Mg并提供电子,导致Mg邻近氧原子上的电荷密度增加,碱性强度增加.单吸附TMP以及共吸附TMP和13CO2分别得到的MgO的31P MAS NMR谱图如图5(a)所示,仅吸附TMP时未出现明显的特征峰,说明其表面无酸性位点或酸性太弱.共吸附表征时,检测到很弱的Lewis酸,密度为15.8mmol×g−1,显然表面键诱导作用增加了MgO的酸性.
ZrO2单吸附13CO2和共吸附TMP和13CO2得到的13C MAS NMR谱图如图4(b)所示.13CO2单吸附在强、中和弱碱性位点形成单齿碳酸盐、双齿碳酸盐和碳酸氢盐,分别对应C169.8、C164.6和C160.6的特征峰.共吸附TMP和13CO2时,强碱性位点对应的化学位移向低场移动至C172.3,表明表面键相互诱导作用增强了强碱性位点的强度.图5(b)为ZrO2单吸附TMP以及共吸附TMP和13CO2的31P MAS NMR谱图.P−39.5、P−42.9和P−47.1的特征峰对应三种不同强度的Lewis酸.共吸附TMP与13CO2时,三种不同强度的Lewis酸峰重叠,P61.5处较弱的峰归属为吸附在较强的Lewis酸性位点的TMPO对应的特征峰,相比单吸附表征结果,总的酸性增强不明显.图4(c)为Al2O3单吸附13CO2以及共吸附TMP和13CO2的13C MAS NMR谱图.单吸附表征结果说明Al2O3表面存在中强和弱的碱性位点.共吸附表征结果中,中强和弱的碱性位点的特征峰向低场移动,表明碱性位点的强度增加.图5(c)为Al2O3吸附TMP和共同吸附TMP和13CO2的31P MAS NMR谱图.同时吸附TMP和13CO2后,与ZrO2的表征结果类似.另外,一些缺陷位的存在导致部分TMP转变成TMPO.
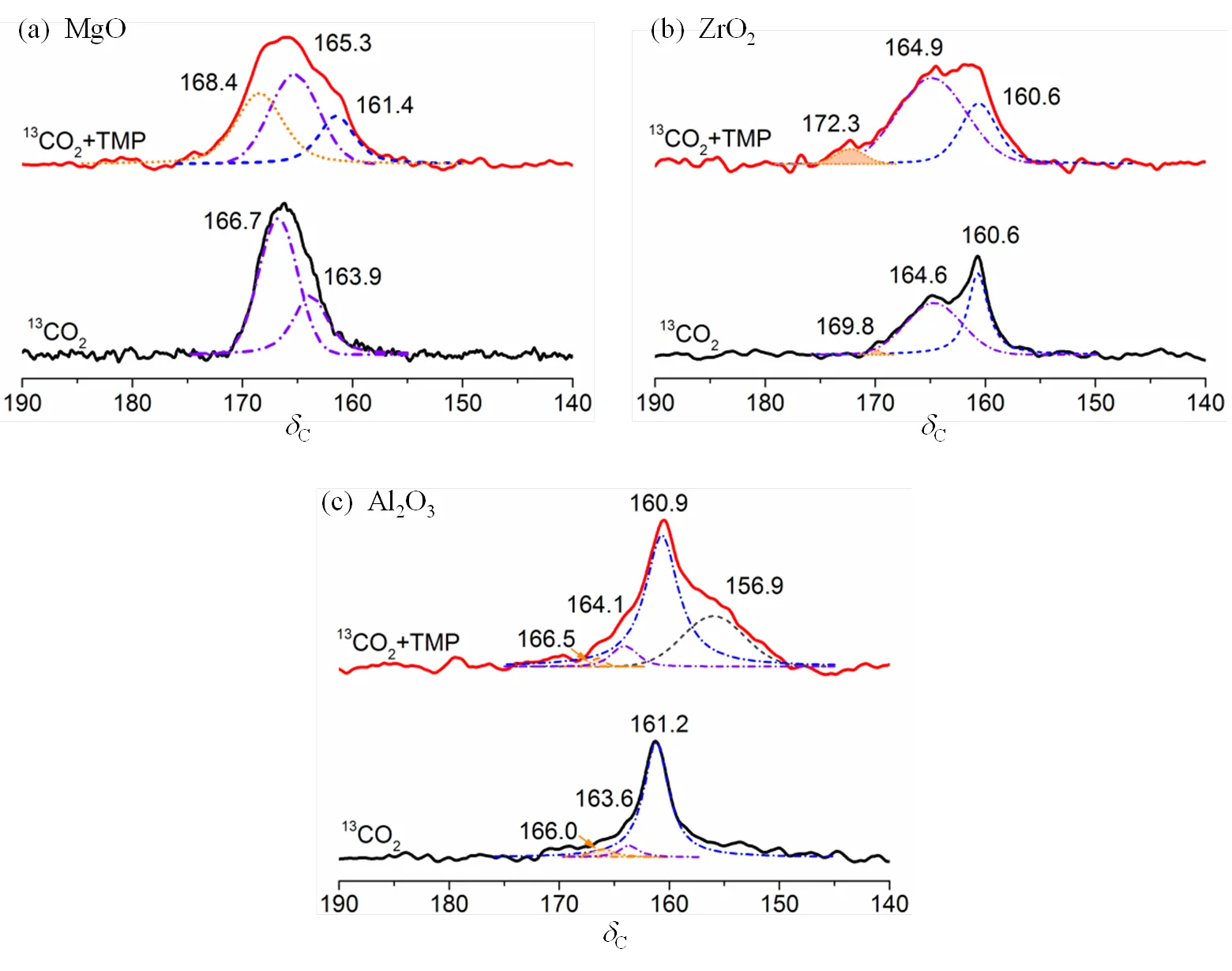
图4 单吸附13CO2及共吸附TMP和13CO2后(a) MgO、(b) ZrO2和(c) Al2O3的13C MAS NMR谱图(依据文献[45])

图5 单吸附TMP以及共吸附TMP和13CO2后(a) MgO、(b) ZrO2和(c) Al2O3的31P MAS NMR谱图(依据文献[45])
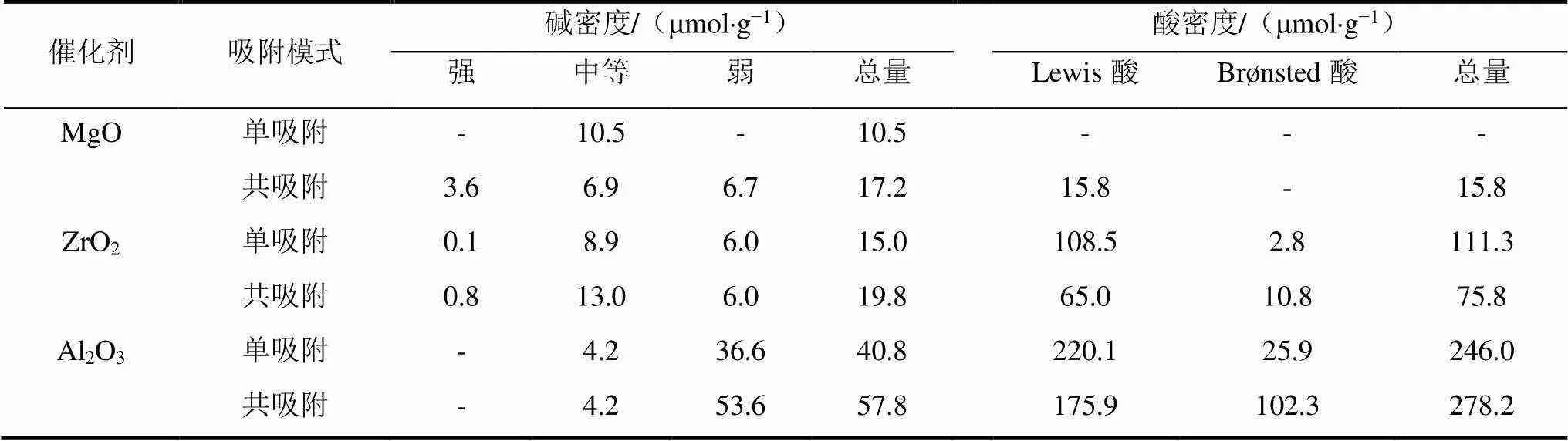
表2 采用TMP或13CO2单吸附及两者共吸附方法得到的催化剂酸碱位密度[45]
总体来看,双探针分子法获得的酸碱性质与单探针分子法有所不同.MgO、ZrO2和Al2O3共吸附CO2和TMP得到的碱性位点的强度和密度通过表面键诱导相互作用增加.双探针分子法测定酸性中,表面键诱导相互作用使得MgO的Lewis酸的强度和密度增加,ZrO2和Al2O3的Lewis酸的密度随着双齿碳酸盐和碳酸氢盐的形成而降低,Brønsted酸密度随之增加.
3.2 酸碱探针分子在金属氧化物表面共吸附的模型
基于上述表征结果,我们提出了TMP和13CO2在金属氧化物催化剂上共同吸附的模型(图6).共吸附法测定的MgO和ZrO2上的强碱性位点对应模型(a),当CO2吸附在强碱位点,形成单齿碳酸盐,TMP分子中P原子的电子通过表面键诱导作用导致Lewis酸性中心M邻近的氧原子的电子密度增加,从而增加碱性强度;并使邻近的金属原子的电子密度通过表面键诱导作用降低,从而增加了酸的强度.吸附在中等碱性位点的CO2形成双齿碳酸盐,如模型(b)所示,同理由于表面键诱导作用导致酸、碱性强度增加.形成的双齿碳酸盐中氧原子占据了相邻M的Lewis酸性位点,共吸附检测到Lewis酸减少.弱碱性位点吸附CO2形成碳酸氢盐[模型(c)],碳酸氢盐中的酸性质子与CO2结合产生新的Brønsted酸,Lewis酸的强度也会通过表面键诱导相互作用而降低.
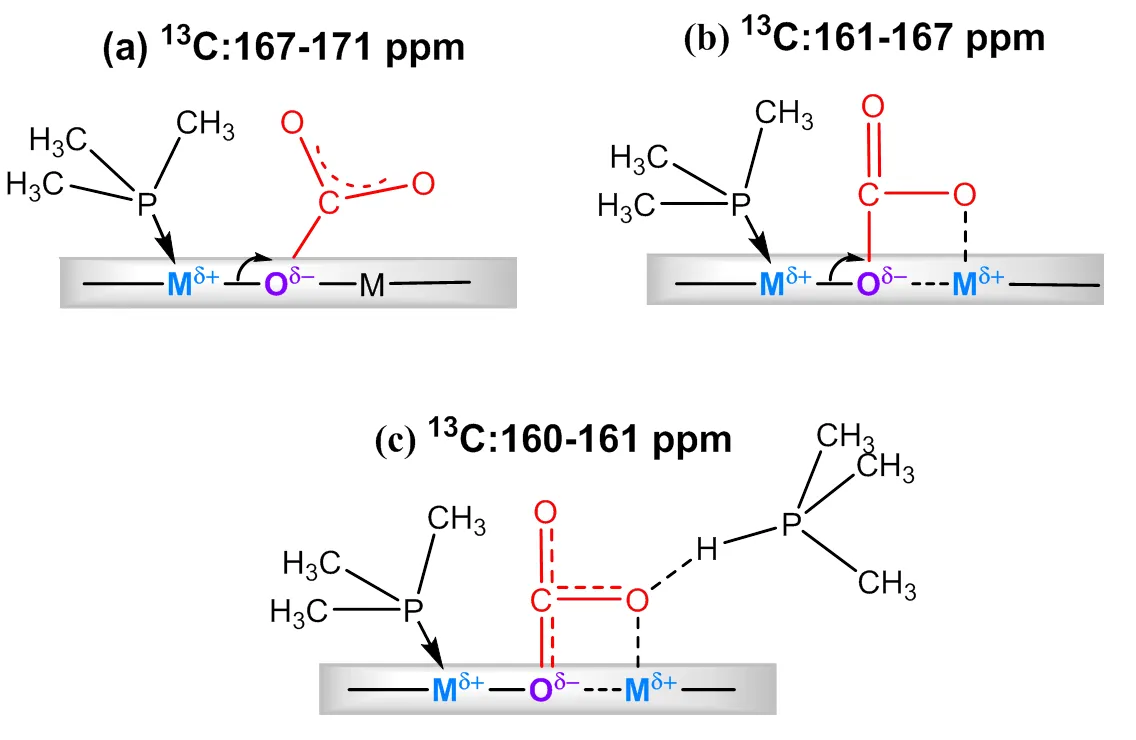
图6 TMP和13CO2在金属氧化物催化剂上的多种共吸附模型(依据文献[45])
TMP和13CO2的共吸附模型表明,催化剂上的酸(碱)性位点可能与其共轭碱(酸)性位点共存,反应物吸附在酸性或碱性位点,其共轭碱或酸性位点的类型、强度和密度也会发生改变.因此以共吸附方法得到的酸、碱性质可能更接近催化剂的实际情况.将ZrO2、Al2O3和MgO用于室温丙酮缩合反应,研究了催化活性与两种方法表征得到的表面酸碱性的关系,得到该反应的反应速率与共吸附表征的酸性结果存在更好的线性关系(图7).可见,不同催化剂上的反应活性和反应速率都与共吸附方法获得的催化剂的酸碱性质更符合,即采用酸碱探针分子共吸附来表征催化剂酸碱性更能反映催化剂在实际参与反应中的状态.
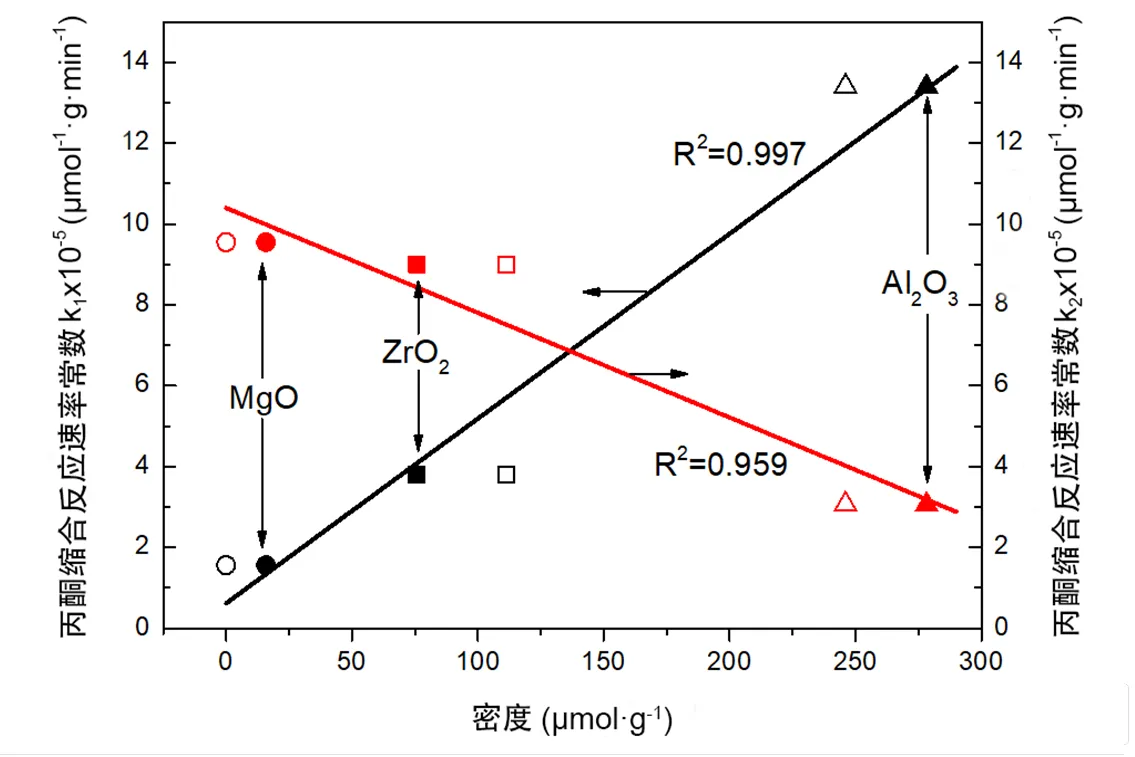
图7 丙酮缩合反应速率常数k1和k2与催化剂表面酸密度的关系(○、□和△为单吸附表征结果,●、■和▲为共吸附表征结果)(依据文献[45])
4 总结与展望
固体NMR技术结合碱性探针分子,可研究固体酸催化剂的酸类型、酸强度和酸密度等信息,并获得定量结果.此技术还可在碱性探针分子存在下引入水分子或酸性探针分子,定量揭示吸附水分子对固体酸催化剂表面酸性位点的影响及单探针分子表征方法难以获得的碱性信息.在水分子存在的条件下,将诱导金属氧化物表面产生新的Brønsted酸,并且将其表面强Lewis酸转化为弱Lewis酸,此类结构变化的信息,难以通过常规NH3程序升温脱附和吡啶吸附红外光谱获得;利用固体NMR技术还可以简单明确地获得转变信息.酸碱探针分子共吸附表征催化剂酸碱性的方法不同于单探针分子表征方法,更接近催化剂实际参与反应表现出的酸碱性质.以上研究有利于阐明表面结构与催化性能之间的关系,可为进一步合理设计催化剂提供新的依据.
固体NMR技术结合其他酸性或碱性探针分子,将可进一步实现酸碱性位点强度的准确区分和酸碱性位点的定量表征;采用一些先进的二维固体NMR技术,可有效研究反应分子或探针分子与固体酸催化剂之间的主客体相互作用,进一步推动固体酸催化剂酸碱性和催化反应机理的研究.
感谢国家自然科学基金(22088101,91645201)对本文的资助.
无
[1] LERCHER J A, GRUNDLING C, EDER-MIRTH G. Infrared studies of the surface acidity of oxides and zeolites using adsorbed probe molecules[J]. Catal Today, 1996, 27(3): 353-376.
[2] BUSCA G. Spectroscopic characterization of the acid properties of metal oxide catalysts[J]. Catal Today, 1998, 41(1-3): 191-206.
[3] TOPSØE NY, PEDERSEN K, DEROUANE E G. Infrared and temperature-programmed desorption study of the acidic properties of ZSM-5-type zeolites[J]. J Catal, 1981, 70(1): 41-52.
[4] HIDALGO C V, ITOH H, HATTORI T, et al. Measurement of the acidity of various zeolites by temperature-programmed desorption of ammonia[J]. J Catal, 1984, 85(2): 362-369.
[5] BROWN S P. Applications of high-resolution1H solid-state NMR[J]. Solid State Nucl Magn Reson, 2012, 41: 1-27.
[6] HUNGER M. Brønsted acid sites in zeolites characterized by multinuclear solid-state NMR spectroscopy[J]. Catal Rev Sci Eng, 1997, 39(4): 345-393.
[7] ZHENG A M, HUANG SJ, WANG Q, et al. Progress in development and application of solid-state NMR for solid acid catalysis[J]. Chin J Catal, 2013, 34(3): 436-491.
[8] GAO X Z, ZHANG Y, WANG X M, et al. Structure and acidity changes in ultra-stable Y zeolites during hydrothermal aging: A solid state NMR spectroscopy study[J]. Chinese J Magn Reson, 2020, 37(1): 95-103.
高秀枝,张翊,王秀梅,等.NMR研究超稳Y分子筛水热老化过程中结构与酸性的变化[J].波谱学杂志, 2020,37(1):95-103.
[9] HILL I M, HANSPAL S, YOUNG Z D, et al. DRIFTS of probe molecules adsorbed on magnesia, zirconia, and hydroxyapatite catalysts[J]. J Phys Chem C, 2015, 119(17): 9186-9197.
[10] XU BQ, YAMAGUCHI T, TANABE K. Acid-base bifunctional behavior of ZrO2in dual adsorption of CO2and NH3[J]. Chem Lett, 1988, (10): 1663-1666.
[11] YU Z W,ZHENG A M,WANG Q, et al.Acidity characterization of solid acid catalysts by solid-state NMR spectroscopy: A review on recent progresses[J]. Chinese J Magn Reson, 2010, 27(4): 485-515.
喻志武, 郑安民, 王强, 等. 固体核磁共振研究固体酸催化剂酸性进展[J]. 波谱学杂志, 2010, 27(4): 485-515.
[12] LI S H, HUANG SJ, SHEN W L, et al. Probing the spatial proximities among acid sites in dealuminated H-Y zeolite by solid-state NMR spectroscopy[J]. J Phys Chem C, 2008, 112(37): 14486-14494.
[13] CHEN K Z, ABDOLRHAMANI M, SHEETS E, et al. Direct detection of multiple acidic proton sites in zeolite HZSM-5[J]. J Am Chem Soc, 2017, 139(51): 18698-18704.
[14] YU Z W, ZHENG A M, WANG Q A, et al. Insights into the dealumination of zeolite HY revealed by sensitivity-enhanced27Al DQ-MAS NMR spectroscopy at high field[J]. Angew Chem Int Ed, 2010, 49(46): 8657-8661.
[15] SU X, XU S T, TIAN P, et al. Investigation of the strong Bronsted acidity in a novel SAPO-type molecular sieve, DNL-6[J]. J Phys Chem C, 2015, 119(5): 2589-2596.
[16] ZHANG M Z, XU S T, LI J Z, et al. Methanol to hydrocarbons reaction over Hβ zeolites studied by high resolution solid-state NMR spectroscopy: Carbenium ions formation and reaction mechanism[J]. J Catal, 2016, 335: 47-57.
[17] WANG Y, ZHUANG J Q, YANG G, et al. Study on the external surface acidity of MCM-22 zeolite: Theoretical calculation and31P MAS NMR[J]. J Phys Chem B, 2004, 108(4): 1386-1391.
[18] PENG YK, YE L, QU J, et al. Trimethylphosphine-assisted surface fingerprinting of metal oxide nanoparticle by31P solid-state NMR: A zinc oxide case study[J]. J Am Chem Soc, 2016, 138(7): 2225-2234.
[19] ZHENG A M, LI S H, LIU S B, et al. Acidic properties and structure-activity correlations of solid acid catalysts revealed by solid-state NMR spectroscopy[J]. Acc Chem Res, 2016, 49(4): 655-663.
[20] LUNSFORD J H, ROTHWELL W P, SHEN W. Acid sites in zeolite Y: A solid-state NMR and infrared study using trimethylphosphine as a probe molecule[J]. J Am Chem Soc, 1985, 107(6): 1540-1547.
[21] LUNSFORD J H. Characterization of acidity in zeolites and related oxides using trimethylphosphine as a probe[J]. Top Catal, 1997, 4(1-2): 91-98.
[22] ZHENG A M, LIU S B, DENG F. Acidity characterization of heterogeneous catalysts by solid-state NMR spectroscopy using probe molecules[J]. Solid State Nucl Magn Reson, 2013, 55: 12-27.
[23] ZHENG A M, LIU S B, DENG F.31P NMR chemical shifts of phosphorus probes as reliable and practical acidity scales for solid and liquid catalysts[J]. Chem Rev, 2017, 117(19): 12475-12531.
[24] OKUHARA T. Water-tolerant solid acid catalysts[J]. Chem Rev, 2002, 102(10): 3641-3666.
[25] USHIKUBO T. Recent topics of research and development of catalysis by niobium and tantalum oxides[J]. Catal Today, 2000, 57(3-4): 331-338.
[26] IGNATCHENKO A, NEALON D G, DUSHANE R, et al. Interaction of water with titania and zirconia surfaces[J]. J Mol Catal A: Chem, 2006, 256(1-2): 57-74.
[27] NOMA R, NAKAJIMA K, KAMATA K, et al. Formation of 5-(hydroxymethyl)furfural by stepwise dehydration over TiO2with water-tolerant Lewis acid sites[J]. J Phys Chem C, 2015, 119(30): 17117-17125.
[28] SANTOS K M A, ALBUQUERQUE E M, INNOCENTI G, et al. The role of Brønsted and water-tolerant Lewis acid sites in the cascade aqueous-phase reaction of triose to lactic acid[J]. ChemCatChem, 2019, 11(13): 3054-3063.
[29] CHEN Z, ZHU G S, WU Y, et al. The promotion effect of transition metals on water-tolerant performance of Cu/SiO2catalysts in hydrogenation reaction[J]. ChemistrySelect, 2019, 4(48): 14063-14068.
[30] TAKAGAKI A. Rational design of metal oxide solid acids for sugar conversion[J]. Catalysts, 2019, 9(11): 907.
[31] NAKAJIMA K, BABA Y, NOMA R, et al. Nb2O5·nH2O as a heterogeneous catalyst with water-tolerant Lewis acid sites[J]. J Am Chem Soc, 2011, 133(12): 4224-4227.
[32] JIMENEZ-MORALES I, MORENO-RECIO M, SANTAMARIA-GONZALEZ J, et al. Mesoporous tantalum oxide as catalyst for dehydration of glucose to 5-hydroxymethylfurfural[J]. Appl Catal B: Environ, 2014, 154: 190-196.
[33] HIRUNSIT P, TOYAO T, SIDDIKI S, et al. Origin of Nb2O5Lewis acid catalysis for activation of carboxylic acids in the presence of a hard base[J]. ChemPhysChem, 2018, 19(21): 2848-2857.
[34] HUANG F M, JIANG T Y, DAI H Y, et al. Transformation of glucose to 5-hydroxymethylfurfural over regenerated cellulose supported Nb2O5·nH2O in aqueous solution[J]. Catal Lett, 2020, 150(9): 2599-2606.
[35] SKRODCZKY K, ANTUNES M M, HAN X Y, et al. Niobium pentoxide nanomaterials with distorted structures as efficient acid catalysts[J]. Commun Chem, 2019, 2: 129.
[36] LEAL G F, LIMA S, GRACA I, et al. Design of nickel supported on water-tolerant Nb2O5catalysts for the hydrotreating of lignin streams obtained from lignin-first biorefining[J]. iScience, 2019, 15: 467-488.
[37] GUAN W X, CHEN X, JIN S H, et al. Highly stable Nb2O5-Al2O3composites supported Pt catalysts for hydrodeoxygenation of diphenyl ether[J]. Ind Eng Chem Res, 2017, 56(47): 14034-14042.
[38] HARA M. Heterogeneous Lewis acid catalysts workable in water[J]. Bull Chem Soc Jpn, 2014, 87(9): 931-941.
[39] BUNIAZET Z, COUBLE J, MAURY S, et al. Acidity of SiO2-supported metal oxides in the presence of H2O using the AEIR method: 2. Adsorption and coadsorption of NH3and H2O on TiO2/SiO2catalysts[J]. Langmuir, 2020, 36(45): 13383-13395.
[40] CHEN X, HUANG D F, HE L L, et al. Effect of adsorbed water molecules on the surface acidity of niobium and tantalum oxides studied by MAS NMR[J]. J Phys Chem C, 2021, 125(17): 9330-9341.
[41] SHYLESH S, THIEL W R. Bifunctional acid-base cooperativity in heterogeneous catalytic reactions: advances in silica supported organic functional groups[J]. ChemCatChem, 2011, 3(2): 278-287.
[42] WALLING C. The acid strength of surfaces[J]. J Am Chem Soc, 1950, 72(3): 1164-1168.
[43] VARTULI J C, SANTIESTEBAN J G, TRAVERSO P, et al. Characterization of the acid properties of tungsten/zirconia catalysts using adsorption microcalorimetry and n-pentane isomerization activity[J]. J Catal, 1999, 187(1): 131-138.
[44] MOREL JP, MARMIER N, HUREL C, et al. Effect of temperature on the acid-base properties of the alumina surface: Microcalorimetry and acid-base titration experiments[J]. J Colloid Interface Sci, 2006, 298(2): 773-779.
[45] FU Y Y, ZHANG L, YUE B, et al. Simultaneous characterization of solid acidity and basicity of metal oxide catalysts via the solid-state NMR technique[J]. J Phys Chem C, 2018, 122(42): 24094-24102.
Acidity and Basicity of Solid Acid Catalysts Studied by Solid-State NMR
,,,*
Department of Chemistry and Shanghai Key Laboratory of Molecular Catalysis and Innovative Materials, Fudan University, Shanghai 200438, China
Solid-state nuclear magnetic resonance (NMR) is an important technique to study the acidity and basicity of solid catalysts. Here we review some research works carried out in our laboratory, including studies on the acidity of metal oxides under different water contents, the acidity and basicity characterization of metal oxides by using acidic and basic probe molecules simultaneously. The investigations extend solid-state NMR technique in qualitative and quantitative studies on the acidity and basicity of solid catalysts.
solid-state nuclear magnetic resonance, adsorbed water molecules, acid-base probe molecules, acidity, basicity
O643
A
10.11938/cjmr20212939
2021-07-29;
2021-09-17
国家自然科学基金资助项目(22088101, 91645201).
* Tel: 021-31243916, E-mail: heyonghe@fudan.edu.cn.

