中性粒细胞百分比与白蛋白比值对慢性阻塞性肺病患者预后判断的价值
袁瑶 黄娟 钟磊 陆建红
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是临床上一种十分常见的慢性呼吸道疾病,其特征为持续的呼吸道症状和不完全可逆气流限制[1]。研究显示,全球患有COPD 的人数超过2.5亿人,给经济带来了沉重负担[2]。为此,临床工作者一直探索可以反映COPD 患者病情严重程度或预后情况的指标,旨在辅助针对性治疗,减少医疗资源浪费,从而改善患者预后。近年来,有研究报道中性粒细胞百分比与白蛋白比值(neutrophil percentage-to-albumin ratio,NPAR)与胰腺癌[3]、急性肾损伤[4]以及脓毒性休克[5]等患者的临床预后密切相关。但目前尚无血NPAR 与COPD 患者预后间研究的报道。故本次研究通过观察COPD 患者入重症监护室(intensive care unit,ICU)时不同水平的NPAR,探讨其在判断COPD 患者短期和长期预后中的价值。现报道如下。
1 资料与方法
1.1 一般资料 回顾性筛选2001 年6 月至2012 年10 月在美国重症监护医学信息数据库中的成年COPD 患者,纳入标准包括:①首次入住ICU 的成年COPD 患者(≥18 周岁);②ICU 住院时间超过24 h患者;排除标准:①入ICU 24 h 内死亡患者;②关键研究资料缺如患者。本次研究共纳入1 418 例患者,其中男性743 例、女性675 例;平均年龄(71.23±12.11)岁;合并症包括:高血压603 例、糖尿病380 例、冠心病363 例、肝硬化43 例、急性呼吸衰竭537 例、急性心肌梗死56 例。
1.2 方法 回顾性选择COPD 患者临床资料,根据患者30 d 预后,分为存活组和死亡组,比较存活组和死亡组患者NPAR 指标的差异;并依据NPAR 水平三分位数将其分三组,运用Kaplan-Meier 生存曲线比较不同NPAR 分组患者间(三组)的累计生存情况;最后建立Cox回归模型以分析入ICU 时不同NPAR 水平与COPD 患者近期和远期临床预后结局的相关性。
1.3 统计学方法 采用Stata 14.0 统计学软件进行分析。正态分布的计量资料以均数±标准差()表示,采用t检验;非正态分布计量资料采用四分位表示,采用Z检验;计数资料比较采用χ2检验。绘制Kaplan-Meier 生存曲线;同时建立Cox回归模型,并得出风险比(hazard ratio,HR)和95%可信区间(confidence interval,CI)。设P<0.05 为差异有统计学意义。
2 结果
2.1 1 418 例COPD 患者随访30 d,死亡357 例,存活组1 061 例,两组的一般情况及临床指标比较见表1。
由表1 可见,与存活组比较,死亡组患者年龄、序贯器官衰竭评分(sequentid organ failwre asses,SOFA)评分、阴离子间隙、NPAR、白细胞、中性粒细胞百分比、血糖及血磷值更高(t分别=-3.78、-5.87、-4.30、-5.35、-3.34、-3.09、-2.03、-3.89,P均<0.05),肝硬化、急性呼吸衰竭及急性心肌梗死比例更高(χ2分别=4.85、37.90、6.16,P均<0.05);而淋巴细胞百分比、血红蛋白及白蛋白值较低(Z=7.83,t分别=3.20、4.29,P均<0.05),总住院时间更短(Z=5.80,P<0.05)。两组间性别、高血压、糖尿病及冠心病比例,血小板、肌酐和血钾以及住ICU 时间比较,差异均无统计学意义(χ2分别=0.14、1.48、0.05、0.38,t分别=1.13、-1.24、-0.94,Z=-1.86,P均>0.05)。
2.2 依据NPAR 水平三分位数将其分为<25.56(n=473)、25.56~31.70(n=473)和>31.70(n=472)三组。Kaplan-Meier 生存曲线分析见图1。
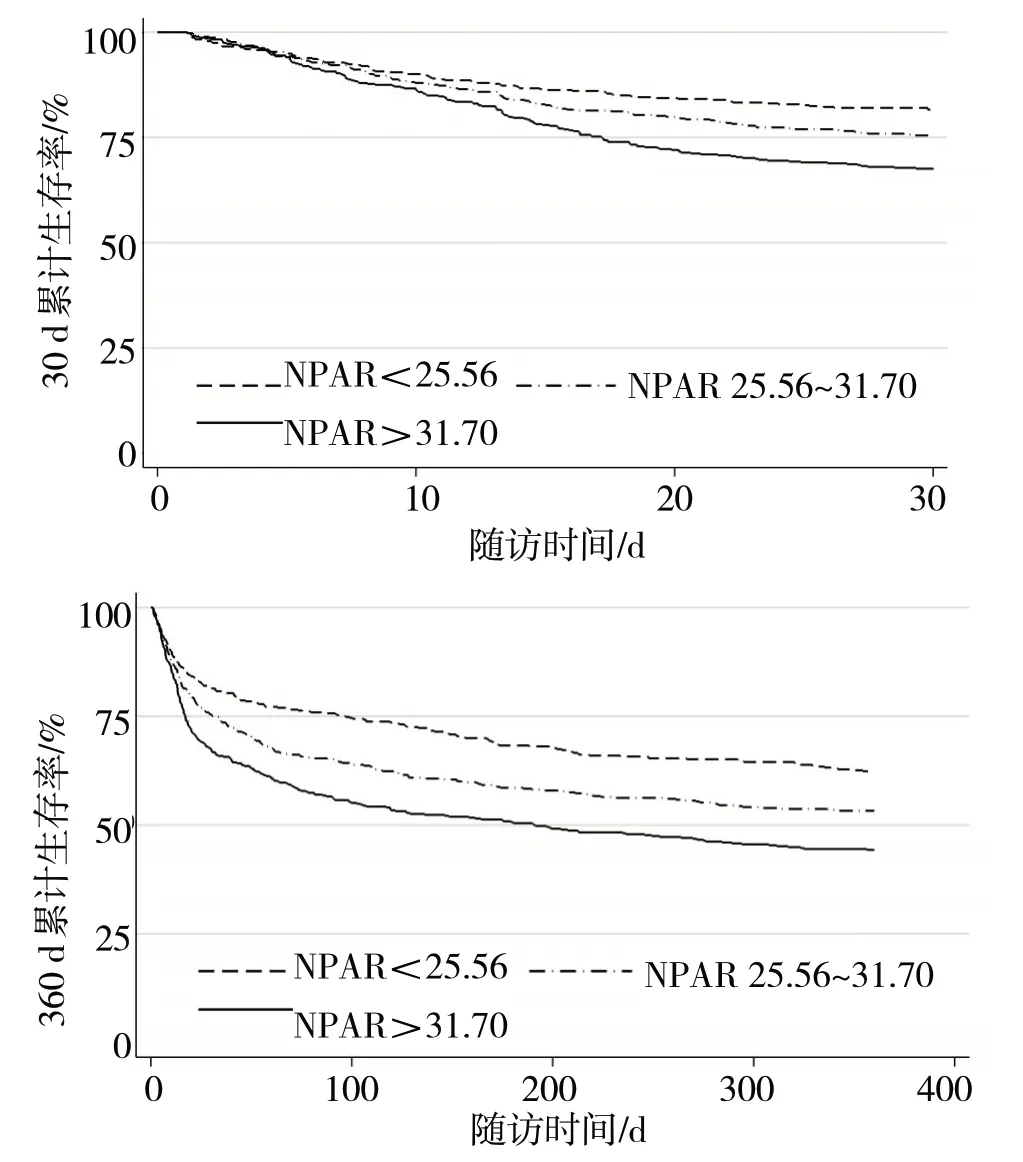
图1 三组间患者30 d和360 dKaplan-Meier生存曲线
由图1 可见,生存曲线显示随着NPAR 水平的上升,COPD 患者的30 d和360 d天累计生存率随之下降,差异均有统计学意义(χ2分别=24.24、34.01,P<0.05)。
2.3Cox回归模型 调整年龄、SOFA 评分、阴离子间隙、白细胞、淋巴细胞百分比、血红蛋白、血糖、血磷、肝硬化、急性心肌梗死、急性呼吸衰竭及总住院时间等因素后,多因素Cox回归模型显示,高水平NPAR(>31.70)是影响COPD 患者近期(HR=1.69,95%CI1.25~2.29,P<0.05)和远期(HR=1.35,95%CI1.08~1.69,P<0.05)死亡的危险因素。
3 讨论
COPD 的危害性很大,它具有患病率高、致残率高和病死率高等特点,严重威胁患者的健康[6]。同时,COPD 也是一种可防治的常见疾病,早期评估其病情严重程度及相应开展针对性治疗对改善此类患者预后有重大意义。目前,临床上多采用问卷、量表、运动试验及肺功能检测等手段来评估COPD的严重程度。但上述评估指标有完成问卷耗时长、问卷过程中患者主观性强、急性期COPD 患者对运动试验及肺功能检测受限等缺陷。因此,一项简便、客观、对受试者限制性小且可预测COPD 患者预后的指标很有必要。
临床工作者们一直在寻找预测COPD 的疾病严重程度或不良临床预后结局的指标或评估工具,如血小板淋巴细胞比率、中性粒细胞淋巴细胞比值[7]及DECAF 评分[8]等。研究显示,在COPD 发生发展过程中,中性粒细胞作为一种关键效应细胞,它可聚集于感染部位,同时释放多种炎性因子(如白介素-8,肿瘤坏死因子等)[9]。在COPD 患者痰液中的中性粒细胞活化标记物、乳铁蛋白和髓过氧化物酶水平均有所上升,表明其参与且活化气道炎症反应,从而使病情加重[10]。白蛋白除了是一个反应营养不良的指标外,还具有抗氧化特性;另外,它是一种负相的急性期蛋白,在急性期反应时其浓度会下降。研究显示,低白蛋白血症与COPD 急性加重期间住院时间延长、急性呼吸衰竭和死亡率增加存有关联,是一项潜在的预测COPD 预后的指标[11]。因此,NPAR 指标将中性粒细胞与白蛋白联合起来,可能作为一项预测COPD 患者不良临床结局的潜在新指标。
本次研究结果显示,死亡组COPD 患者NPAR较存活组更高。Kaplan-Meier 生存曲线显示,随着NPAR水平的上升,此类患者30 d和360 d累计生存率随之下降。多因素Cox比例风险回归分析显示,高水平NPAR(>31.70)是影响COPD 患者近期和远期死亡的危险因素,表明NPAR 作为一种新型血清学炎症指标,可用于评估COPD 的严重程度或不良预后。
2020 年,一项纳入2 166 例严重脓毒症或脓毒症休克患者的回顾性研究显示,随着血NPAR 水平的上升,这类患者30 d、90 d 和365 d 全因死亡率均总体呈现上升趋势,且高水平NPAR(≥34.40)是影响此类患者死亡的独立危险因素[12]。除此之外,NPAR 在呼吸系统疾病的预测方面也有相关的研究。近期,一项关于新型冠状病毒肺炎患者的研究报道,与轻型患者比较,重型患者的中性粒细胞计数与白蛋白比值(neutrophil count to albumin ratio,NAR)显著增高,且NAR 预测这类患者死亡的最佳临界值为201.5[13]。总之,诸多研究显示了NPAR 指标在预测多种疾病不良预后中的价值。
综上所述,NPAR 是一种计算简单、经济有效的新型炎症标志物。入ICU 时高水平NPAR 值与COPD 患者不良预后密切相关,对此类患者近期和远期不良临床结局具有一定的预测价值。但本次研究是一项回顾性观察性单中心研究,且研究人群来自国外。因此,在未来需要前瞻性、多中心的国内研究加以证实。

