MRI-FLAIR序列高信号血管征对急性脑梗死的应用价值研究
陈少云 虞海卓 杨慧强 吴张平 宋大桥 商发科
近年来,随着人口老龄化和饮食习惯的改变,脑梗死已成为我国居民死亡的首要原因,且其发病率仍在不断升高[1]。随着核磁共振成像技术的快速发展和临床应用,研究人员不仅可以观察脑梗死的形态变化,而且可以提高对病理过程和分子改变的理解[2,3]。MRI-FLAIR 序列对于评估脑实质和蛛网膜下腔病变具有高度的敏感性和特异性。在部分严重脑血管病变及早期脑梗死患者脑动脉走行的脑沟裂内时常出现类似血管的异常高信号,即高信号血管征(hyperintense vessel sign,HVS)[4]。HVS 与脑梗死的发生及发展密切相关,探讨其在脑梗死局部脑组织的病理生理中的变化情况,为临床指导脑梗死的治疗及预后评估提供参考。现报道如下。
1 资料与方法
1.1 一般资料 选取2018 年8 月至2021 年1 月期间义乌市中医医院收治的急性脑梗死住院患者100 例为研究对象,其中男性62 例、女性38 例;年龄(62.72±11.51)岁,体重指数(23.59±3.24)kg/m2。均行常规颅脑MRI 扫描(包括FLAIR 序列)及3DTOF MRA 扫描(时间飞跃MRA,以获取脑血管狭窄相关信息)。所有患者均符合急性脑梗死诊断标准,在入院48 h 内进行头部MRI 检查,包括(T1WI、T2WI、DWI、T2-FLAIR、SWI)序列;患者均首次发病,且病程<1 周;所有患者或家属对本次研究均知情同意。并剔除:①有脑梗死病史者;②接受过静脉溶栓或急诊动脉取栓者;③心源性栓塞者;④合并严重心、肝、肾等系统性疾病者。
1.2 诊断方法 由2 位资深医师和1 位影像医师共同做出诊断,HVS 判断标准:①T2 FLAIR 像上在外侧裂池、脑沟或临近脑表面的斑点状、管状或蛇纹状高信号;②T2WI 像上在对应位置呈流空信号;③参照DWI 像,排除分布于脑沟附近的皮层梗死;④参照T1 FLAIR 像,排除临近层面脑皮层容积效应;符合以上4 条即认定HVS 阳性(见图1),否则为阴性(见图2)。
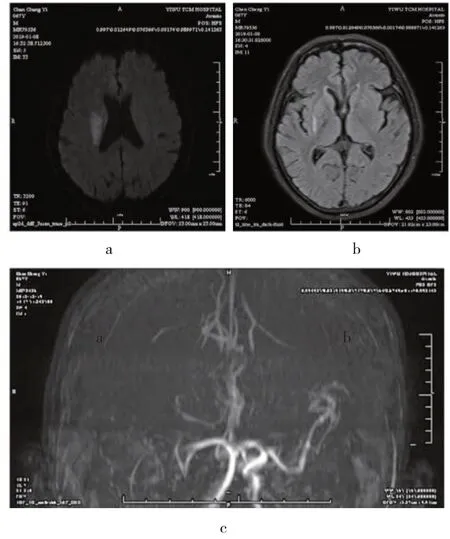
图1 HVS征阳性
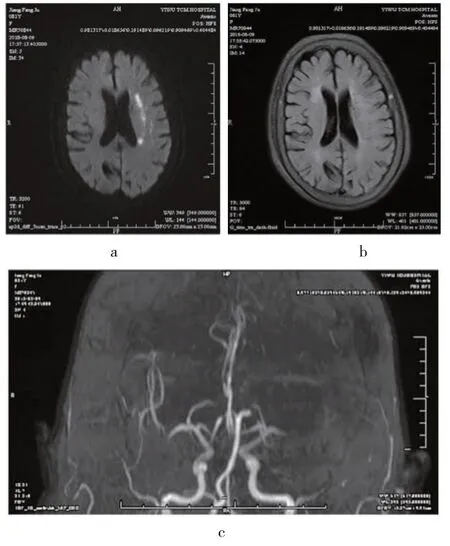
图2 HVS征阴性
1.3 检测指标 ①血管狭窄程度:采用NASCET 标准测量责任侧血管狭窄程度,并分4 级:轻度狭窄(动脉内径缩小<30%)、中度狭窄(30%~69%)、重度狭窄(70%~99%)以及完全闭塞。本次研究将轻度狭窄和中度狭窄归为轻中度狭窄组,而将重度狭窄和闭塞归为重度狭窄闭塞组,比较两组血管狭窄程度与HVS 发生率。②比较HVS 阳性组和HVS 阴性组脑梗死面积、神经功能及预后情况;采用ASPECT 评分法对梗死区面积进行评分。完全正常10 分,完全受累为0 分,每梗塞一个区域减一分。采用美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评分系统比较患者早期神经功能恢复情况(入院时与入院10~14 d时NIHSS 评分的差值)。采用改良的Rankin 评分评估患者出院30 d的预后情况,分值越高,预后越差。
1.3 统计学方法 采用SPSS 22.0 软件进行统计学处理。采用Spearmen分析进行相关性分析。计数资料采用χ2检验;计量资料以均数±标准差()表示,采用t检验,采用logistic回归分析HVS 阳性的影响因素。设P<0.05 为差异有统计学意义。
2 结果
2.1 血管狭窄程度与HVS 发生率比较 100 例急性脑梗死患者中,轻中度狭窄62 例,重度狭窄闭塞38 例,HVS 阳性35 例,HVS 阴性65 例。其中重度狭窄闭塞组HVS 阳性为86.84%,明显高于轻中度狭窄组的HVS 阳性率(3.23%),差异有统计学意义(χ2=76.37,P<0.05)。
2.2 血管狭窄程度与HVS 的相关性Spearman分析显示,HVS 与血管狭窄不同程度呈正相关(r=0.84,P<0.05)。
2.3 HVS 与脑梗死面积、神经功能及预后的关系见表1
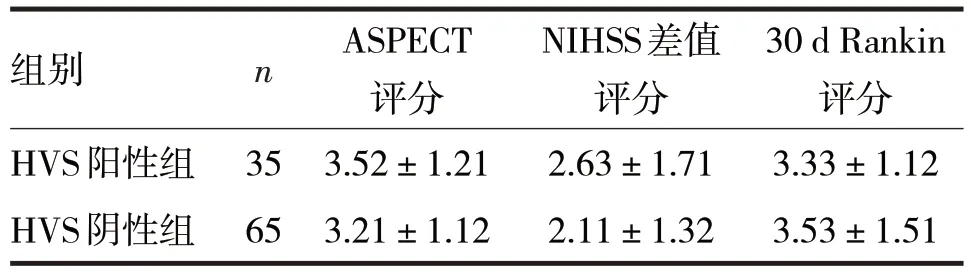
表1 HVS与脑梗死面积、神经功能及预后的关系/分
由表1 可见,HVS 阳性组ASPECT 评分、入院时与入院10~14 d 时NIHSS 评分的差值、30 d Rankin评分与HVS 阴性组比较,差异均无统计学意义(t分别=1.26、1.64、0.69,P均>0.05)。
2.4 HVS阳性的单因素分析见表2
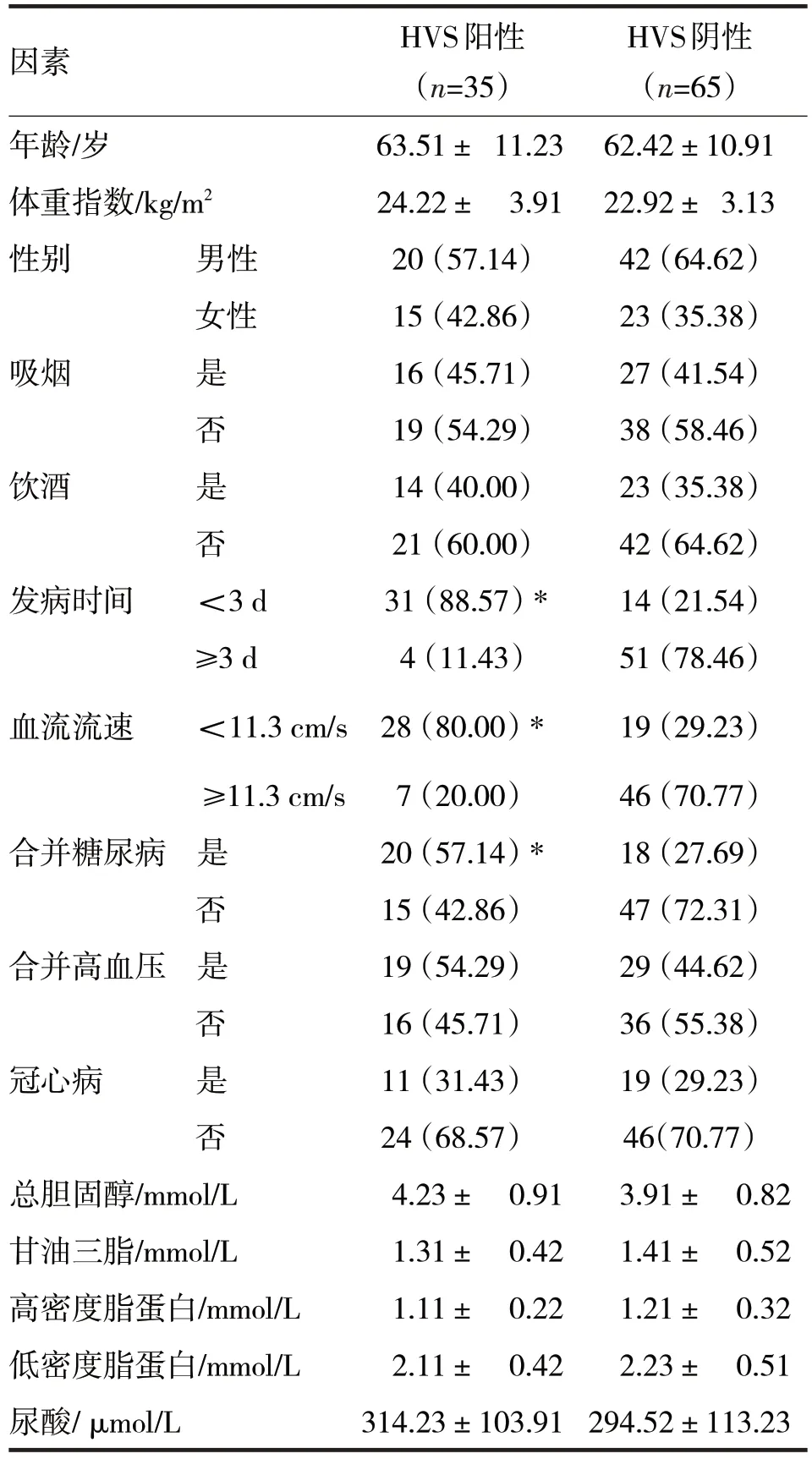
表2 HVS阳性的单因素分析
由表2 可见,HVS 阳性组患者发病时间<3 d、动脉血流流速<11.3 cm/s 以及合并糖尿病的比例均高于HVS 阴性组(χ2分别=41.30、23.54、8.38,P均<0.05),两组在年龄、体重指数、总胆固醇、甘油三脂、高密度脂蛋白、低密度脂蛋白、尿酸水平,和性别、吸烟、饮酒、合并高血压、冠心病比例方面比较,差异均无统计学意义(t分别=0.45、1.82、1.71、1.02、1.77、1.02、0.85,χ2分别=0.54、0.16、0.21、0.85、0.05,P均>0.05)。
2.5 HVS阳性的影响因素logistic回归分析见表3

表3 HVS阳性的影响因素logistic回归分析
由表3 可见,经logistic回归分析HVS 阳性的影响因素表明,发病时间<3 d、血流流速<11.3 cm/s和合并糖尿病是急性脑梗死患者HVS 阳性的影响因素(P均<0.05)。
3 讨论
HVS 可出现于多种脑血管疾病中,表示大脑局部血流动力学的异常改变。同时,HVS 在缺血性脑病中有重要的临床意义,对严重的脑血管狭窄或闭塞有较高的阳性预测值,且具有较长诊断时效性。
自HVS 发现以来,大量学者及临床工作者围绕HVS 在急性脑梗死的临床应用作了大量的研究。Maeda等[5]研究指出,在患者脑梗死发生24 h、1~4 d、5~9 d 后,HVS 的发生率分别为100%、40%、18%,由此可见,HVS 在急性脑梗死发生中扮演重要角色。HVS 分级与脑梗死ASPECTS 评分呈反比,即HVS 分级越高,脑梗死病情的发展相对较缓慢[6]。HVS 对预测颅脑大动脉闭塞或重度狭窄灵敏度和特异度较高[7,8]。本次研究结果显示,重度狭窄闭塞组HVS 阳性明显高于轻中度狭窄组(P<0.05)。通过Spearman分析表明,HVS 与血管狭窄不同程度呈正相关(P<0.05)。表明HVS 可能与脑梗死患者的预后密切相关。Liu 等[9]通过探讨颈内动脉狭窄患者经治疗后其HVS 变化情况发现,患者临床症状得到改善的同时其颅内HVS 明显减少或消失,认为HVS 可能对预测患者局部脑血流动力学的改变。可见HVS 征象对于急性脑梗死的治疗方案、预后评估以及判断脑内动脉的狭窄程度程度有较大临床价值。
另外,本次研究HVS阳性组ASPECT评分、入院时与入院10~14 d 时NIHSS 评分的差值、30 d Rankin 评分与HVS 阴性组比较,差异均无统计学意义(P均>0.05),与文献报告有所不同[6],这可能与本次研究来源区域或人种有关,仍需加大样本量作更加深入的研究进一步明确区域患者的HVS 征象与患者预后之间相关性。
目前,HVS 的发生机制虽然尚未完全了解,但受到多种因素的影响。HVS 常发生在脑梗死的早期阶段,并在随后的干预中其发生率逐渐降低。Maeda 等[5]研究表明HVS 的发生率随着病情的发展不断降低。本次研究通过logistic回归分析发现,发病时间<3 d 是HVS 阳性的影响因素。表明HVS 具有时间依赖性,并随着时间的增加呈下降趋势,这可能与血动脉及侧支循环血流状态有关。可能是因急性期或亚急性期脑梗死侧支循环代偿或治疗后血管再通,病变区血流加快,使得HVS 逐渐消失。本次研究还发现,血流流速<11.3 cm/s 是HVS 的影响因素。动脉血流缓慢是HVS 的形成原因,随着血流流速减慢,HVS 信号在一定范围内逐渐明显[10]。Ahn 等[11]研究也得出相似结果,发现HVS 信号强度随着流速升高逐渐下降。糖尿病是诱导心脑血管疾病发生的独立危险因素,其可引起机体糖脂质代谢异常,脂质堆于血管内壁,导致小动脉粥样硬化,同时患者常处于高血糖状态下血管内皮细胞容易受到损伤,血小板聚集受损的内皮细胞上,造成血管狭窄,而血液流经狭窄的脑动脉时,会导致其速度变慢,诱导HVS发生。
综上所述,HVS 阳性与脑梗死相关血管狭窄及血流速度降低的严重程度有较高的一致性,可能是脑梗死加重的预测指标,提示临床医生并尽早干预治疗,对于急性脑梗死的救治有指导意义。此外,发病时间<3 d,血流流速<11.3 cm/s 和合并糖尿病是HVS阳性的影响因素。

