柴胡皂苷对热诱导的奶牛乳腺上皮细胞抗氧化能力和热休克蛋白基因表达的影响
胡海涛 孙先枝 黄 峰 王青峰 李晶晶 卓 钊 范彩云 苏衍菁 程建波**
(1.安徽农业大学动物科技学院,合肥 230036;2.上海城建职业学院,上海 201415;3.光明牧业有限公司,上海 200436)
热应激(HS)一直是困扰我国奶牛生产的主要问题,阐明热应激对奶牛机体影响的机制并找出相应的缓解措施是当前研究的热点。研究表明,夏季热应激可能通过改变奶牛乳腺组织物质代谢而影响泌乳量和乳成分[1]。Li等[2]在体外建立奶牛乳腺上皮细胞(BMECs)热应激模型,运用微阵列分析鉴定出2 716个基因在热应激和正常BMECs中差异表达,这些差异表达基因参与调控细胞骨架、细胞周期和应激反应等。热应激可诱导氧化应激,机体内产生大量的活性氧自由基(ROS),引发脂质过氧化而使组织和细胞受到损伤[3-4]。权素玉等[5]发现热应激可显著降低BMECs的存活率,引起细胞氧化应激。胡菡等[6]研究发现,42 ℃热处理0.5 h后BMECs中热休克转录因子-1(HSF-1)、热休克蛋白27(HSP27)、热休克蛋白70(HSP70)mRNA表达上调,其中HSP70 mRNA表达量在短时间内迅速升高。热应激引起的ROS水平升高导致母畜乳腺组织发生氧化损伤,乳腺功能下降是影响泌乳量的重要因素[7]。因此,如何缓解热应激对奶牛乳腺造成的氧化应激以提高乳腺功能,已成为畜牧工作者急需解决的问题。
近年来,国内外关于中草药和植物提取物缓解奶牛热应激的报道众多。Wang等[8]研究表明,黄芪甲苷预处理牛乳腺上皮细胞(MAC-T)能有效抑制细胞内ROS水平的升高和细胞凋亡率。在人医临床上,柴胡是一种普遍使用的解热药,已被证明具有很好的解热疗效[9]。柴胡中的主要活性成分包括柴胡皂苷类、挥发油和多糖等[10],柴胡皂苷及水解后的皂苷元是主要的解热物质[11]。金国泰等[12]发现柴胡皂苷对大鼠的发热反应可起到明显降温作用。有大量研究发现柴胡皂苷能够发挥抗炎抗肿瘤活性,可通过降低过氧化氢(H2O2)诱导的细胞外调节蛋白激酶(ERK)、应激活化蛋白激酶(JNK)和p38丝裂原活化蛋白激酶(p38MAPK)磷酸化而有效降低氧化应激损伤,提高细胞在应激状态下的存活率[13-14]。柴胡皂苷具有较强的抗氧化功能,可显著抑制ROS和丙二醛(MDA)的产生,增强超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶的活性[15]。在本课题组的前期研究中,在饲粮中添加柴胡提取物饲养热应激奶牛,发现适当剂量的柴胡提取物可降低奶牛直肠温度,提高热应激奶牛的舒适度,增加奶牛干物质采食量,进而提高泌乳性能,改善乳品质[16-17]。然而,柴胡提取物中是哪种物质发挥有效作用尚不清楚。因此,为进一步明确柴胡提取物中具有缓解奶牛热应激的有效物质是否为柴胡皂苷a(SSa)和柴胡皂苷d(SSd)及深入探究其作用机制,本试验建立体外热应激BMECs模型,探讨SSa和SSd对热诱导的BMECs氧化应激的保护作用及对热休克蛋白基因表达的影响,为研制抗氧化及缓解奶牛热应激的饲料添加剂提供科学依据。
1 材料与方法
1.1 主要试剂及仪器

1.2 试验方法
1.2.1 细胞培养及试验设计
以含10% FBS的DMEM/F12培养基悬浮BMECs,置于38 ℃、5% CO2培养箱中培养至细胞长到80%~90%时,用0.25%胰酶消化细胞,并以1×104个/cm2的数量接种于6孔板中。阴性对照组:在接种BMECs的6孔板中加入含10% FBS的DMEM/F12培养基,于38 ℃、5% CO2培养箱中培养24 h。阳性对照组:在接种BMECs的6孔板中加入含10% FBS的DMEM/F12培养基,于42 ℃、5% CO2培养箱中分别培养1、4、8、12和24 h。处理组:BMECs在含0.1、1.0 μmol/L SSa或0.01、0.10 μmol/L SSd的诱导培养基中38 ℃培养4 h(SSa和SSd作用细胞时间)后,42 ℃分别处理1、4、8、12和24 h,每个处理3个重复。
1.2.2 细胞中抗氧化物酶活性的测定
收集细胞和培养液,采用比色法测定阴性对照组、阳性对照组和各处理组BMECs中SOD、GSH-Px、CAT活性和培养液中MDA含量,分别在560、420、405和532 nm处检测吸光度(OD)值。
1.2.3 实时荧光定量PCR(RT-qPCR)检测BMECs中热休克蛋白基因表达


表1 引物序列Table 1 Primer sequences
1.3 数据分析
采用2-△△Ct法对BMECs热休克蛋白基因表达进行相对定量分析。试验数据采用SAS 9.2软件中的GLM进行分析。采用Duncan氏法进行均值多重比较,试验结果以“平均值±标准误”表示,P<0.05为差异显著。
2 结果与分析
2.1 热诱导对BMECs抗氧化能力的影响
42 ℃热诱导对BMECs中抗氧化酶活性及培养液中MDA含量的影响见表2。在阳性对照组中,BMECs中SOD和GSH-Px活性均显著低于阴性对照组(P<0.05);BMECs中CAT活性在热诱导1、4和8 h时较正常培养条件下的阴性对照组未发生显著变化(P>0.05),在热诱导12和24 h时则显著低于阴性对照组(P<0.05)。当42 ℃培养24 h时,BMECs培养液中MDA含量急剧上升,显著高于阴性对照组(P<0.05)。
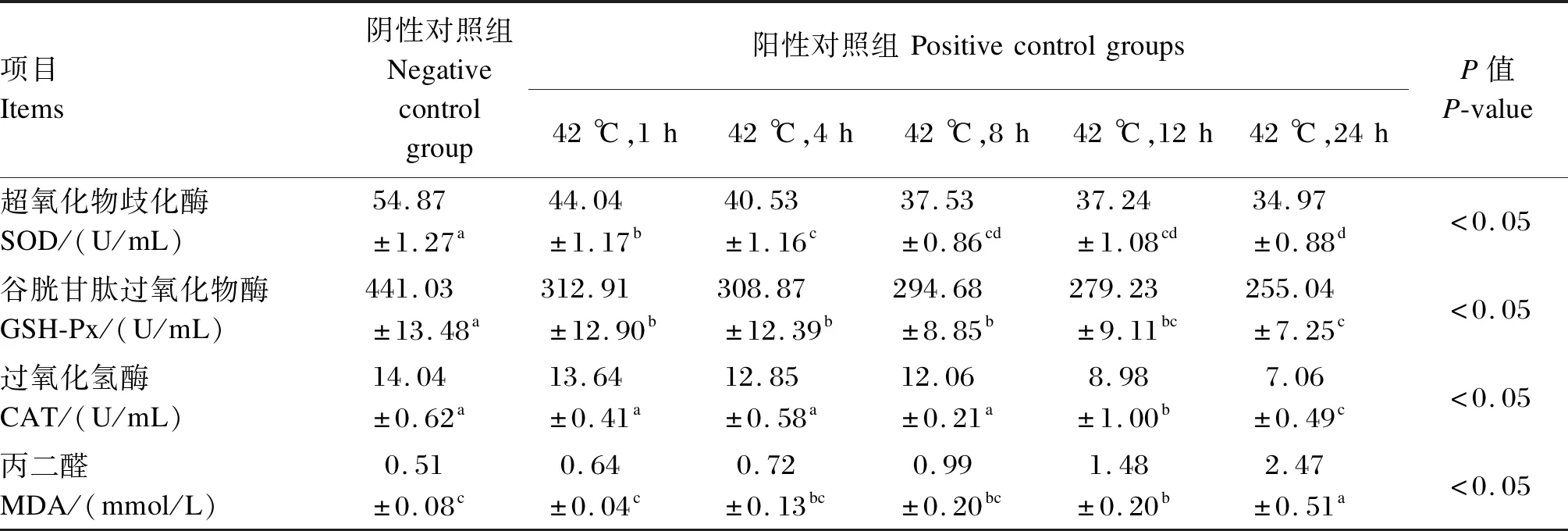
表2 热诱导对BMECs中抗氧化酶活性及培养液中MDA含量的影响Table 2 Effects of heat induction on activities of antioxidant enzymes and content of MDA in culture medium
2.2 SSa和SSd对热诱导的BMECs氧化应激的缓解
2.2.1 SSa和SSd对热诱导的BMECs中SOD、GSH-Px和CAT活性的影响
不同浓度的SSa和SSd对热诱导的BMECs中SOD活性的影响见表3。与相同热诱导时间的阳性对照组相比,在热诱导1 h时,0.1、1.0 μmol/L SSa和0.10 μmol/L SSd处理组BMECs中SOD活性显著提高(P<0.05);在热诱导4 h时,0.1 μmol/L SSa处理组BMECs中SOD活性显著提高(P<0.05);在热诱导8 h时,0.1 μmol/L SSa对BMECs中SOD活性无显著影响(P>0.05),但1.0 μmol/L SSa和0.01、0.10 μmol/L SSd可使BMECs中SOD活性显著降低(P<0.05);在热诱导24 h时,各处理组BMECs中SOD活性均显著降低(P<0.05)。
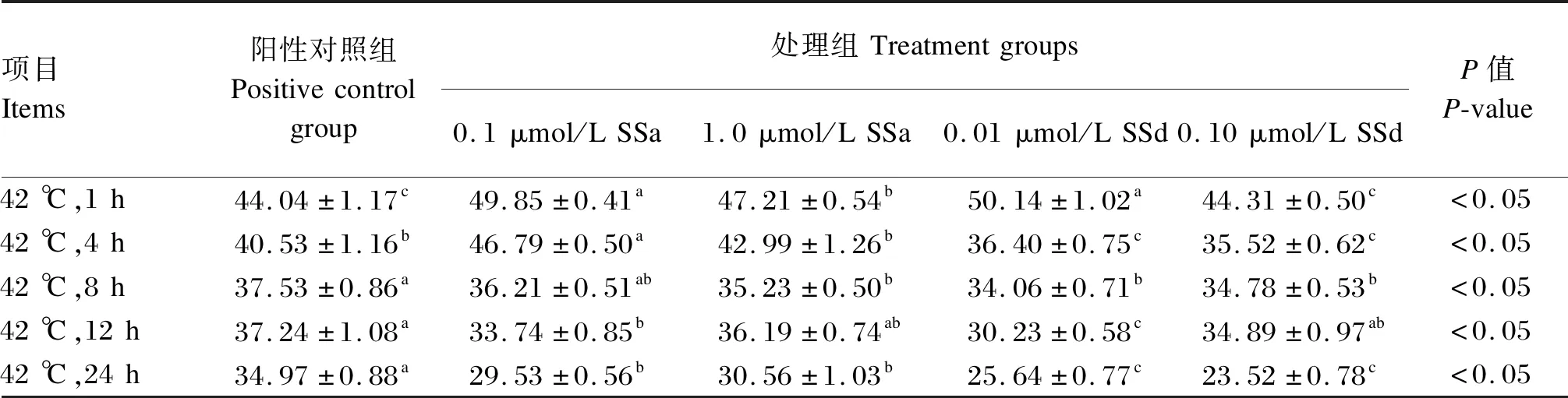
表3 不同浓度SSa和SSd对热诱导的BMECs中SOD活性的影响 Table 3 Effects of different concentrations of SSa and SSd on SOD activity in heat induced BMECs U/mL
不同浓度SSa和SSd对热诱导的BMECs中GSH-Px活性的影响见表4。与相同热诱导时间的阳性对照组相比,在热诱导1 h时,1.0 μmol/L SSa和0.01、0.10 μmol/L SSd处理组BMECs中GSH-Px活性显著提高(P<0.05);在热诱导4 h时,任意浓度的SSa和SSd均能显著提高BMECs中GSH-Px活性(P<0.05);在热诱导12和24 h时,0.01 μmol/L SSd组BMECs中GSH-Px活性显著提高(P<0.05),而1.0 μmol/L SSa处理组BMECs中GSH-Px活性则显著降低(P<0.05)。
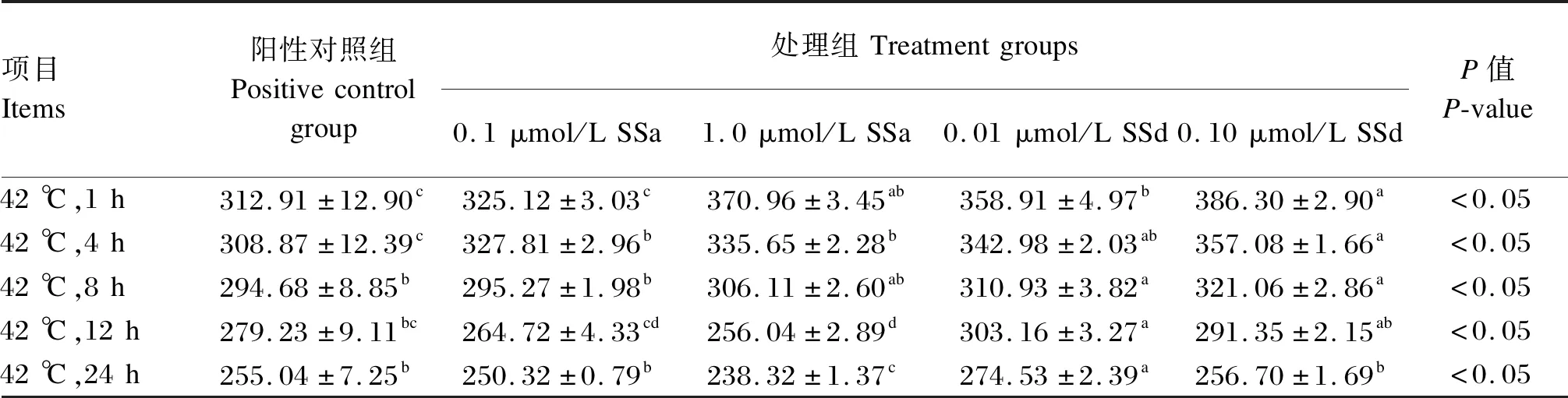
表4 不同浓度SSa和SSd对热诱导的BMECs中GSH-Px活性的影响Table 4 Effects of different concentrations of SSa and SSd on GSH-Px activity in heat induced BMECs U/mL
不同浓度SSa和SSd对热诱导的BMECs中CAT活性的影响见表5。与相同热诱导时间的阳性对照组相比,0.01 μmol/L SSd在热诱导1 h时显著提高了BMECs中CAT活性(P<0.05);在热诱导4 h时,1.0 μmol/L SSa处理组BMECs中CAT活性显著提高(P<0.05);在热诱导8 h时,0.1 μmol/L SSa和0.01 μmol/L SSd处理组BMECs中CAT活性显著提高(P<0.05),而1.0 μmol/L SSa和0.10 μmol/L SSd处理组BMECs中CAT活性则显著降低(P<0.05)。

表5 不同浓度SSa和SSd对热诱导的BMECs中CAT活性的影响Table 5 Effects of different concentrations of SSa and SSd on CAT activity in heat induced BMECs U/mL
2.2.2 不同浓度SSa和SSd对热诱导的BMECs培养液中MDA含量的影响
不同浓度SSa和SSd对热诱导的BMECs培养液中MDA含量的影响见表6。与相同热诱导时间的阳性对照组相比,在热诱导1和8 h时,任意浓度的SSa和SSd对培养液中MDA含量均无显著影响(P>0.05);在热诱导12 h时,0.10 μmol/L SSd显著提高了培养液中MDA含量(P<0.05);在热诱导24 h时,0.01 μmol/L SSd显著降低了培养液中MDA含量(P<0.05)。

表6 不同浓度SSa和SSd对热诱导的BMECs培养液中MDA含量的影响 Table 6 Effects of different concentrations of SSa and SSd on MDA content in culture medium of heat induced BMECs mmol/L
2.3 SSa和SSd对热诱导的BMECs中热休克蛋白基因表达的影响
如图1所示,在42 ℃热诱导条件下,BMECs中HSF-1和HSP70 mRNA相对表达量较阴性对照组在不同热诱导时间下均显著上调(P<0.05),并且随着热诱导时间的延长而呈现先增加后降低的趋势,在热诱导4 h后相对表达量不再升高,但与阴性对照组相比仍然显著上调(P<0.05),直至热诱导24 h时。在热诱导8 h时,0.1 μmol/L SSa处理组BMECs中HSF-1 mRNA相对表达量较阳性对照组显著提高(P<0.05);任意浓度的SSa和SSd在热诱导12 h时对BMECs中HSF-1 mRNA相对表达量均无显著影响(P>0.05)。
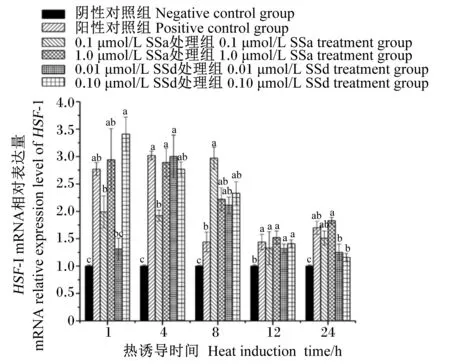
数据柱标不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。图2同。Data columns with different small letters indicated significant difference (P<0.05),while with the same small letters indicated no significant difference (P>0.05).The same as Fig.2.图1 不同浓度SSa和SSd对热诱导的BMECs中HSF-1 mRNA相对表达量的影响Fig.1 Effects of different concentrations of SSa and SSd on mRNA relative expression level of HSF-1 in heat induced BMECs
如图2所示,与阴性对照组相比,在热诱导1 h时,任意浓度的SSa和SSd均能够显著提高BMECs中HSP70 mRNA相对表达量(P<0.05);在热诱导4和8 h时,0.1 μmol/L SSa和0.10 μmol/L SSd能够显著提高BMECs中HSP70 mRNA相对表达量(P<0.05);在热诱导12和24 h时,0.01 μmol/L SSd处理组BMECs中HSP70 mRNA相对表达量显著升高(P<0.05)。
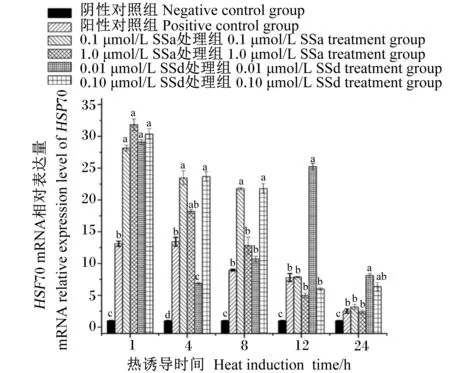
图2 不同浓度SSa和SSd对热诱导的BMECs中HSP70 mRNA相对表达量的影响Fig.2 Effects of different concentrations of SSa and SSd on mRNA relative expression level of HSP70 in heat induced BMECs
3 讨 论
3.1 热处理对BMECs抗氧化能力的影响
热应激会引起机体代谢增强,产生过量的ROS而发生氧化应激[18-19]。机体内存在一套复杂的抗氧化防御系统,SOD是重要的内源性抗氧化物酶,SOD催化ROS生成H2O2和氧气(O2)[20],GSH-Px和CAT进一步将H2O2分解生成H2O和O2,从而使细胞免受氧化应激损伤[21-22]。MDA是脂质过氧化的终产物,通常用MDA含量来评价脂质过氧化的程度[23]。本试验结果表明,在阳性对照组BMECs中SOD和GSH-Px活性较阴性对照组显著降低,热诱导8 h时,BMECs中CAT活性也显著降低。随着热诱导时间的延长,BMECs培养液中MDA含量逐渐增加,在42 ℃处理24 h时,培养液中MDA含量达到最大值,表明42 ℃热处理能够诱导BMECs发生氧化应激。
3.2 SSa和SSd对热诱导的BMECs抗氧化能力的影响
研究表明,植物提取物不仅对动物的免疫功能发挥调控作用,还能通过减少ROS的产生而作为抗氧化剂使用[24-25]。关于柴胡皂苷的药理作用的研究发现,SSa和SSd具有抗炎、抗肿瘤、抗氧化应激、抑制细胞凋亡等作用[13]。基于纯化的柴胡皂苷单体的研究表明,SSa[26]和SSd[27]可提高细胞抗氧化能力,清除ROS,抑制脂质过氧化。Chen等[28]研究发现,小鼠腹腔注射SSa能够缓解香烟烟雾引起的小鼠肺脏组织损伤,抑制MDA的生成,且激活肺组织中与氧化应激相关的核因子E2相关因子2(Nrf2)信号通路。SSa具有良好的抗炎和抗氧化作用,SSa可显著抑制脂多糖诱导的人脐静脉内皮细胞ROS的产生及炎症因子的表达[29]。何燕等[30]研究表明,SSd可显著降低肝纤维化大鼠血清和肝脏中MDA的含量,缓解大鼠的脂质过氧化现象。SSd能够通过抑制MDA的产生和提高SOD的活性来发挥抗氧化作用,减轻四氯化碳(CCl4)诱导的急性肝细胞损伤[31]。GSH-Px是具有一种较强的抗氧化应激作用的酶,可提高细胞抗氧化和清除自由基的能力,保护细胞免受氧化应激损伤。李素婷等[32]研究发现,培养基中添加不同浓度的SSd可以缓解乙醇诱导的原代大鼠肝细胞损伤,显著提高细胞中GSH-Px活性,增强细胞抗氧化能力。SSd显著降低H2O2诱导的大鼠肾上腺嗜铬细胞(PC12)MDA的释放,提高SOD活性和总抗氧化能力,并且SSd能够抑制ROS积累,阻断丝裂原活化蛋白激酶(MAPK)依赖性氧化损伤而缓解H2O2诱导的细胞凋亡[33]。热应激奶牛生产试验结果表明,饲粮中添加柴胡提取物可降低奶牛直肠温度,改变奶牛血液代谢,提高热应激奶牛产奶量和乳蛋白产量,降低乳中体细胞数[17]。本试验结果表明,与阳性对照组相比,培养基中添加任意浓度的SSa均能够显著提高热诱导1 h时BMECs中SOD活性;在热诱导4、8和24 h时,0.1 μmol/L SSa组BMECs中CAT活性较阳性对照组显著提高;培养基中添加0.01 μmol/L SSd在热诱导1、4、8、12和24 h时均能显著提高BMECs中GSH-Px活性。上述结果表明适宜浓度的SSa和SSd可以通过提高BMECs中抗氧化酶活性而增强抗氧化能力。在热诱导24 h时,0.01 μmol/L SSd显著降低了BMECs培养液中MDA含量。本研究中所利用的细胞模型与上述研究不同,但本质都是探究SSa和SSd对细胞抗氧化能力的影响,本试验证明较低剂量的SSa(0.1 μmol/L)和SSd(0.01 μmol/L)对热诱导的BMECs氧化应激有较好的缓解作用,可能是由于SSa和SSd能够增强BMECs中抗氧化物酶的活性并且抑制脂质过氧化作用。
研究表明,柴胡皂苷的药理学和毒理学效应与剂量相关[34],腹腔注射较大剂量的SSa后小鼠出现毒性反应[35]。Chen等[36]研究了SSd对人肝细胞的毒性作用,结果表明,SSd呈剂量依赖性抑制细胞活力,0.4 μmol/L SSd显著抑制细胞增殖,该浓度下细胞线粒体膜电位降低,B淋巴细胞瘤-2(Bcl-2)基因表达下调,标志细胞凋亡的Bcl-2相关X蛋白(Bax)基因表达上调。SSa会以剂量依赖的方式增加表皮角质细胞(HEKa)中ROS的产生,降低线粒体膜电位,诱导HEKa凋亡[37]。Wang等[38]也发现,10 μmol/L SSa会诱导癌细胞产生ROS,导致细胞凋亡,且SSa较SSd细胞毒性更强。研究发现,长时间、多次为大鼠灌服柴胡皂苷粗提物会导致大鼠肝脏毒性损伤,且损伤途径与氧化损伤机制有关[39]。本试验结果表明,在热诱导12和24 h时,培养基中添加1.0 μmol/L SSa和0.10 μmol/L SSd对BMECs中SOD、GSH-Px和CAT活性无显著改善作用,或者显著降低了以上抗氧化酶的活性,说明高浓度的SSa和SSd可能会对细胞产生毒性作用。在热诱导12 h时,0.10 μmol/L SSd组培养液中MDA的含量显著升高,表明SSa和SSd对BMECs氧化应激的缓解作用存在剂量依赖性,较高浓度的SSa或SSd可能会随着热处理时间的延长对BMECs产生不利影响。本研究进一步证实了SSa和SSd 既是柴胡发挥功效的主要化学单体成分,又是其产生毒性的主要物质基础。
3.3 SSa和SSd对热诱导的BMECs中热休克蛋白基因表达的影响
热休克反应是细胞应对高温的适应性机制,对于热应激下细胞的存活至关重要[40],若不及时采取缓解措施,持续热应激会导致细胞死亡。在体外,暴露于高温环境会导致BMECs增殖停滞并诱导细胞凋亡[41]。HSF-1是调节热休克蛋白(HSPs)基因表达的关键转录因子,在细胞遭受热应激时,HSF-1启动转录过程,促进HSPs的表达,从而对错误折叠蛋白进行修复,提高细胞抵抗热应激的能力[42-43]。HSPs的大量表达是热应激状态下一种重要的内源性保护机制,HSF-1和HSPs表达的上调可增强细胞的稳定性,并在热应激条件下形成耐热性[41]。本试验结果表明,在42 ℃热处理下,BMECs中HSF-1和HSP70基因的表达均显著上调,并且随着热处理时间的延长而呈现先增加后降低的趋势,表明BMECs在热处理条件下启动了HSPs的内源性保护机制,并且BMECs产生了热耐受性。
Guo等[44]研究发现,HSP70可通过调节GSH-Px的活性以应对氧化应激,并且提出这可能是HSPs在应激状态下发挥保护细胞功能的一种作用机制。Choi等[45]探讨HSP70与抗氧化酶的关系时发现,敲除HSP70基因后小鼠中SOD活性和SOD蛋白表达水平与对照组小鼠相比显著降低,推测HSP70可能通过转录水平或转录后修饰参与了SOD的表达调控。HSPs可通过调节细胞的氧化状态来保护细胞免受热和氧化应激的损伤,同时,一些外源性的添加物有助于调控热休克相关基因的表达,从而改善细胞的抗氧化能力[46]。天然植物来源的化合物可能通过其生物和药理活性来诱导应激条件下HSPs的表达,从而增强机体或者细胞在应激状态下的抗氧化能力[47]。Zhang等[48]用SSd处理高温诱导的猪肾近端小管上皮细胞,HSP72 mRNA和蛋白表达均显著增加,且呈剂量依赖性。本试验中,在热诱导1 h时,0.01 μmol/L SSd能显著提高BMECs中HSP70 mRNA相对表达量,同时BMECs中SOD和GSH-Px活性较阳性对照组显著升高;在热诱导12和24 h时,0.01 μmol/L SSd能够显著提高BMECs中HSP70 mRNA相对表达量,BMECs中GSH-Px活性较阳性对照组也显著提高,但高浓度的SSa和SSd却对HSP70 mRNA相对表达量无显著影响,说明随着热处理时间的延长,高浓度的SSa和SSd不能起到缓解BMECs热应激的作用,反而会对热诱导条件下的BMECs产生不利影响,该结论与Zhang等[48]的研究结果相似。本试验仅研究了SSa和SSd对热诱导的BMECs中HSF-1和HSP70基因表达的影响,其作用通路及影响机制还有待进一步探究。
4 结 论
42 ℃高温会诱导BMECs发生氧化应激,并引发细胞热休克反应。在BMECs培养基中添加不同浓度的SSa和SSd会以剂量依赖性的方式提高热诱导条件下BMECs中SOD、GSH-Px和CAT的活性,降低培养液中MDA的含量;同时,较低浓度的SSa和SSd可显著提高HSF-1和HSP70 mRNA相对表达量,且HSP70基因表达上调可能与细胞中抗氧化物酶活性增强存在关联。综上可知,0.1 μmol/L SSa和0.01 μmol/L SSd对热诱导条件下BMECs的氧化应激损伤有较好的缓解作用。

