过表达miR-146b-3p通过靶向调控PCSK9表达对oxLDL诱导的血管内皮细胞损伤的保护作用
陈艳芳 贾贺 李富慧 黄景贺
(1南阳市中心医院神经内科,河南 南阳 473000;2郑州大学第二附属医院老年病科)
动脉粥样硬化(AS)是一种发病率和死亡率都较高的慢性血管性疾病,脂质代谢障碍是其病变的基础,动脉壁变厚、血管腔变窄,最终导致组织缺血或坏死,随着治疗方法的改进,患者病死率略有下降,但死亡总数仍不断上升〔1,2〕。研究氧化型低密度脂蛋白(oxLDL)诱导的人脐静脉血管内皮细胞(HUVECs)损伤修复的分子机制,为AS靶向治疗提供理论基础。 研究表明,miR-146b-3p 在高糖诱导的HUVECs中〔3〕、缺血再灌注损伤大鼠脑皮质〔4〕和糖尿病性脑梗死患者〔5〕中均表达下降,药物利拉鲁肽可能通过上调miR-146b-3p 表达改善炎症和血管内皮功能。生物信息学预测发现,前蛋白转化酶枯草溶菌素(PCSK)9可能是miR-146b-3p的下游靶基因。oxLDL、高脂血症和心肌缺血再灌注损伤均能上调PCSK9 mRNA 和蛋白质的表达,诱导HUVECs、apoE (-/-)小鼠海马神经元或心肌细胞凋亡〔6~8〕。但miR-146b-3p在oxLDL诱导的HUVECs损伤中的表达和影响及其是否靶向调控PCSK9影响oxLDL诱导的HUVECs损伤目前还尚未可知。本研究旨在探讨过表达miR-146b-3p通过靶向调控PCSK9表达对oxLDL诱导的血管内皮细胞损伤的保护作用。
1 材料与方法
1.1材料 HUVECs购自北京北纳生物;胎牛血清(FBS)、F-12培养基和内皮细胞生长添加剂(ECGS)购自美国Gibco公司,胰蛋白酶和肝素购自Sigma-Aldrich公司;丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自北京索莱宝科技有限公司;双荧光素酶报告系统购自美国Promega公司;总RNA提取试剂盒、反转录试剂盒〔RT-聚合酶链反应(PCR)〕、实时荧光定PCR试剂盒和Lipofectamine 2000转染试剂盒购自宝生物工程(大连)有限公司;引物、miR-146b-3p mimics(miR-146b-3p)、抑制剂(anti-miR-146b-3p)、PCSK9过表达载体(pcDNA-PCSK9)、PCSK9干扰物(si-PCSK9)、空载体和对照物(pcDNA、miR-NC、anti-miR-NC和si-NC)及PCSK9突变型和野生型双荧光素酶载体购自上海吉玛制药技术有限公司;PCSK9抗体、B细胞淋巴瘤(Bcl)-2抗体、Bcl相关X蛋白(Bax)抗体、酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)3抗体和抗GAPDH抗体购自英国Abcam公司;双染色流式法细胞凋亡检测试剂盒购自BD公司;流式细胞仪购自BD公司,发光仪、光学显微镜、全自动酶标仪及实时荧光定量PCR仪购自美国Bio-rad公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司。
1.2方法
1.2.1细胞培养 将HUVECs在含有10%FBS、100 U/ml青霉素和100 μg/ml 链霉素的F-12K培养基中培养,同时添加0.1 mg/ml肝素和0.05 mg/ml ECGS,培养条件:饱和湿度、37℃ 5% CO2恒温密闭培养箱中培养。当细胞生长至对数生长期,消化传代。
1.2.2细胞oxLDL模型构建和实验分组 oxLDL模型建立:根据文献〔9〕对HUVECs进行oxLDL模型的建立,用培养液将对数生长期的HUVECs稀释为5×104个/ml,接种于6孔板,细胞密度达到80%时每孔加入100 μg/ml oxLDL培养24 h,收集细胞进行实验。
1.2.3细胞转染和实验分组 转染前24 h进行HUVECs的接种和培养,当细胞培养至融合度为80%时,根据Lipofectamine 2000转染试剂盒说明书将miR-NC、miR-146b-3p mimics、si-NC、si-PCSK9、anti-miR-NC、anti-miR-146b-3p、miR-146b-3p mimics与pcDNA、miR-146b-3p mimics与pcDNA-PCSK9分别转染HUVECs。转染48 h收集细胞,验证转染效果。实验分组:未处理的HUVECs记为对照(Con)组;用100 μg/ml oxLDL孵育HUVECs 24 h记为oxLDL组;用100 μg/ml oxLDL分别孵育转染miR-NC、转染miR-146b-3p mimics、转染si-NC、转染si-PCSK9、转染miR-146b-3p mimics与pcDNA、转染miR-146b-3p mimics与pcDNA-PCSK9的HUVECs 24 h,分别记为oxLDL+miR-NC组、oxLDL+miR-146b-3p组、oxLDL+si-NC组、oxLDL+si-PCSK9组、oxLDL+miR-146b-3p+pcDNA组、oxLDL+miR-146b-3p+pcDNA-PCSK9组。转染miR-NC、转染miR-146b-3p mimics、转染anti-miR-NC、转染anti-miR-146b-3p的HUVECs分别记为miR-NC组、miR-146b-3p组、anti-miR-NC组、anti-miR-146b-3p组。
1.2.4实时荧光定量PCR检测RNA的表达 收集oxLDL处理和(或)转染过的HUVECs,用总RNA提取试剂盒提取细胞总RNA,以RNA为模板按照反转录试剂盒说明书合成cDNA,测定合成的cDNA的浓度和纯度,以cDNA为模板按照实时荧光定量PCR试剂盒的说明书进行反应合成miR-146b-3p和PCSK9 mRNA;反应程序为:95℃ 2 min;94℃ 45 s、58℃ 30 s、72℃ 30 s,35个循环;72℃ 5 min。用2-ΔΔCt法进行数据分析。
1.2.5流式细胞术测定细胞凋亡率 将各组HUVECs接种于6孔板中(5×104个细胞/孔),培养24 h,收集并洗涤细胞2次,将细胞稀释为1×105个/ml,取300 μl 1倍结合缓冲液重悬细胞,然后加入5 μl Annexin V-FITC和10 μl碘化丙啶(PI),室温避光20 min,再加入200 μl 1倍结合缓冲液,上流式细胞仪分析细胞凋亡率。
1.2.6检测细胞中MDA、SOD和GSH-Px水平 收集各组HUVECs,按照MDA、SOD和GSH-Px试剂盒说明书操作,检测细胞内MDA、SOD和GSH-Px的含量。
1.2.7双荧光素酶报告系统实验 根据试剂盒说明书进行操作,接种HUVECs,培养细胞至对数生长期,按照1.2.3进行转染,将构建的含有miR-146b-3p与PCSK9预测结合位点的野生型(WT-PCSK9)和突变型(MUT-PCSK9)双荧光素酶报告载体,分别与miR-NC或miR-146b-3p共转染HUVECs。转染48 h,收集细胞,室温裂解细胞20 min,离心收集上清,加入荧光素酶底物,以海肾荧光素酶活性为内参照,检测相对萤火虫荧光素酶活性。
1.2.8Western印迹检测PCSK9和凋亡相关蛋白 收集HUVECs,加入细胞裂解液室温裂解20 min,4℃超声破碎细胞,收集蛋白,BCA法检测蛋白浓度,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转聚偏氟乙烯(PVDF)膜,室温封闭2 h,加入一抗(PCSK9抗体 1∶1 000,Bcl-2抗体1∶2 000,Bax抗体 1∶1 000,酶切caspase3抗体1∶3 000,抗GAPDH抗体1∶4 000),4℃过夜孵育,洗膜2次,加入稀释的酶标二抗,室温孵育2 h,显影,以GAPDH为内参照,分析蛋白水平。
1.3统计学处理 采用 SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-146b-3p和PCSK9在oxLDL诱导的HUVECs中的表达 oxLDL组HUVECs中miR-146b-3p表达量显著低于Con组(P<0.001),PCSK9的mRNA和蛋白表达量显著高于Con组(P<0.001),见图1、表1。

图1 Western印迹检测PCSK9蛋白表达

表1 miR-146b-3p和PCSK9在oxLDL诱导的HUVECs中的表达
2.2miR-146b-3p过表达减轻oxLDL诱导的HUVECs氧化应激的影响 oxLDL组HUVECs中miR-146b-3p表达显著低于Con组(P<0.05),MDA水平显著高于Con组(P<0.05),SOD和GSH-Px活性显著低于Con组(P<0.05);oxLDL+miR-146b-3p组HUVECs中miR-146b-3p表达显著高于oxLDL+miR-NC组(P<0.05),MDA水平显著低于oxLDL+miR-NC组(P<0.05),SOD和GSH-Px活性显著高于oxLDL+miR-NC组(P<0.05)。见表2。

表2 miR-146b-3p过表达对oxLDL诱导的HUVECs氧化应激的影响
2.3miR-146b-3p过表达抑制oxLDL诱导的HUVECs凋亡 oxLDL组HUVECs凋亡率显著高于Con组(P<0.05),抗凋亡蛋白Bcl-2表达显著低于Con组(P<0.05),促凋亡蛋白Bax和酶切caspase3表达显著高于Con组(P<0.05);oxLDL+miR-146b-3p组HUVECs凋亡率显著低于oxLDL+miR-NC组(P<0.05),抗凋亡蛋白Bcl-2表达显著高于oxLDL+miR-NC组(P<0.05),促凋亡蛋白Bax和酶切caspase3表达显著低于oxLDL+miR-NC组(P<0.05)。见图2、图3、表3。

表3 miR-146b-3p过表达对oxLDL诱导的HUVECs凋亡的影响

1~4:Con组,oxLDL组,oxLDL+miR-NC组,oxLDL+miR-146b-3p组图2 Western印迹检测凋亡相关蛋白的表达
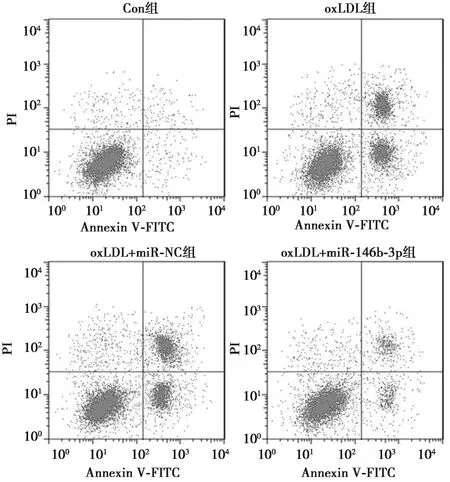
图3 miR-146b-3p过表达对oxLDL诱导的血管内皮细胞凋亡的影响
2.4抑制PCSK9表达对oxLDL诱导的HUVECs损伤的影响 oxLDL+si-PCSK9组HUVECs中PCSK9表达量显著低于oxLDL+si-NC组(P<0.05),MDA水平显著低于oxLDL+si-NC组(P<0.05),SOD和GSH-Px活性显著高于oxLDL+si-NC组(P<0.05),细胞凋亡率显著低于oxLDL+si-NC组(P<0.05),Bcl-2表达显著高于oxLDL+si-NC组(P<0.05),Bax表达显著低于oxLDL+si-NC组(P<0.05)。见图4、表4。

图4 PCSK9和凋亡相关蛋白表达

表4 抑制PCSK9表达对oxLDL诱导的HUVECs损伤的影响
2.5miR-146b-3p靶向调控PCSK9的表达 通过生物信息学预测发现,PCSK9的3′UTR中含有与miR-146b-3p互补的序列,见图5。双荧光素酶报告结果显示,miR-146b-3p和WT-PCSK9共转染组细胞荧光素酶相对活性显著低于miR-NC和WT-PCSK9共转染组(P<0.05);miR-146b-3p和MUT-PCSK9共转染组细胞荧光素酶相对活性与miR-NC和MUT-PCSK9共转染组差异无统计学意义,见表5。miR-146b-3p组细胞PCSK9表达量(0.22±0.02)显著低于miR-NC组(0.43±0.04,P<0.05);anti-miR-146b-3p组细胞PCSK9表达量(0.89±0.08)显著高于miR-NC组(0.41±0.04,P<0.05),见图6。

图5 PCSK9的3′UTR中含有与miR-146b-3p互补的核苷酸序列

表5 双荧光素酶报告实验

1~4:miR-NC组,miR-146b-3p组,anti-miR-NC组,anti-miR-146b-3p组图6 Western印迹检测PCSK9蛋白表达
2.6PCSK9过表达逆转了miR-146b-3p过表达对oxLDL诱导的HUVECs细胞损伤的作用 oxLDL+miR-146b-3p+pcDNA-PCSK9组HUVECs细胞PCSK9蛋白表达量、MDA水平、凋亡率、Bax蛋白表达量显著高于oxLDL+miR-146b-3p+pcDNA组(P<0.05),SOD和GSH-Px活性、Bcl-2蛋白表达显著低于oxLDL+miR-146b-3p+pcDNA组(P<0.05)。见图7、表6。

1~4:miR-NC组,miR-146b-3p组,miR-146b-3p+pcDNA组,miR-146b-3p+pcDNA-PCSK9组图7 PCSK9和凋亡相关蛋白表达

表6 PCSK9过表达逆转了miR-146b-3p过表达对oxLDL诱导的HUVECs损伤的作用
3 讨 论
oxLDL的聚集和血管内皮细胞结构及功能的损伤是AS发生的始动因素,内皮炎症通路的激活可导致AS、败血症等血管疾病,miR-146a和miR-146b可被促炎细胞因子诱导,研究表明,miR-146负调节炎症反应,其可通过抑制促炎通路抑制内皮细胞活化,在AS中可能发挥重要作用〔10〕。miR-146b-5p在AS患者病灶中表达显著上调,抑制miR-146b-5p可通过靶向TRAF6促进AS相关泡沫细胞形成炎症,提高泡沫细胞形成过程中的脂质摄取〔11〕。血管生成素(Ang)-1可显著减弱脂多糖(LPS)对HUVECs的炎症反应,上调细胞中miR-146b-5p的表达,但是对miR-146b-3p和miR-146a表达无影响〔12〕。miR-146b-3p在AS中的研究较少,有研究表明,miR-146b-3p在动脉血栓性疾病中表达下降,受信号传导及转录激活因子(STAT)3调节,并通过丝裂原活化蛋白激酶(MAPK)信号传导途径影响下游靶基因COX-2表达〔13〕。本研究结果发现miR-146b-3p在oxLDL诱导后的HUVECs中表达显著下调,与前述研究结果一致〔13〕,过表达miR-146b-3p表达可减轻oxLDL诱导的HUVECs损伤并抑制细胞凋亡,说明miR-146b-3p在HUVECs氧化损伤中发挥作用,对AS具有重要调节作用。
PCSK9又称神经细胞凋亡调节转化酶(NARC)-1,其可通过调节细胞膜表面低密度脂蛋白(LDL)受体影响血液中脂类代谢,参与AS的发展〔14〕。PCSK9抑制剂可降低血液中低密度脂蛋白胆固醇(LDL-C)水平,已被市场批准用于防治AS等心血管疾病〔15,16〕。研究发现,PCSK9缺乏可减少AS、载脂蛋白B分泌和内皮功能障碍〔17〕。本研究发现PCSK9在oxLDL诱导后的HUVECs细胞中表达显著升高,抑制PCSK9表达可减轻oxLDL对HUVECs细胞的损伤,抑制细胞凋亡,与前述研究结果〔15,16〕一致,说明抑制PCSK9可抑制AS的进展。

