miR-103a-3p靶向CEMIP基因调控肺癌细胞增殖与凋亡的分子机制
张丽萍 杨静 段学波 王慎临 吴萍
(宁夏人民医院呼吸内科,宁夏 银川 750001)
肺癌发病率较高且患者5年生存率极低,早期诊断、药物治疗等均是影响肺癌患者死亡的重要原因〔1〕。由于肺癌早期临床症状不明显导致大部分患者就诊时已处于肺癌晚期,晚期患者错失最佳治疗时机导致生存率降低〔2〕。因而肺癌早期诊断及评估预后的有效指标成为当前研究亟待解决的问题。研究表明微小RNA-103a-3p(miR-103a-3p)在胶质瘤发生及发展过程中发挥抑癌作用,上调miR-103a-3p表达可抑制胶质瘤干细胞的恶性进展〔3〕。miR-103a-3p在膀胱癌细胞中呈低表达,miR-103a-3p过表达可抑制膀胱癌细胞增殖进而减缓癌症进展〔4〕。研究报道指出miR-103a-3p在非小细胞肺癌中发挥抗肿瘤作用,但关于其具体作用机制尚未明确〔5〕。然而,miR-103a-3p在肺癌发生及发展过程中具体作用机制的研究相对较少。通过靶基因预测发现CEMIP基因可能是miR-103a-3p的靶基因,研究表明CEMIP在卵巢癌细胞中呈高表达,并可通过激活PI3K/AKT信号通路进而促进卵巢癌发生及发展〔6〕。Miao等〔7〕研究表明抑制CEMIP表达可抑制视网膜母细胞瘤增殖、迁移及侵袭。胰腺癌患者血清中CEMIP表达水平显著升高,其可作为临床诊断胰腺癌的重要辅助指标〔8〕。然而,关于miR-103a-3p是否通过调控CEMIP基因表达进而参与肺癌发生及发展过程仍未可知。因此,本研究探讨miR-103a-3p及CEMIP在肺癌细胞增殖及凋亡中的作用。
1 材料与方法
1.1材料与试剂 人正常肺上皮细胞BEAS-2B与肺癌细胞H1299、A549、SPC-A-1均购自中国科学院上海生命科学研究院细胞资源中心。胎牛血清(FBS)、胰蛋白酶购自碧云天生物技术研究所;RPMI1640培养基均购自美国Gibco公司;四甲基偶氮唑蓝(MTT)检测试剂盒购自武汉艾美捷科技有限公司;细胞凋亡检测试剂盒与碘化丙啶(PI)均购自北京索莱宝科技有限公司;RIPA蛋白裂解液购自上海翊圣生物科技有限公司;二喹啉甲酸(BCA)蛋白定量试剂盒购自美国Thermo Fisher公司;Trizol试剂购自北京天根生化科技有限公司;反转录试剂盒、实时荧光定量-聚合酶链反应(qRT-PCR)试剂盒均购自德国Roche公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;miR-103a-3p mimics、miR-103a-3p抑制剂(anti-miR-103a-3p)、si-CEMIP及其阴性对照均购自广州锐博生物科技有限公司;双荧光素酶报告基因鉴定试剂盒购自美国Promega公司;辣根过氧化物酶标记的山羊抗兔IgG二抗购自美国R&D公司;兔抗鼠细胞周期蛋白(Cyclin)依赖性激酶(CDK)4、CyclinD1一抗均购自英国Abcam公司;兔抗人B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)多克隆抗体及CEMIP一抗均购自美国Cell Signaling Technology公司。
1.2方法
1.2.1细胞培养、转染及分组 取出冻存的BEAS-2B、H1299、A549、SPC-A-1细胞,37℃水浴锅内复苏细胞,4℃条件下,1 000 r/min转速离心5 min,弃上清,加入含有10%FBS及双抗溶液(青霉素-链霉素混合溶液)的RPMI1640培养基,放入温度37℃、CO2体积分数5%、相对湿度95%的培养箱内培养,待细胞生长融合度达到80%时,弃旧培养基,用预冷磷酸盐缓冲液(PBS)洗涤细胞,加入0.2%胰蛋白酶消化细胞,5 min后加入含有10%FBS及双抗溶液(青霉素-链霉素混合溶液)的RPMI1640培养基进行传代培养,待细胞稳定传代2~3代后收集对数生长期细胞进行后续实验。取对数生长期A549细胞,转染前1 h将培养基更换为Opti-MEM减血清培养基,参照Lipofectamine2000转染试剂盒进行转染,将miR-103a-3p mimics、miR-103a-3p抑制剂(anti-miR-103a-3p)、si-CEMIP及其阴性对照分别转染至A549细胞,命名为miR-con组、miR-103a-3p组、anti-miR-103a-3p组、anti-miR-NC组、si-con组、si-CEMIP组。同时将miR-103a-3p mimics与pcDNA共转染入肺癌A549细胞,miR-103a-3p mimics与pcDNA-CEMIP共转染入肺癌A549细胞,命名为miR-103a-3p+pcDNA组、miR-103a-3p+pcDNA-CEMIP组。转染后置于温度37℃、CO2体积分数5%、相对湿度95%的培养箱内培养,转染6 h后更换为含有10%FBS及双抗溶液(青霉素-链霉素混合溶液)的RPMI1640培养基,继续培养48 h后收集细胞进行后续实验。
1.2.2qRT-PCR 采用Trizol法提取细胞总RNA,微量核酸蛋白分析仪测定RNA浓度,RNA浓度为100~500 ng/μl,A260/A280(吸光度值)在1.9~2.1为合格样本,参照反转录试剂盒合成cDNA,置于-20℃冰箱保存。利用qRT-PCR试剂盒进行qRT-PCR,配制体系共20 μl,其主要包括10 μl的SYBR Premix,1 μl的cDNA样本,上下游引物各0.5 μl,ddH2O补足体系至20 μl。每个样本均设置3个复孔,反应条件为95℃ 5 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,共循环35次。以2-ΔΔCt法计算miR-103a-3p和CEMIP的mRNA相对表达量。
1.2.3Western印迹 取对数生长期人正常肺上皮细胞BEAS-2B与肺癌细胞H1299、A549、SPC-A-1及转染后各组A549细胞,4℃,1 000 r/min转速离心10 min,加入RIPA蛋白裂解液裂解细胞30 min提取细胞总蛋白,BCA法定量蛋白,配制分离胶(12%)与浓缩胶(5%),取适量蛋白样品加入上样缓冲液(比例为1∶4),充分混匀后上样(蛋白量20 μg),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,反应条件为起始电压80 V,样品指示剂进入分离胶电压调整为120 V,反应结束后将分离的蛋白凝胶转移至聚偏氟乙烯(PVDF)膜,转膜反应条件为电压80 V,时间为90 min,温度为4℃,Tis-HCI缓冲液(TBST)洗涤蛋白凝胶,加入5%脱脂牛奶封闭1 h,TBST洗涤后加入蛋白一抗(稀释倍数1∶500),4℃条件下孵育24 h,TBST洗涤后加入二抗(稀释倍数1∶5 000),室温孵育1 h,加入增强型化学发光试剂(ECL)显影,放入凝胶成像系统分析蛋白表达情况。
1.2.4MTT比色法检测细胞增殖 分别收集转染后各组肺癌A549细胞,接种于96孔板,每组均设置3次重复,调整细胞密度(1×105个细胞/ml),放入温度37℃、CO2体积分数5%、相对湿度95%的培养箱内继续培养24 h、48 h、72 h、96 h后加入MTT溶液(20 μl),室温孵育4 h后吸取上清,向每孔加入150 μl二甲基亚砜(DMSO)溶液,室温孵育25 min,置于酶标仪内检测波长为490 nm处各孔吸光度值。
1.2.5流式细胞术检测细胞凋亡 收集转染48 h后各组A549细胞,0.25%胰蛋白酶消化细胞,调整细胞密度(1×106个细胞/ml),采用预冷的PBS清洗2次×5 min,加入100 μl结合缓冲液悬浮细胞,依次加入5 μl Annexin V-FITC与5 μl PI,充分混匀后避光孵育10 min,上机前各流式管内加入400 μl结合缓冲液,流式细胞仪检测各组A549细胞凋亡情况。
1.2.6双荧光素酶报告基因测定 利用靶基因预测库预测miR-103a-3p与CEMIP的3′UTR存在结合位点,构建荧光素酶报告载体,将含有miR-103a-3p结合位点的CEMIP 3′UTR片段插入荧光素酶报告基因载体构建野生型WT-CEMIP载体,将结合位点突变后的CEMIP 3′UTR片段插入荧光素酶报告基因载体构建突变型MUT-CEMIP载体,将上述两种载体分别与miR-103a-3p mimics或阴性对照共转染至肺癌A549细胞,放入温度37℃、CO2体积分数5%、相对湿度95%的培养箱内继续培养48 h后使用荧光素酶检测试剂盒检测荧光素酶活性变化。
1.3统计学方法 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-103a-3p和CEMIP在人肺癌细胞和人正常肺上皮细胞中的表达 人正常肺上皮细胞BEAS-2B中miR-103a-3p的表达水平显著高于人肺癌细胞H1299、A549、SPC-A-1(P<0.05),其中肺癌A549细胞中miR-103a-3p的表达水平相对其他肺癌细胞显著降低(P<0.05),与BEAS-2B细胞比较,人肺癌细胞H1299、A549、SPC-A-1中CEMIP的mRNA及蛋白表达水平均显著升高(P<0.05),其中肺癌A549细胞中CEMIP的mRNA及蛋白表达水平显著高于其他肺癌细胞(P<0.05)。见图1、表1。因此后续研究中以肺癌A549细胞为研究对象。

图1 Western印迹检测CEMIP蛋白表达

表1 各组miR-103a-3p和CEMIP表达水平比较
2.2上调 miR-103a-3p表达对人肺癌细胞A549增殖的影响 通过将miR-103a-3p mimics转染至肺癌A549细胞,qRT-PCR验证转染效率,结果显示,miR-103a-3p组肺癌A549细胞中miR-103a-3p的表达水平显著高于miR-con组(P<0.05),表明转染成功。与miR-con组比较,miR-103a-3p组肺癌A549细胞在转染48 h、72 h、96 h后细胞增殖活性明显降低(P<0.05)。miR-103a-3p组肺癌A549细胞中CDK4、CyclinD1的蛋白表达水平相较于miR-con组显著降低(P<0.05),见图2、表2。表明上调miR-103a-3p表达可通过下调CDK4、CyclinD1的蛋白表达进而抑制肺癌细胞增殖。

图2 Western印迹检测人肺癌细胞A549增殖相关蛋白和凋亡相关蛋白的表达

表2 上调miR-103a-3p表达对肺癌细胞增殖的影响
2.3上调miR-103a-3p表达对人肺癌细胞A549凋亡的影响 转染miR-103a-3p mimics后肺癌A549细胞凋亡率显著增加(P<0.05),Bcl-2表达显著下调(P<0.05),Bax表达显著上调(P<0.05),见图3,图4,表3。表明上调miR-103a-3p表达后可通过下调Bcl-2表达及上调Bax表达进而促进肺癌细胞凋亡。

图3 检测人肺癌细胞A549凋亡率

图4 Western印迹检测凋亡相关蛋白Bcl-2和Bax的表达

表3 上调miR-103a-3p表达对人肺癌细胞A549凋亡的影响
2.4miR-103a-3p靶向调控CEMIP蛋白表达 利用靶基因预测网站鉴定miR-103a-3p的靶基因及其在CEMIP基因的3′UTR中的结合位点,见图5。双荧光素酶活性测定结果显示,在含有miR-103a-3p与CEMIP基因的3′UTR结合位点的WT-CEMIP野生型质粒细胞中,与miR-con组比较,miR-103a-3p组荧光素酶活性显著降低(P<0.05),在含有结合位点突变基因的MUT-CEMIP突变型质粒细胞中,miR-103a-3p组荧光素酶活性与miR-con组比较差异无统计学意义(P>0.05),见表4。表明miR-103a-3p可调控CEMIP的活性。与miR-103a-3p组(EMIP蛋白(0.32±0.04)比较,miR-con组(0.76±0.08)显著升高(P<0.05),与anti-miR-103a-3p组CEMIP蛋白(0.97±0.07)比较,anti-miR-con组(0.79±0.06)显著下降(P<0.05),见图6。表明miR-103a-3p可负向调控靶基因CEMIP表达。

图5 CEMIP的3′UTR中含有与miR-103a-3p互补的核苷酸序列

表4 双荧光素酶报告实验
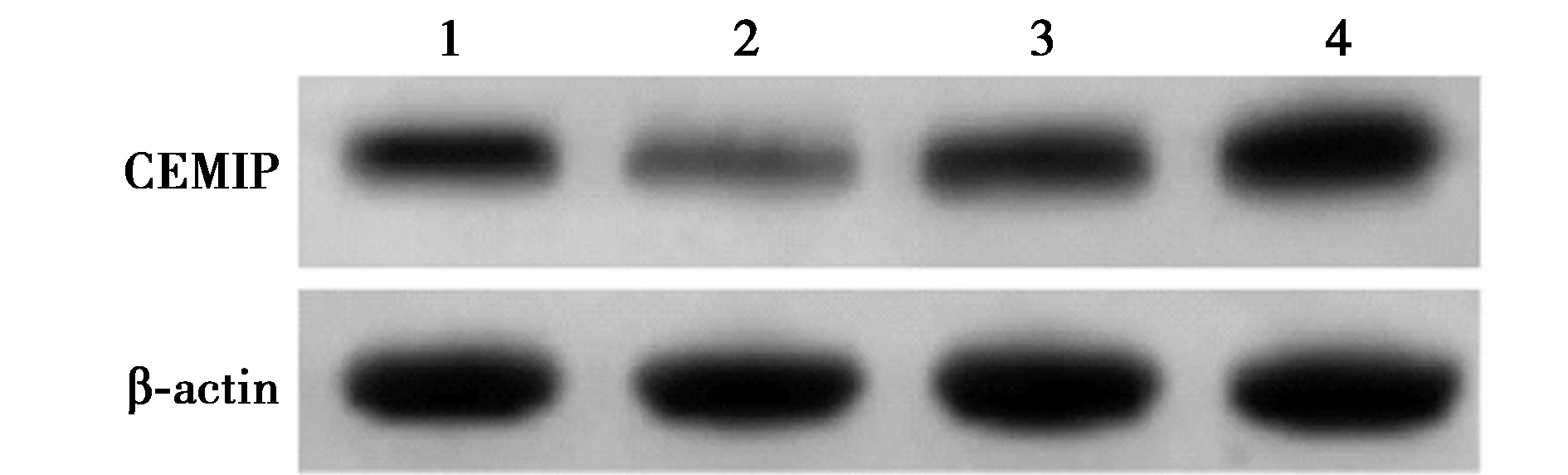
1~4:miR-con组,miR-103a-3p组,anti-miR-con组,anti-miR-103a-3p组图6 Western印迹检测各组CEMIP表达水平
2.5沉默CEMIP抑制人肺癌细胞A549增殖和诱导凋亡 转染si-CEMIP后肺癌A549细胞CEMIP的蛋白表达水平较si-con组显著降低(P<0.05),表明成功干扰肺癌A549细胞CEMIP的高表达。沉默CEMIP后肺癌A549细胞增殖活性显著降低(P<0.05),细胞凋亡率显著增加(P<0.05),CDK4、CyclinD1、Bcl-2表达显著下调(P<0.05),Bax表达显著上调(P<0.05),见图7、表5。表明沉默CEMIP可通过下调CDK4、CyclinD1、Bcl-2表达及上调Bax表达进而促进肺癌细胞凋亡并抑制细胞增殖。

表5 沉默CEMIP抑制人肺癌细胞A549增殖和诱导凋亡
2.6CEMIP过表达逆转了上调miR-103a-3p抑制人肺癌细胞A549增殖和诱导凋亡的作用 与miR-103a-3p+pcDNA组比较,miR-103a-3p+pcDNA-CEMIP组肺癌A549 48 h后细胞增殖活性显著增强(P<0.05),细胞凋亡率显著降低(P<0.05),CDK4、CyclinD1、Bcl-2表达显著上调(P<0.05),Bax表达显著下调(P<0.05),见表6、图8。表明CEMIP过表达可逆转miR-103a-3p过表达对肺癌细胞增殖的抑制作用及凋亡的促进作用。

1,2:si-con组,si-CEMIP组图7 Western印迹检测人肺癌细胞A549增殖相关蛋白表达

表6 CEMIP过表达逆转了上调miR-103a-3p抑制人肺癌细胞A549增殖和诱导凋亡的作用
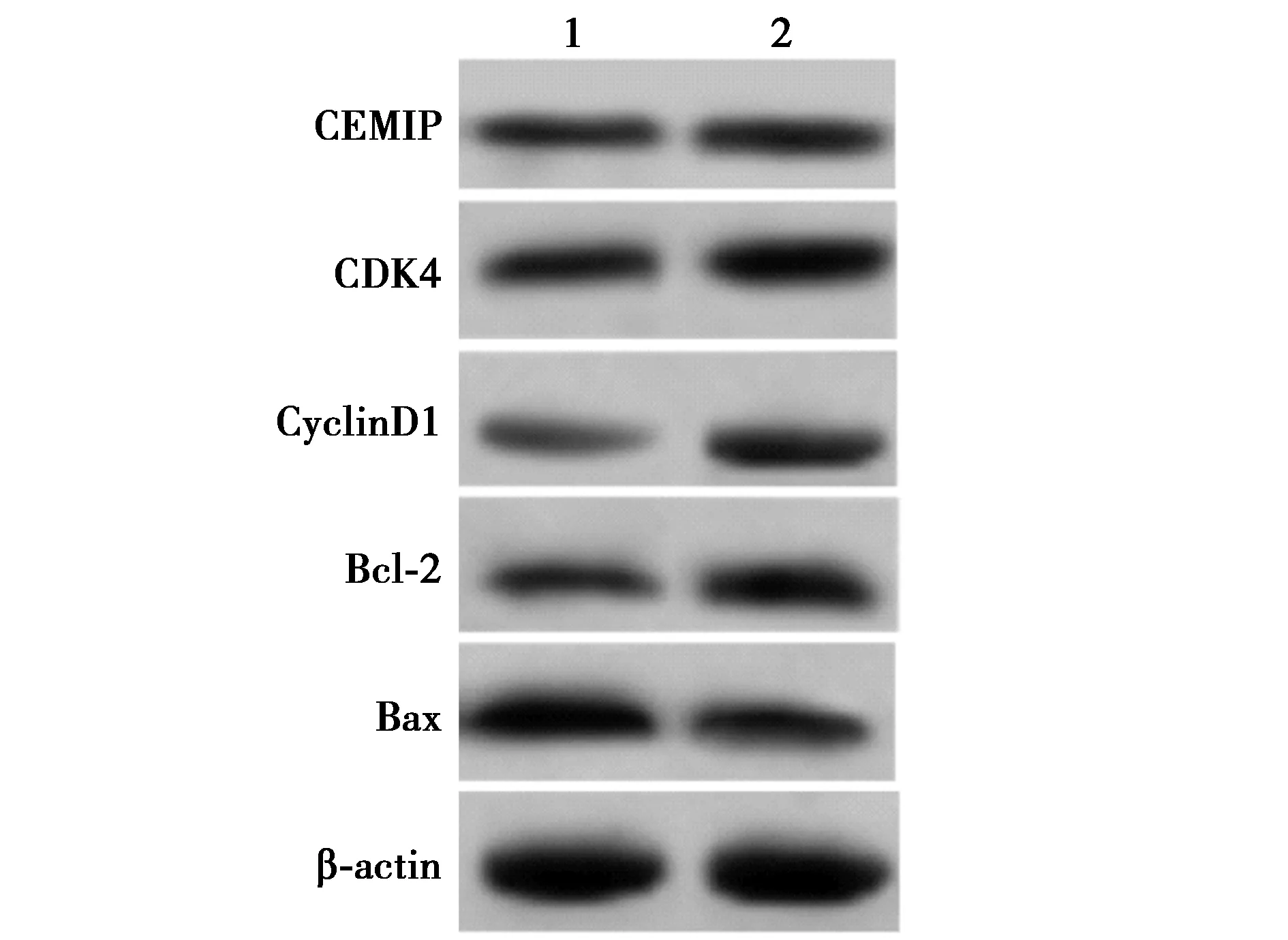
1,2:miR-103a-3p+pcNDA组,miR-103a-3p+pcNDA-CEMIP组图8 检测人肺癌细胞A549中CEMIP、CDK4、CyclinD1、Bcl-2和Bax蛋白表达
3 讨 论
肺癌是一种呼吸系统恶性肿瘤,已严重影响人类生命安全,但肺癌发病机制尚未完全阐明〔9〕。miRNA作为单链非编码RNA分子,其在动植物、细菌等微生物基因组内广泛存在,并可通过调控相关基因表达进而发挥促进或抑制疾病进展作用〔10〕。已有研究表明部分miRNA表达异常与肺癌发生及发展密切相关〔11〕。但仍有部分miRNA与肺癌发病机制的关系尚未完全阐明,因此需进一步探讨miRNA表达与肺癌发生及发展的关系为进一步阐明肺癌发病机制及提高临床治疗效果提供一定依据。
miR-103a-3p在肝癌细胞中呈低表达,miR-103a-3p过表达后可能通过靶向调控锌指蛋白(FEZF)1/细胞分裂周期25A蛋白(CDC25A)表达进而明显抑制肝癌细胞增殖,诱导细胞周期停滞于G0/G1期,促进细胞凋亡〔12〕。乳腺癌组织及细胞中miR-103a-3p的表达水平明显降低,上调miR-103a-3p表达可通过抑制PDK4表达而降低细胞糖酵解水平进而抑制细胞增殖〔13〕。但相关研究发现miR-103a-3p在胰腺癌细胞中表达水平升高,抑制miR-103a-3p表达可抑制癌细胞增殖,同时另有研究报道指出miR-103a-3p在结直肠癌组织中呈高表达并可通过激活Wnt信号通路进而促进癌症进展〔14,15〕。以上研究结果表明miR-103a-3p在不同组织中表达方式不同,可能发挥促癌作用,又可发挥抑癌基因作用,从而调控肿瘤发生及发展过程。已有研究表明miR-103a-3p在肺癌组织中表达水平降低,并可抑制肺癌细胞增殖、迁移及侵袭〔16〕。本研究结果说明miR-103a-3p在肺癌发生过程中可能发挥抑癌基因作用;miR-103a-3p过表达可抑制肺癌细胞增殖并诱导细胞凋亡进而减缓肺癌恶性进展过程。细胞周期异常是引发肿瘤的重要原因之一,CDK4与CyclinD1是调控细胞周期的重要因子,CyclinD1过度表达而促使其与CDK4结合形成复合物增多,诱导细胞周期进入G1/S期刺激细胞生长进而促使细胞周期异常〔17〕。本研究结果说明miR-103a-3p过表达可通过降低CDK4、CyclinD1表达而诱导细胞周期停滞于G0/G1期进而抑制细胞生长。提示miR-103a-3p可通过影响细胞周期调控因子表达而抑制肺癌细胞生长。细胞凋亡与细胞增殖失衡是诱导肿瘤进展的重要原因之一,Bcl-2与Bax在细胞凋亡过程中发挥重要作用,抑制Bcl-2表达而上调Bax表达可诱导肺癌细胞凋亡〔18,19〕。本研究结果提示miR-103a-3p可通过上调Bax表达及下调Bcl-2表达进而促进肺癌细胞凋亡。
CEMIP在结直肠癌中表达水平升高,长链非编码RNA CASC19可通过调控miR-140-5p/CEMIP轴进而调控结直肠癌进展过程〔20〕。CEMIP过表达可促进前列腺癌细胞迁移及侵袭进而其恶性发展进程〔21〕。沉默CEMIP可通过抑制Wnt /β-连环蛋白/Snail信号转导途径及抑制EMT转换进程进而抑制结肠直肠癌发展〔22,23〕。本研究结果表明不同肺癌细胞系中CEMIP的表达水平较正常肺上皮细胞明显升高,提示CEMIP在肺癌生过程中可能发挥促癌作用;沉默CEMIP表达后可通过下调CDK4、CyclinD1、Bcl-2表达及上调Bax表达进而抑制肺癌细胞增殖并促进细胞凋亡;miR-103a-3p可通过抑制CEMIP表达及调控肺癌细胞增殖、凋亡相关蛋白表达进而抑制肺癌发生及发展过程。

