载奥沙利铂细胞膜囊泡纳米药物的制备及其对小鼠结肠癌细胞的杀伤作用
黄莉莉, 刘宇轩, 方楷漪, 穆业腾, 胡楠楠, 郭 冲, 杨馥旭, 关新刚
(北华大学医学技术学院医药生物工程重点实验室,吉林 吉林 132013)
奥沙利铂(oxaliplatin,OXA)是结肠癌临床治疗的常见化疗药,通过靶向结合DNA 抑制DNA复制和转录来发挥抗肿瘤功效[1-4]。尽 管OXA 具有比顺铂和卡铂低的药物毒性,但其对正常组织的不良反应仍是不容忽视的问题[5]。近年来,基于纳米载体的化疗药物递送系统在肿瘤治疗领域引起了广泛关注。越来越多的研究[6-10]显示:利用纳米胶束、聚合物囊泡、介孔硅球和金纳米粒等纳米颗粒递送化疗药物能够改善药物溶解性、提高药物的肿瘤组织蓄积、延长血液循环时间和降低在正常组织引起的不良反应,显示出较小分子化疗药物更好的肿瘤抑制增殖效果。然而,纳米材料本身的生物安全性也是药物研发不可回避的关键问题,设计和开发安全及高效的药物递送系统成为肿瘤研究的热点课题[11]。
细胞膜作为生物体细胞与胞外环境的天然屏障,具有其他外源性材料具有无可比拟的优势。细胞膜纳米囊泡是一种利用细胞膜材料人工制备的纳米级生物囊泡,因其良好的生物相容性和可降解性及低免疫原性等优势成为药物递送领域的优质载体[12-13]。与外泌体产量较低不同,细胞膜囊泡可以通过挤出等方法大量制备,为其大规模应用奠定了基础[14]。细胞膜囊泡和外泌体等天然囊泡均可以避免被内皮网状系统清除,延长了药物的半衰期;作为抗肿瘤药物输送载体,细胞膜囊泡还具有纳米颗粒在肿瘤部位独有的增强通透和滞留效应(enhanced permeability and retention effect,EPR),明显延长药物的体内循环,增加药物在肿瘤部位的滞留,降低在正常组织引起的不良反应[15-18]。
近年来,将细胞膜(尤其是红细胞膜)包被纳米颗粒制备的纳米制剂在肿瘤治疗领域取得了重要进展[19-20],然而,利用细胞膜囊泡作为药物递送载体的研究却相当有限,现有细胞膜囊泡载药体系大部分来源于肿瘤细胞的细胞膜[21-22],来自正常组织细胞的细胞膜囊泡研究鲜有报道。本研究尝试采用人胚肾HEK293T 细胞的细胞膜制备细胞膜纳米囊泡(nanovesicles,NVs),通过电击法或孵育法将OXA 担载入细胞囊泡内腔,得到担载OXA 的新型纳米药物NVs@OXA,探讨NVs@OXA 对小鼠结肠癌CT26 细胞的内吞情况和肿瘤杀伤效果,为开发高效低毒的新型化疗药提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠结肠癌CT26 细胞、人胚胎肾HEK293T 细胞和小鼠树突状DC2.4细胞来自于本实验室细胞库。OXA 购自大连美仑生物技术有限公司,1% 青霉素- 链霉素溶液、MTT、PMSF、DAPIT 、DiO 和BCA 蛋白定量试剂盒购自上海碧云天生物技术公司,二甲基亚砜(dimethyl sulfoxide,DMSO)、改良Eagle 培养基(dulbecco’s modificationofEagle’s medium,DMEM)和胎牛血清(fatal bovine serun,FBS)购自生工生物工程(上海)股份有限公司。纳米粒径分析仪Microtrac Nanotrac Wave Ⅱ购自美国麦奇克有限公司,LF10 脂质体挤出仪购自加拿大AVESTIN公司,CUY21EDIT Ⅱ细胞电转化仪 购自日本BEX 公司,高效液相色谱仪Agilent 1260 InfinityⅡ购自安捷伦科技有限公司,M200 多功能酶标仪购自瑞士TECAN 公司,ACEA NovoCyte 序列流式细胞仪和倒置荧光显微镜购自美国Life Technologies 公司。
1.2 细胞培养将含有细胞悬液的冻存管从液氮罐取出后37℃水浴锅中迅速解冻,离心后弃去上清液,加入培养基轻柔吹匀。所有细胞悬液加入培养瓶中培养过夜。所有细胞采用含10% FBS 和1%青霉素-链霉素溶液的DMEM 培养基培养,于37℃、5%CO2培养箱中孵育,细胞密度达80%~90% 时即可进行传代培养。
1.3 NVs 的制备采用胰酶收集对数生长期的HEK293T 细胞,消化后1 000 r·min-1离心5 min 收集细胞沉淀,采用PBS 缓冲液洗涤细胞沉淀,采用HM培养基(1 mmol·L-1EDTA、20 mmol·L-1Hepes-NaOH、1 mmol·L-1PMSF、pH 7.4)进行重悬,轻柔混匀后置于冰上的匀浆器,来回挤压50次,1 000 r·min-1离心10 min,取其上清进行超高速离心(35 000 r·min-1,2 h)收集沉淀,PBS缓冲液重悬3次,采用DiO 染料室温染色20 min,获得细胞膜悬液依次通过1.0 和0.4 μm滤膜的脂质体挤出仪,来回挤压20次,获 得NVs。采 用BCA蛋白定量试剂盒检测NVs 的蛋白浓度,以mg·L-1表示。采用纳米粒径分析仪Microtrac Nanotrac Wave Ⅱ检测NVs 的粒径分布。透射电子显微镜下观察制备的NVs 的超微结构。
1.4 NVs 的细胞相容性分析将对数生长期小鼠骨髓树突状DC2.4 细胞置于96 孔细胞培养板中,每孔加入100 μL 细胞悬液(每孔5 000个细胞),37℃、5%CO2培养箱孵育24h后每孔加入蛋白终浓度分别为5、10、20、50 、75 和100 mg·L-1的NVs,空白对照孔不作处理,37℃、5%CO2培养箱培养48h后快速在每孔中加入20 μ L MTT(5 g·L-1)溶液,继续置于培养箱中培养4 h,弃去孔中溶液,加入150 μL DMSO,充分混合震荡1 min 后检测490 nm 处吸光度(A)值并计算细胞存活率。细胞存活率=囊泡处理孔A 值/空白对照孔A 值×100%。
1.5 NVs 的肿瘤细胞内吞情况为了检测纳米药物的细胞内吞情况,采用细胞膜特异性荧光染料DiO 对NVs 进行标记,制备荧光标记的NVs。取对数生长期的小鼠结肠癌CT26 细胞接种于提前放有洁净玻片的24 孔板内,37℃、5%CO2培养箱孵育12h后,37℃共培养3h后弃去孔中液体,采用PBS 缓冲液清洗3~5次,采用4% 多聚甲醛固定20 min,PBS 缓冲液清洗3~5次 后 用DAPI染色10 min,PBS 缓冲液清洗3~5次,采用封片剂进行封片,于荧光显微镜下成像。采用Image J 软件分析图片DiO 荧光标记的荧光强度。
1.6 纳米药物NVs@OXA 的制备本研究为了将游离OXA 药物装载入NVs 内腔得到纳米药物NVs@OXA,采用电击法和孵育法制备。①电击法。在CUY21EDIT Ⅱ细胞电转化仪电击杯中加入细胞膜NVs 与OXA(质量比为2∶1),电转条件:PPV 120 V,On 10 ms,Off 10 ms;PdV 25 V,On 50 ms,Off 50 ms;Cycle 5,C 940 μF。②孵育法。NVs 与游离OXA(质量比为2∶1)在37℃孵育3h后离心去除囊泡外药物,10 000 r·min-1离心5 min,PBS 缓冲液洗涤3次后重悬,-80℃冷冻保存。OXA 在波长250 nm 处有最高吸收峰,采用高效液相色谱分析绘制OXA 标准曲线,对制备的纳米药物的OXA 浓度进行定量检测。
1.7 纳米药物NVs@OXA 体外稳定性检测将NVs@OXA 置于PBS 缓冲液(pH 7.4)中,在第0、3、6、9 和12天采用纳米粒径分析仪Microtrac Nanotrac Wave Ⅱ检测NVs@ OXA 的粒径分布,以反映其体外稳定性。
1.8 各组结肠癌CT26 细胞存活率和细胞凋亡率检测取对数生长期小鼠结肠癌CT26 细胞,接种于96 孔细胞培养板中,每孔5 000个细胞,设置空白对照组,置于37℃、5%CO2培养箱孵育24 h后,对照组每孔加入100 μL 1.0、2.5、5.0、10.0和15.0 μmol·L-1游 离OXA(游 离OXA组)或NVs@OXA(NVs@OXA组),每组设置5个重复孔。置于37℃、5%CO2培养箱培养48h后弃去上清液,在每孔加入20 μL MTT(5 g·L-1),孵 育4h后弃去上清溶液,每孔加入150 μL DMSO,全波长多功能自动酶标仪(瑞士TECAN 公司)检测490 nm 处A 值,计算细胞存活率。细胞存活率=药物孔A 值/空白对照孔A 值×100%。
细胞凋亡率检测:在12 孔板中以每孔1×105个细胞的密度接种结肠癌CT26 细胞,置于37℃、5%CO2培养箱孵育过夜至细胞密度在培养皿内长至70%~80%,分别加入终浓度为15 μmol·L-1OXA(OXA组)或NVs@OXA(NVs@OXA组),并设对照组(不处理)37℃孵育3h后采用胰蛋白酶消化,收集悬浮细 胞 离心(1 500 r·min-1、5 min),取细胞沉淀PBS 缓冲液洗涤3~5次后加入500 μLPBS缓冲液悬浮细胞,加入5 μL Annexin Ⅴ-FITC 和Propidium Iodide 染液,混匀后在室温避光静置5 min,采用流式细胞术检测各组细胞凋亡率。
1.9 统计学分析采用Graphpad Prism 5.0 统计软件进行统计学分析。各组细胞存活率、载药效率、荧光强度和细胞凋亡率均呈正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 NVs 的粒径分布超速离心法分离HEK293T 细胞的细胞膜,经PBS 缓冲液重悬后采用脂质体挤出仪得到NVs,采用动态光散射测得平均粒径为222.2 nm(图1),透射电子显微镜显示所制备的NVs 为空心球形结构(图2)。
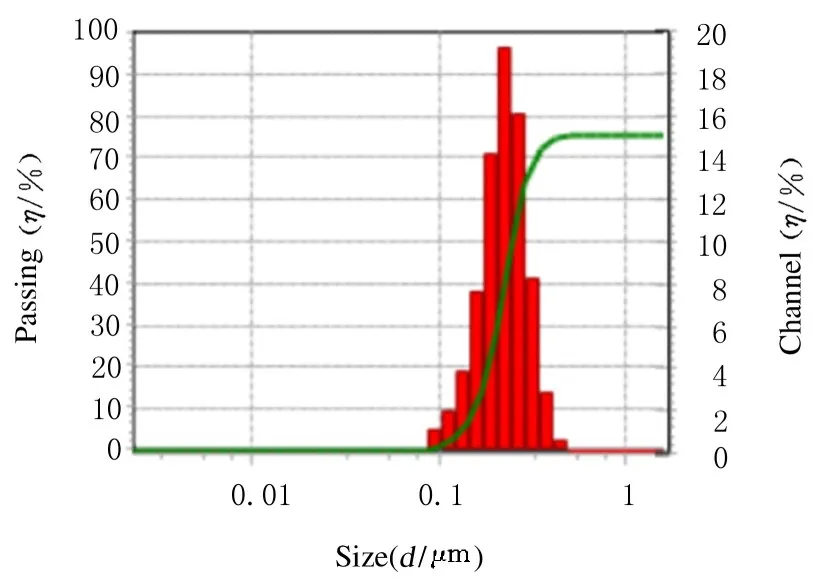
图1 NVs 的粒径分布Fig.1 Distribution of particle sizes of NVs
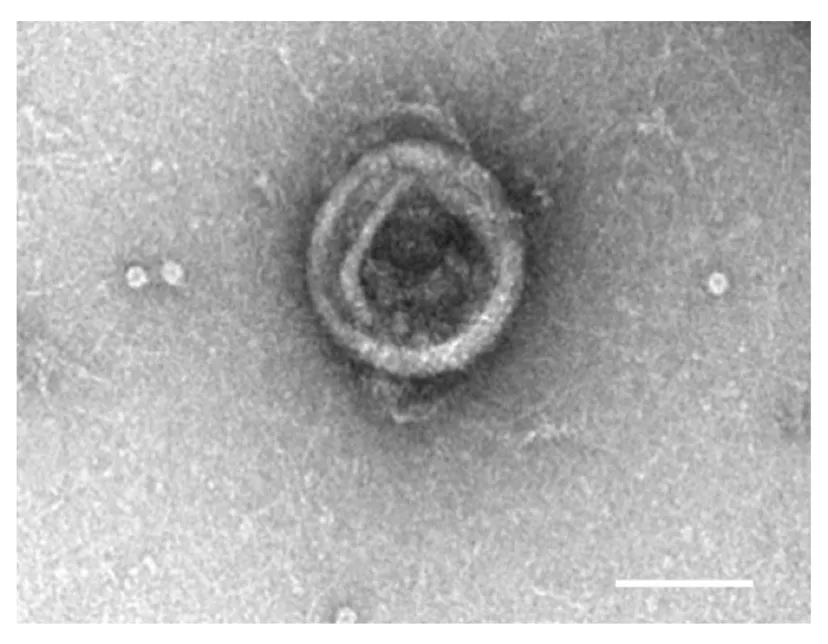
图2 透射电子显微镜下NVs 的超微结构(Bar=200 nm)Fig.2 Ultrastructure of NVs under transmission electron microscope(Bar=200 nm)
2.2 NVs 的细胞相容性细胞相容性检测结果显示:在所测试的所有浓度中,树突状DC2.4 细胞的增殖情况未受影响,NVs 处理后细胞存活率均>100%,显示其具有良好的生物相容性。见图3。
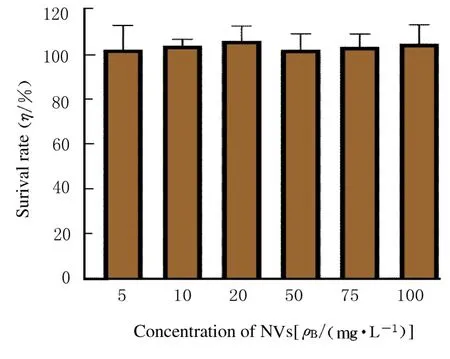
图3 MTT 法检测树突状DC2.4 细胞存活率Fig.3 Survival rates of dendritic DC2.4 cells detected by MTT method
2.3 NVs 的细胞内吞情况囊泡与小鼠结肠癌CT26 细胞孵育3h后,DiO 荧光标记的绿色荧光呈斑点状分布在细胞核周围,提示NVs@OXA 被肿瘤细胞摄取,分布在细胞质中。见图4。
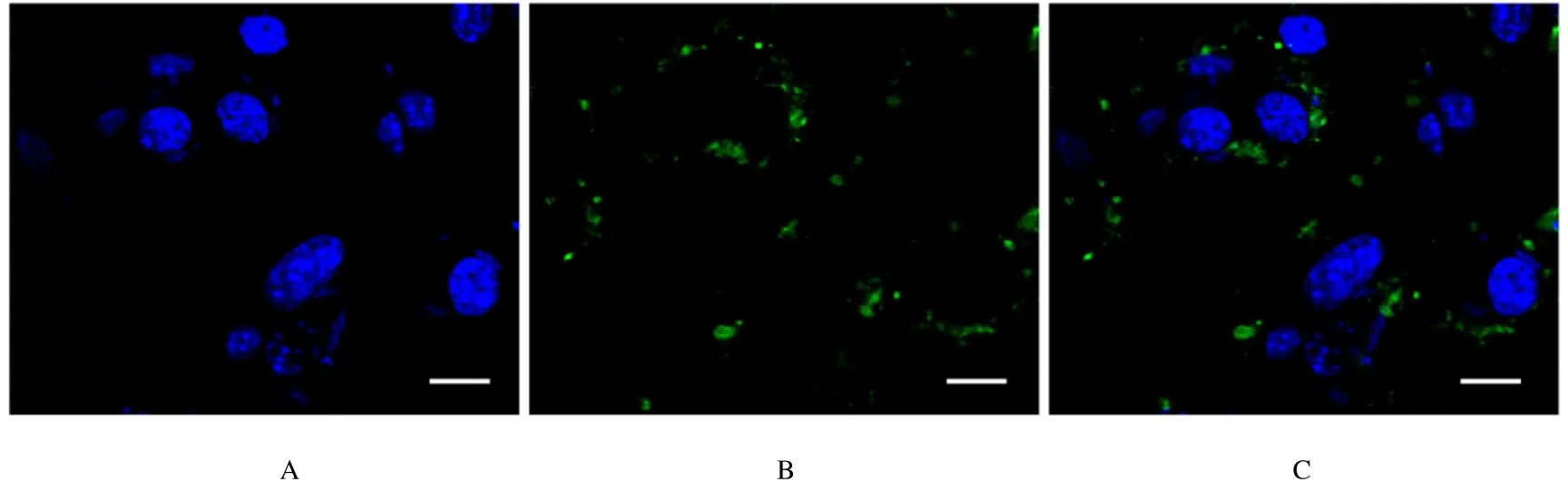
图4 DiO 荧光标记的NVs 的细胞内吞情况Fig.4 Cellular uptake of DiO-labeled NVs
2.4 纳米药物NVs@OXA 的装载效率和稳定性为了将OXA 载入囊泡内腔,采用电击法和孵育法制备纳米药物NVs@OXA。孵育法和电击法制备得到的纳米药物OXA 的装载效率分别为16.10%和23.16%,电击法制备的纳米药物OXA 的装载效率明显高于孵育法,因此后续实验纳米药物NVs@OXA 均采用电击法制备。稳定性研究结果显示:纳米药物在PBS 溶液中孵育12 d 后尺寸无明显变化,提示NVs@OXA 在体外溶液中具有较好的稳定性。见图5。
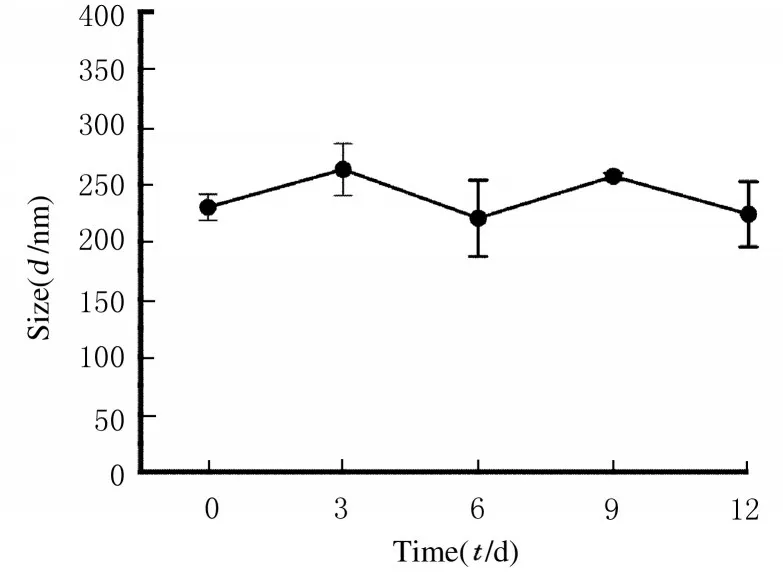
图5 NVs@OXA 在PBS 中孵育12 d 的粒径分布Fig.5 Distribution of particle sizes of NVs@OXA buffered in PBS for 12 d
2.5 各组结肠癌CT26 细胞的存活率和细胞凋亡率游离OXA 和NVs@OXA 处理组结肠癌CT26细胞的存活率随着药物浓度的增加均呈现逐渐下降趋势,在OXA浓度为10和15μmol·L-1时,与 游离OXA组比较,NVs@OXA组细胞的存活率明显降低(P<0.05),提示纳米药物NVs@OXA 较游离OXA 具有更强的肿瘤细胞毒性。见图6。

图6 各组结肠癌CT26 细胞的存活率Fig.6 Survival rates of colon cancer CT26 cells in various groups
NVs@OXA组CT26 细胞凋亡率(34.51%±0.30%)明显高于游离OXA组(21.69%±0.70%),该结果与MTT 结果一致,即NVs@OXA 较游离OXA 够诱发更多的结肠癌CT26 细胞发生凋亡。见图7。

图7 流式细胞术检测各组结肠癌CT26 细胞凋亡率Fig.7 Apoptotic rates of colon cancer CT26 cells detected by flow cytometry
3 讨 论
结直肠癌已成为当今世界发病率第三、死亡率第二的恶性肿瘤。由于结直肠癌具有易转移和复发的特性,晚期结直肠癌患者的预后效果不理想。化疗是临床治疗结直肠癌的主要手段之一,提高化疗药的利用度成为决定临床治疗效果的关键因素。
多项研究[19-22]显示:基于细胞膜囊泡的化疗药物递送系统在多种肿瘤模型中取得了良好的抗肿瘤效果。ZHANG 等[19]采用红细胞膜囊泡制备的阿霉素纳米药物均展示出较小分子药物更强的抑制乳腺癌增殖的效果;COMPARETTI 等[20]采用胰腺癌PANC-1 细胞膜制备的吉西他滨/紫杉醇共担载纳米药物能够上调共刺激分子CD80 和CD86 等分子表达,激活机体免疫系统;GAO 等[21]制备的胆管癌细胞膜纳米囊泡可递送氨甲喋呤激活机体抗肿瘤免疫应答,发挥抗肿瘤功效;QIAO 等[22]制备了担载阿霉素的人纤维肉瘤HT1080 细胞膜囊泡,其较游离药物具有更强的肿瘤组织保留能力,可延长药物作用时间。本研究中HEK293 细胞来源的NVs 具有极佳的生物相容性,用于担载OXA 能够明显提高药物的溶解性和利用度,在体外细胞实验中显示出剂量依赖的杀伤效应,显示出细胞膜纳米药物的独特优势。此外,本研究采用人胚肾HEK293 细胞的细胞膜制备NVs,低分化的HEK293 细胞具有较低的免疫原性,因此有望在将来作为一种通用的递送策略用于多种疾病的治疗。本研究成功制备了基于细胞膜囊泡的OXA 纳米药物NVs@OXA,该纳米药物可被结肠癌CT26细胞高效内吞并具有较游离药物更强的肿瘤细胞杀伤效应,显示出细胞膜囊泡药物在结肠癌方面巨大的的治疗潜力,本研究结果可为开发高效低毒的新型抗肿瘤药物提供依据。

