酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究
张春林,杨 亮,李 喆,甘广东,何珺珺
(茅台学院 酿酒工程系,贵州 仁怀 564501)
堆积发酵是酱香型白酒生产的独特工艺,高粱经过蒸煮后,加入高温大曲,在生产场地堆积发酵,再进入窖池发酵,堆积时间根据季节、气温和工艺要求实时调整,最长可达到10 d以上。该工艺一方面是对酒曲中微生物扩增,并网罗场地和空气中的微生物,为后续的窖内发酵工艺富集微生物,另一方面在多种微生物和酶类的共同作用下堆积酒醅产生了酱香型白酒的酒体风味物质和风味前体物质,因此该过程也被称之为“二次制曲”,对酱香风味物质的生成及酒精发酵至关重要[1-2]。
酱香型白酒的堆积的核心是微生物的富集和增殖。随着技术的进步,高通量测序技术已逐步成熟,并广泛应用于发酵食品微生物群落的研究,包括酱油[3]、食醋[4]、黄酒[5]、浓香型[6]和清香型白酒[7]等。王鹏等[8]利用高通量测序技术确定了白酒发酵过程中的核心微生物,揭示了环境因子与核心微生物群的相互关系。黄蕴利等[9]利用高通量测序技术分析了传统酱香型白酒堆积和窖池酒醅中的微生物群落结构,研究发现酒醅中的优势细菌属为芽孢杆菌属、肠球菌属、乳球菌属和乳杆菌属。WANG H等[10]采用高通量测序方法对酱香型白酒堆积酒醅一至七轮次130个样品进行测定,鉴定真菌7个门158个属,细菌27个门658个属,不同轮次之间微生物群落结构差异明显。
在酿造过程中,温度、酸度、水分、淀粉、还原糖等理化指标对酿造微生物群落的丰度及变化规律有重要影响,如温度因素通过调控大曲发酵前期微生物群落的演替规律而影响成品曲中微生物群落的组成[11];窖池的水分、酒精和淀粉含量对于微生物群落有着调控作用,同时会影响最终酒体风味[12]。二轮次作为取三轮次酒的前置轮次,酒醅内微生物群落结构及理化特性将对后续轮次的发酵有直接影响,解析二轮次堆积发酵酒醅内微生物群落及其与理化指标之间的相关性,将为调控下一个轮次发酵、提高酱香型白酒产量及品质起着重要作用。
本研究以酱香型白酒二轮次堆积发酵酒醅为研究对象,通过高通量测序技术解析堆积发酵过程中的酒醅微生物群落组成,结合多元统计分析揭示酒醅理化特性对微生物群落结构多样性的影响。以期为酱香型白酒的酿造机理解析及发酵过程控制提供理论依据。
1 材料与方法
1.1 材料与试剂
酒醅样品:样品采集于茅台某酒企1号车间的二轮次堆积发酵酒醅。堆积酒醅的采集时间为堆积发酵的第1~7天,即分别取堆积酒醅的上层样品A为1号取样点(堆积酒醅上层),中层样品B由2、3取样点混合后样品(堆积酒醅中层),下层样品C由4、5取样点混合后样品(堆积酒醅下层),再将A、B、C三个样品混合形成一个样品,置于-70 ℃条件下保存,分别记为D1、D2…D7[13]。
Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega Bio-Tek公司;氢氧化钠、酚酞、邻苯二甲酸氢钾、葡萄糖、斐林试剂、次甲基蓝指示剂、无水乙醇、浓盐酸、硫酸铜、酒石酸钾钠、亚铁氰化钾(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
Agilent 2100生物分析仪:美国安捷伦公司;DHG-9140A电热鼓风干燥箱:上海精宏实验设备有限公司;HH-6电热恒温水浴锅:常州润华电器有限公司;DH-20008高速台式冷冻离心机:上海德洋意邦仪器有限公司;ME204TE分析天平:梅特勒-托利多集团;D-78224超声波清洗仪:德国Elma公司。
1.3 方法
1.3.1 酒醅微生物多样性检测
酒醅样本基因组提取采用试剂盒,取质量合格的基因组样品及对应的融合引物配制反应体系,开展聚合酶链式反应(polymerase chain reaction,PCR)扩增,使用试剂盒磁珠对扩增产物进行纯化并溶于洗脱缓冲液,完成建库。使用Agilent 2100 生物分析仪对片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择高通量测序平台进行测序分析。提取酒醅微生物总基因组后,分别对基因组16S V4区和ITS1区扩增子测序分析[16-17]。
1.3.2 酒醅理化指标的检测
每隔12 h(0 h、12 h、24 h、36 h…168 h)采集堆积酒醅上、中、下混合样品测定酒醅理化指标。水分、酸度、淀粉、还原糖测定:参考DB34/T 2264—2014《固态发酵酒醅分析方法》[14];酒醅温度、粗蛋白测定:参照《白酒生产技术全书》[15]。
1.3.3 数据处理
采用SPSS19.0软件进行理化指标数据统计分析。
2 结果与分析
2.1 酒醅发酵过程中真菌微生物群落结构多样性分析
2.1.1 真菌群落测序数据统计
如表1所示,按照相似性将得到的样品所对应的分类序列条数归类为可操作分类单元(operational taxonomic unit,OTU)。其中,OTU数量最多的是堆积发酵3 d的酒醅,共78个。所有样品共有的真菌OTU数量为21。堆积发酵过程中酒醅样品的物种丰富度的指标(Chao 1指数)在42~82之间;物种多样性指标(Shannon指数)在1.43~1.91之间,堆积发酵5 d的Shannon指数达到最高值1.91。所有样本的覆盖率(Coverage)在0.999 7~0.999 9之间,测序结果能完整反映二轮次堆积发酵真菌菌群组成信息。

表1 酒醅真菌菌落测序数据统计分析Table 1 Statistical analysis of fungal community sequencing data of fermented grains
2.1.2 发酵过程中真菌群落的演替规律
如图1所示,在酱香型白酒二轮次堆积发酵酒醅中共检出4个门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和壶菌门(Chytridiomycota),其中子囊菌门相对丰度达94%以上,占绝对优势。而担子菌门在酱香型白酒二轮次堆积发酵酒醅中相对丰度为0.16%~5.55%。接合菌门含量较低,相对丰度约为0.03%~0.65%。壶菌门只在个别样品中检出。

图1 门水平真菌群落结构组成分布Fig.1 Distribution of fungal community structure at phylum level
二轮次堆积酒醅中共检测出46个属的真菌微生物,真菌微生物属水平的群落组成如图2所示,丰度>1%的有8个属,包括曲霉属(Aspergillus)、假丝酵母属(Candida)、裸胞壳属(Emericella)、毕赤酵母属(Pichia)、红曲霉属(Monascus)、毛孢子菌属(Trichosporon)、节担菌属(Wallemia)、威克汉姆酵母属(Wickerhamomyces)。其中曲霉属和红曲霉属占绝对优势,曲霉属相对丰度为2.70%~50.02%,发酵前期繁殖迅速,成为优势菌,在第2天相对丰度最高。随着温度升高,曲霉属相对丰度呈下降趋势,发酵后期丰度逐渐降低。红曲霉属相对丰度为15.08%~52.47%,在第5天相对丰度达到峰值。假丝酵母属相对丰度为0.01%~67.25%,在堆积发酵过程中其相对丰度持续增加,假丝酵母属是酱香型白酒中的主要功能微生物,是酱香型白酒堆积发酵酒醅中的优势真菌,在酒醅和大曲中均有检出[18]。毕赤酵母属相对丰度为0.26%~2.09%,在堆积发酵中期波动增加,毕赤酵母属属于耐高温酵母菌,是酒醅发酵过程中产乙醇和产酯的功能菌,虽有报道称堆积发酵过程中酒醅中的毕赤酵母属来自发酵环境[19],但大曲中也存在毕赤酵母属[20],其具体来源还需进一步探索。
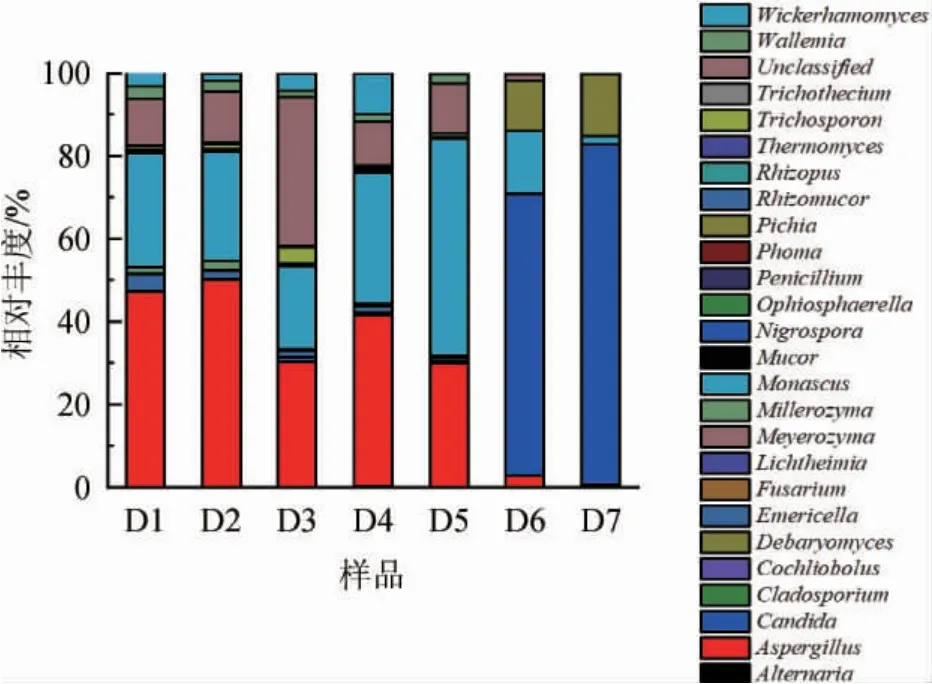
图2 属水平真菌群落结构组成分布Fig.2 Distribution of fungal community structure at genus level
2.2 酒醅发酵过程中细菌微生物群落结构多样性分析
2.2.1 细菌群落测序数据统计
酒醅细菌菌群测序数据统计分析见表2。由表2可知,其中堆积发酵6 d的酒醅中细菌的OTU数最多为243,所有样品共有的细菌OTU数为65。堆积发酵过程中酒醅样本的Chao 1指数在115~206之间;Shannon指数在2.40~2.80之间,堆积发酵第3天的Shannon指数最高,说明二轮次堆积3 d可使酒醅内微生物多样性达到最高。所有样本的覆盖率在0.999 2~0.999 7之间,测序结果能完整反映二轮次堆积发酵细菌菌群组成信息。

表2 酒醅细菌菌落测序数据统计分析Table 2 Statistical analysis of bacteria community sequencing data of fermented grains
2.2.2 发酵过程中细菌群落的演替规律
如图3所示,二轮次酱香型白酒堆积酒醅中共检出11个细菌门,包括放线菌门(Actinobacteria)、装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、泉古菌门(Crenarchaeota)、蓝藻细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)。其中,厚壁菌门、变形菌门、放线菌门占绝对优势。
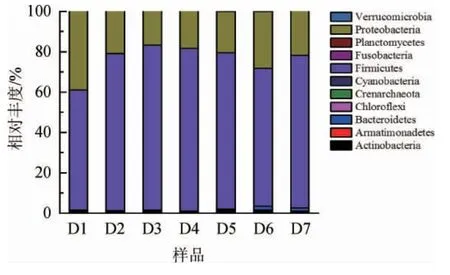
图3 门水平细菌群落结构组成分布Fig.3 Distribution of bacterial community structure at phylum level
二轮次酱香型白酒堆积酒醅中共检测出125个细菌属微生物。如图4所示,其中相对丰度>1%的有7个属,包括芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、海洋芽孢杆菌属(Oceanobacillus)、高温放线菌属(Thermoactinomyces)、枝芽孢菌属(Virgibacillus)、片球菌属(Pediococcus)、光冈菌属(Mitsuokella)。其中,有3个属丰度较高,是二轮次的主导菌属,分别是芽孢杆菌属、海洋芽孢杆菌属、高温放线菌属。其中高温放线菌属占绝对优势,相对丰度为12.48%~30.64%,且随着堆积发酵时间的延长,丰度逐渐增加。海洋芽孢杆菌属相对丰度为10.04%~30.88%,丰度呈现先上升后下降最后稳定的趋势,相对丰度从最初的13.24%增加至30.88%,从第3天开始逐渐下降,后期相对丰度保持在10%左右。芽孢杆菌属相对丰度为5.90%左右。

图4 属水平细菌群落结构组成分布Fig.4 Distribution of bacterial community structure at genus level
芽孢杆菌属是酱香白酒中酱香风味物质的主要代谢菌属,能分泌蛋白酶、淀粉酶等水解酶类,分解原料形成丰富的发酵前体物质,有利于风味物质的形成[21]。如热乳杆菌具有分解蛋白质和水解淀粉的能力,可产酸、增香、增加酒体的绵甜感。地衣芽孢杆菌能生成如吡嗪类、芳香类、酸类及酚类化合物等风味物质[22],赋予了酱香型白酒独特的风格及健康因子。海洋芽孢杆菌属属于芽孢杆菌科,该属主要分布于深海环境、发酵食品环境[23],某些物种可用于氧化酶、淀粉酶、过氧化氢酶、酯酶和脲酶等工业酶制剂生产[24]。该菌属是酱香型白酒高温大曲制曲过程中第二次翻曲阶段的功能微生物,但具体的酿造功能未见报道[25]。
2.3 堆积发酵过程中理化指标分析
在酱香型白酒酒醅堆积过程中,水分、温度、总酸、蛋白质、淀粉含量、还原糖等理化指标随着堆积时间发生变化,并影响微生物的代谢和风味物质的形成。
水分是酱香型白酒生产过程中重点控制的工艺参数[26]。水分过高,堆积酒醅透气性差,好氧性微生物生长受到抑制,厌氧菌含量增加,导致酒醅酸败[27]。水分过低,微生物的代谢受抑制,影响酒的产量和质量。如图5所示,二轮次酒醅在堆积过程中水分含量在47%~50%之间,在0~84 h其呈下降趋势,在84~168 h呈上升趋势,前期随着发酵温度的升高,水分蒸发速度增加,水分含量下降,后期伴随着微生物的大量繁殖和淀粉降解,水分含量呈现逐渐上升趋势。
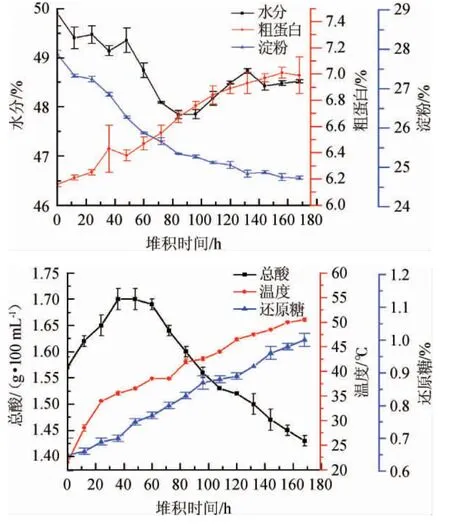
图5 二轮次堆积发酵过程中酒醅理化指标变化情况Fig.5 Changes of physical and chemical indexes of fermented grains during the second rounds stacking fermentation
蛋白质是酿造过程中微生物的主要氮物质来源,具有形成风味物质、促进美拉德反应以及酒体风味特征形成等功能[28]。在二轮次堆积发酵过程中,酒醅中的粗蛋白呈上升的趋势,含量从6.16%增加至6.99%。
淀粉是酿造过程中微生物生长繁殖的能量来源,淀粉含量高低与出酒率成正比。由图5可知,在二轮次堆积发酵过程中,随着发酵时间的延长,酒醅中淀粉含量逐渐下降,从27.88%下降至24.73%,淀粉逐渐被微生物分解。
由淀粉等多糖物质水解可形成还原糖。酒醅中还原糖含量的变化情况基本上反映了糖化与发酵速度的平衡与协调。如图5所示,还原糖含量在二轮次堆积过程中呈明显的上升趋势,含量从0.65%上升至1.00%。
在堆积发酵过程中,酸物质含量呈现动态变化趋势。如图5所示,在堆积发酵前期细菌大量生长繁殖并分泌有机酸,酒醅酸度缓慢上升。酒醅堆积48 h后,由于堆积温度的上升,产酸微生物代谢活动被抑制,且有机酸在酯类等风味物质的合成过程中被消耗,在堆积后期酒醅中酸度呈下降趋势。
温度是评价高温堆积成效的重要指标之一[29],当堆积酒醅顶温达到50 ℃左右进入窖池发酵,适宜的温度有助于酒体风味的形成和质量的提高。如图5所示,在二轮次堆积发酵过程中,伴随着微生物的大量生长代谢所释放的热量使堆温持续升高,顶温达到50 ℃以上。
2.4 理化指标与微生物群落相关性分析
为了探究堆积发酵过程中微生物之间相互作用关系,以及酒醅理化指标对酒醅微生物多样性的影响,利用SPSS软件对酒醅优势微生物属(相对丰度>1%)和酒醅样品的理化指标(水分、粗蛋白、淀粉、总酸、温度和还原糖)进行斯皮尔曼(Spearman)相关性分析并计算相关系数,结果见表3。

表3 堆积发酵酒醅中理化指标与优势微生物属的相关性Table 3 Correlation between physicochemical parameters and dominant microbial genera in fermented grains during stacking fermentation
结果表明,粗蛋白含量与裸胞壳属、毕赤酵母属的丰度呈负相关,与假丝酵母属的丰度呈正相关,其中粗蛋白含量与裸胞壳属的相对丰度呈极显著负相关(P<0.01)。淀粉、总酸含量与海洋芽孢杆菌属、曲霉属、裸胞壳属、毕赤酵母属、节担菌属的相对丰度呈正相关,其中淀粉含量与曲霉属、裸胞壳属的相对丰度呈极显著正相关(P<0.01),总酸含量与海洋芽孢杆菌属、曲霉属、裸胞壳属、毕赤酵母属的相对丰度呈极显著正相关(P<0.01)。温度与假丝酵母属的相对丰度呈正相关,与裸胞壳属、毕赤酵母属的相对丰度呈负相关,其中温度与裸胞壳属的相对丰度呈极显著负相关(P<0.01)。还原糖含量与海洋芽孢杆菌属、假丝酵母属的相对丰度呈正相关,与裸胞壳属、毕赤酵母属的相对丰度呈负相关,其中还原糖含量与裸胞壳属的相对丰度呈极显著负相关(P<0.01)。在堆积过程,水分、粗蛋白、淀粉、总酸、温度、还原糖等指标都在发生变化,影响着微生物的繁殖和代谢,同时这些条件也受到微生物繁殖和代谢的影响。通过研究分析,将微生物群落与理化指标变化规律相关联,对阐明堆积工艺的酿造机理,提高酱香型白酒品质和发酵效率具有重要意义。
3 结论
本研究利用高通量测序法分析酱香型白酒二轮次堆积发酵酒醅样品中的微生物组成,并采用多元统计分析探讨了理化因子对微生物结构的影响。共检测出171个属微生物,其中包括125个属细菌,46个属真菌。发酵过程中真菌以曲霉属,假丝酵母属,裸胞壳属,毕赤酵母属,红曲霉属,毛孢子菌属,节担菌属,威克汉姆酵母属等为主;细菌以芽孢杆菌属,乳杆菌属,海洋芽孢杆菌属,高温放线菌属,枝芽孢菌属、片球菌属,光冈菌属等为主。相关性分析结果表明,粗蛋白含量与裸胞壳属的相对丰度呈极显著负相关(P<0.01),淀粉含量与曲霉属、裸胞壳属的相对丰度呈极显著正相关(P<0.01),总酸含量与海洋芽孢杆菌属、曲霉属、裸胞壳属、毕赤酵母属的相对丰度呈极显著正相关(P<0.01),温度与裸胞壳属的相对丰度呈极显著负相关,还原糖含量与裸胞壳属的相对丰度呈极显著负相关(P<0.01),水分含量与微生物多样性之间相关性不显著。本研究初步推断了环境因子对群落驱动作用,后续将从功能层面,采用多组学技术,揭示堆积发酵过程中微生物的功能贡献,为关键功能菌的挖掘及堆积发酵的调控提供理论依据。

