基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性
周 森,王 成,朱绍宾,赵文俊,刘京国
(北京农学院 生物与资源环境学院 农业农村部华北都市农业重点实验室,北京 102206)
白酒是我国特有的传统发酵食品,具有悠久的酿造历史和文化内涵,根据不同香型分类,我国白酒可被细分为清香型、浓香型、米香型、酱香型等12种香型。其中,浓香型白酒以“窖香浓郁、绵柔甘洌、香味协调”的酒体风格在我国白酒行业中占据主导地位,其年产量占全国白酒的70%左右,在国家级名酒中约占50%[1]。浓香型白酒风味的形成除与原料、酿造工艺有关,还与大曲的质量有着重要联系,大曲是浓香型白酒生产的前提,是酿造优质浓香型白酒的关键[2]。浓香型大曲常以小麦为原料,采用生料制曲,自然接种,自然发酵而成,品温可达50~60 ℃[3]。由于大曲制作过程中受原料、环境的影响较大,使得大曲中微生物情况十分复杂。已有研究表明,浓香型大曲中含有大量不同种类的真菌和细菌,其代谢所产生的淀粉酶、糖化酶、蛋白酶等对白酒发酵、生香及产酯等方面起着重要作用[4]。
目前,对于浓香型大曲真菌微生物研究主要有传统分离方法和免培养方法两种。如向慧平等[5]利用纯培养技术对11份浓香型白酒大曲酵母进行选择性分离,所获得的194株酵母菌均归属于酵母目;窦骁等[6]对浓香型白酒大曲酵母菌进行分离鉴定,共获得260株酵母菌,分为22个种,并确定异常维克汉姆酵母(Wickerhamomyces anomalus)和扣囊覆膜酵母(Saccharomycopsis fibuligera)是制曲过程中的优势酵母,扣囊覆膜酵母是成品曲中的优势酵母。传统分离虽然能够有效获得大曲活体菌株,但由于大曲微生物往往适应了高温、低水分的制曲环境,在人工培养模式下,由于培养环境和条件的不同,会导致微生物可培养性降低,大量具有重要作用的微生物资源被埋没[7]。近年来,随着现代分子生物学技术的不断完善与发展,对大曲中真菌群落结构的研究不再受传统微生物纯培养技术的限制,如变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、高通量测序等分子生物学技术可直接从分子水平研究大曲真菌微生物资源,为大曲真菌群落结构及多样性解析奠定了坚实的基础。如谭崇尧等[8]利用高通量测序对不同地域浓香型白酒大曲进行菌群结构研究,结果表明北方派浓香型白酒大曲优势真菌有热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、威克汉姆酵母属(Wickerhamomyces)等,长江中游派优势真菌为曲霉属(Aspergillus)、热子囊菌属、嗜热真菌属,江淮派优势真菌有曲霉属、热子囊菌属、耐干霉菌属(Xeromyces)等,川派优势真菌有热子囊菌属、嗜热真菌属、曲霉属等;吴树坤等[9]利用高通量测序分析了四川不同地区浓香型白酒大曲微生物群落结构,发现大曲中优势真菌为嗜热真菌属、曲霉属、嗜热子囊菌属、丝衣霉属(Byssochlamys)、节担菌属(Wallemia);施思等[10]利用高通量测序技术研究了浓香型白酒大曲贮藏过程中微生物多样性的变化,结果发现在贮存过程中大曲真菌群落结构不断调整,毕赤酵母属(Pichia)、根霉属(Rhizopus)及横梗霉属(Lichtheimia)成为最终的优势菌群。
浓香型白酒在我国的白酒消费市场上占据着主导的地位,因此对浓香型白酒大曲中的微生物进行研究,对解析大曲的代谢机理、丰富大曲微生物资源及保证大曲质量具有十分重要的意义。目前,虽然已有浓香型大曲真菌群落组成的相关研究,但多数研究往往采用较为传统的微生物分离技术及DGGE技术,难以系统确定大曲真菌组成情况,即使部分研究运用了高通量测序,但所研究样品往往存在数量较少的问题,很难全面反应浓香型大曲真菌真实组成情况。因此,本实验从四川15家不同浓香型白酒企业采集大曲样品,利用高通量测序技术分析其真菌群落组成及多样性,为进一步解析浓香型大曲微生物及微生物筛选等工作提供基础数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
大曲样品:分别采集自四川15家浓香型白酒酒企,编号为NX-1~NX-15,其中样品NX-1采集自四川巴中,NX-4、NX-6、NX-10、NX-11采集自四川成都,NX-3、NX-7、NX-8、NX-13采集自四川泸州,NX-2、NX-5采集自四川绵阳,NX-12采集自四川遂宁,NX-9、NX-14、NX-15采集自四川宜宾。样品采集后砸碎混匀,-80 ℃储存备用。
1.1.2 主要试剂
三氯甲烷、月桂酸钠、异戊醇、异丙醇(均为分析纯):上海生工生物工程有限公司;乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris-base)、酚(Phenol)(均为分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
1-14k高速冷冻离心机:德国Eppendorf公司;C1000快速梯度基因扩增仪;Powerpac Basic基础型水平电泳仪;GelDoc XR+BIO-RAD全自动凝胶成像仪:美国BIORAD公司:Illumina MiSeq测序仪:北京奥维森基因科技有限公司。
1.3 方法
1.3.1 大曲总DNA的提取
从-80 ℃冰箱中各取1 g大曲样品放入研钵中,倒入液氮,迅速研磨成粉末后转移到50 mL无菌离心管中,加入10 mL月桂酸钠缓冲液(5.844 g NaCl,10 g月桂酸钠,100 mL 1.0 mol/L Tris-HCl,40 mL 0.5 mol/L EDTA,pH 8.0,定容至1 L),并缓慢摇动离心管15~20 min。加入10 mL苯酚∶氯仿∶异戊醇(25∶24∶1,V/V),缓慢摇动10 min,12 000 r/min、4 ℃条件下离心20 min。吸取16 mL上清液至50 mL离心管中,加入12.8 mL异丙醇,上下缓慢颠倒数次,12 000 r/min、4 ℃条件下离心15 min,弃上清。加入1 mL体积分数为70%的乙醇反复轻轻振荡洗涤沉淀,12 000 r/min、4 ℃条件下离心15 min,弃乙醇。重复上一步骤后,将白色沉淀再次在12 000 r/min、4 ℃条件下短暂离心数秒,用移液枪吸干残留乙醇,白色沉淀置于37 ℃干燥箱中,烘干后添加0.9 mL TE缓冲液(pH 8.0)溶解脱氧核糖核酸(deoxyribonucleic acid,DNA)[11]。
1.3.2 Illumina MiSeq高通量测序
DNA检测合格后,送往北京奥维森公司,利用Illumina MiSeq测序平台对大曲真菌ITS1区基因序列进行测序。测序引物内部转录间隔区(internal transcribed spacer,ITS)1-F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-TGCGTTCTTCATCGATGC-3')。下机数据经拼接、过滤、剔除嵌合体,舍弃低质量序列等。利用USEARCH(v11.0.667)将序列按97%相似度聚类为可操作分类单元(operational taxonomic unit,OTU)。利用基本局部比对搜索工具(basic local alignment search tool,BLAST)在UNITE数据库(https://unite.ut.ee/analysis.php)对真菌序列进行分类注释,获得有效的OTU分类学信息。
1.3.3 数据分析
利用Mothur(v1.42.1)对序列数进行归一化处理,计算出稀疏曲线数据、Alpha多样性指数;基于R语言(3.6.1)分析微生物门、纲、属组成情况;基于R语言的vegan包进行主坐标分析(principal coordinates analysis,PCoA),进而分析不同浓香型大曲真菌组成情况。
2 结果与分析
2.1 浓香型白酒大曲真菌群落多样性分析
2.1.1 稀释曲线
有研究表明,稀释曲线能够反应测序深度情况[12]。浓香型白酒大曲样品真菌菌群的稀释曲线见图1。由图1可知,15份大曲样品的稀释曲线随测序深度的增加呈现先直线上升后缓慢上升直至趋向平坦,说明测序样品数据量已经能够反映样品中绝大多数的微生物菌群信息,再增加测序深度也无法获得更多的OTU,真菌菌群的多样性也不会发生改变,所测数据能够满足后续实验分析。
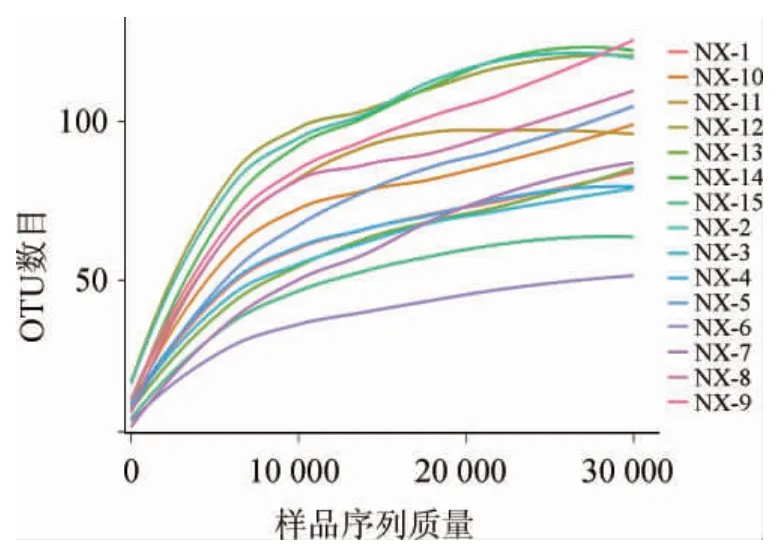
图1 浓香型白酒大曲样品真菌菌群稀释曲线Fig.1 Rarefaction curves of fungal community in strong-flavor Baijiu Daqu samples
2.1.2 Alpha多样性分析
15份大曲样品的真菌ITS区测序共获得657 848条真菌序列,按照97%相似度归类,并进行Alpha多样性分析,结果见表1。
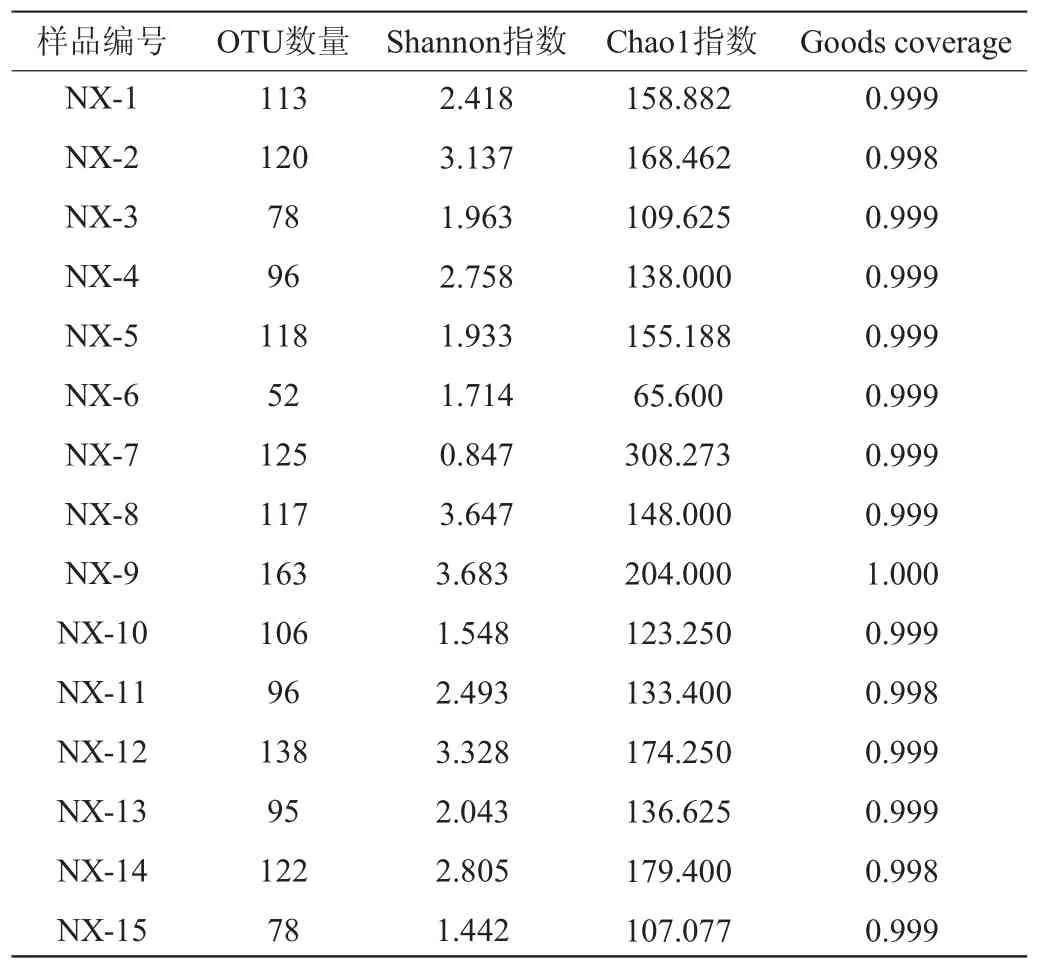
表1 15份浓香型白酒大曲样品真菌菌群α-多样性指数分析结果Table 1 Analysis results of α-diversity indexes of fungal community in 15 strong-flavor Baijiu Daqu samples
由表1可知,15份大曲样品累计共获得393个OTU,样品NX-9的OTU数最高,达到163,样品NX-6的OUT数最低为52。Goods coverage、Chao1、Shannon指数是Alpha多样性常用指数,其中Goods coverage指数用来反映测序得到的微生物群落的覆盖率[13],15份浓香型大曲样品的Goods coverage均>99.79%,说明该实验测序结果能够很好地反映样品中真菌的情况。Chao1指数用于计算物种丰度,其值越大说明样品的微生物群落的丰度越高,15份大曲样品中,样品NX-7的Chao1指数最高,达到308.3,样品NX-6的Chao1指数最低,仅为65.6。Shannon指数常用于计算菌群多样性指数,其值越大说明群落多样性越高,15份大曲样品中,样品NX-9的Shannon指数最高,为3.683,样品NX-7的Shannon指数最低,仅为0.847。结果表明,不同浓香型白酒大曲真菌微生物丰度及群落多样性存在较大差异。
2.1.3 Beta多样性分析
为进一步分析不同浓香型白酒大曲真菌群落相似性,本研究基于Bray Curtis距离对测序获得的OTU进行主坐标分析(principal coordinate analysis,PCoA)分析,以反应不同大曲真菌组成相似度,结果见图2。
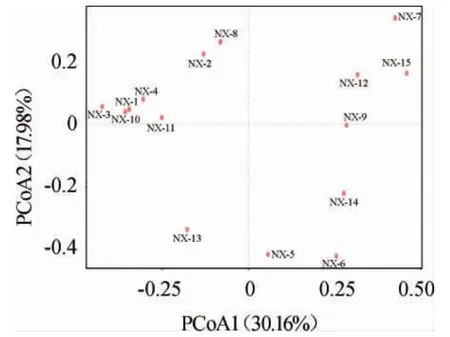
图2 基于OUT 15份浓香型白酒大曲样品真菌菌群PCoA结果Fig.2 PCoA results of fungal community in 15 strong-flavor Baijiu Daqu samples based on OTU
PCoA常用来研究样本群落组成的相似性或差异性[14],各个点之间的距离越大,表明它们之间的菌群差异越大[15]。由图2可知,PCoA1和PCoA2对样品差异性方差贡献率分别为30.16%和17.98%,累计方差贡献率为48.14%,其余主成分方差贡献率均低于10%,说明同一香型大曲中,15份大曲样品真菌组成存在一定差异,但并不明显。样品NX-1、NX-3、NX-4、NX-10、NX-11距离较近,样品NX-2和NX-8距离较近,说明样品NX-1、NX-3、NX-4、NX-10、NX-11真菌菌群组成相似,样品NX-2和NX-8真菌组成相似,其余样品距离较远,未出现明显聚类,说明不同酒厂浓香大曲真菌组成之间存在一定差异性。
2.2 浓香型白酒样品真菌菌群组成分析
基因门、纲及属水平15份浓香型白酒大曲样品中真菌群落结构见图3。由图3a可知,15份浓香型白酒大曲所检测到的393个真菌OTU隶属于6个门19个纲和117个属。在门分类水平,6个门分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、球囊菌门(Glomeromycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、罗兹菌门(Rozellomycota)。其中,子囊菌门在15份大曲中相对丰度较高,达到67.98%~99.48%,毛霉门在样品NX-9(26.98%)、NX-11(14.62%)和NX-6(11.13%)中相对丰度较高,其余门相对丰度较低。
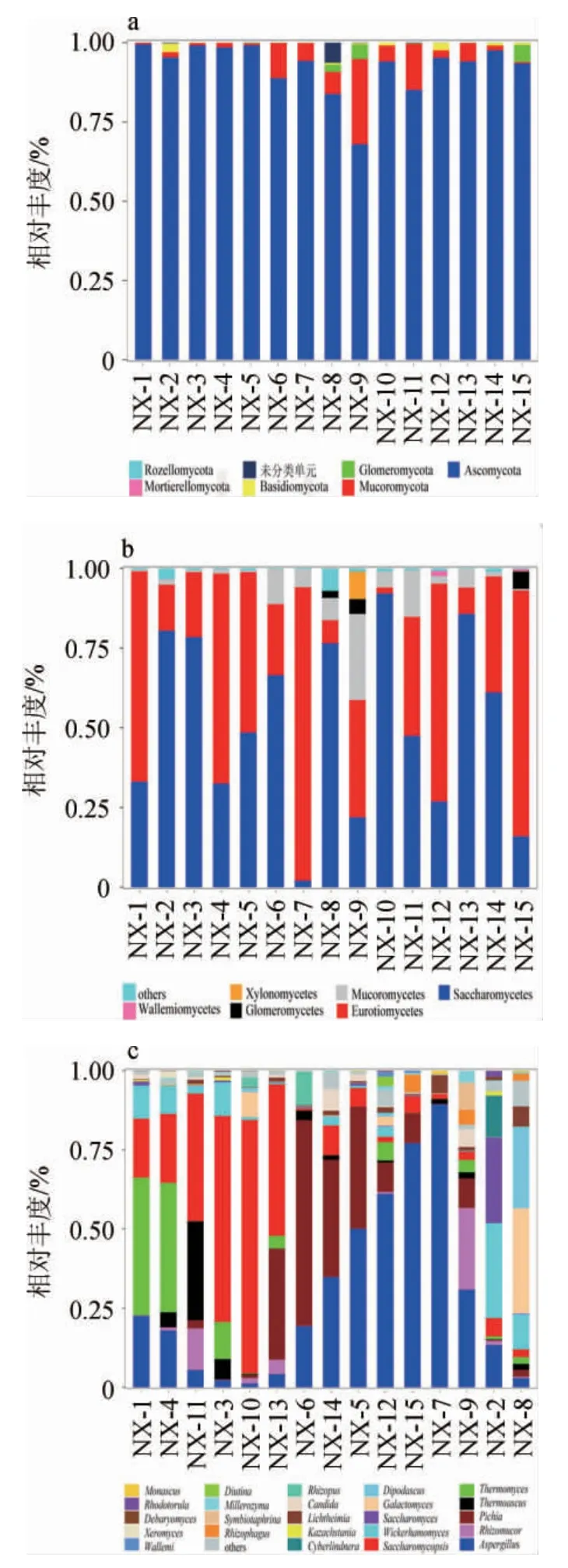
图3 基于门(a)、纲(b)及属(c)水平15份浓香型白酒大曲样品真菌群落结构Fig.3 Fungal community structure of 15 strong-flavor Baijiu Daqu samples at phylum (a),class (b) and genus (c) level
在纲分类水平上,共有19个纲被检测到,将相对丰度<1%及无法归类的纲合并为others。由图3b可知,15份大曲样品中,酵母纲(Saccharomycetes)和散囊菌纲(Eurotiomycetes)的相对丰度较高,二者相对丰度之和达到58.8%~99.1%。另外,Mucoromycetes在样品NX-9(26.98%)、NX-11(14.62%)、NX-6(11.13%)中也占有较高相对丰度,其余纲相对丰度较低。
在属分类水平上,共检测到117个真菌属,将相对丰度<1%及无法归类的属合并为others。由图3c可知,15份大曲样品中真菌菌群出现明显差异。样品NX-1、NX-4、NX-11中以嗜热类真菌的热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)为主,相对丰度较高,两者相对丰度之和达45.6%~31.3%,同时还含有一定量的覆膜孢酵母属(Saccharomycopsis)(18.7%~40.4%)和曲霉属(Aspergillus)(5.4%~22.4%)。样品NX-3、NX-10、NX-13、NX-6和NX-14则主要以酵母类的覆膜孢酵母属和毕赤酵母属(Pichia)为主,两者相对丰度之和达到46.4%~83%。样品NX-5、NX-12、NX-15、NX-7中曲霉属相对丰度较高,能够达到50%~89.3%。样品NX-9中丝状真菌相对丰度较高,曲霉属和根毛霉属(Rhizomucor)相对丰度之和达56.6%。样品NX-2主要以酵母类的威克汉姆酵母属(Wickerhamomyces)和酵母属(Saccharomyces)为主,相对丰度之和达到56.9%。样品NX-8以酵母类的耐碱酵母属(Galactomyces)和双足酵母属(Dipodascus)为主,相对丰度之和能够达到59%。
结果表明,虽然15份大曲样品门分类和纲分类较为一致,但真菌属组成存在较大的差异,丝状真菌类的Thermoas cus、Thermomyces、曲霉属、根毛霉属以及酵母类的酵母属、覆膜孢酵母属、毕赤酵母属、威克汉姆酵母属、耐碱酵母属和双足酵母属在不同大曲样品中相对丰度较高。在白酒酿造过程中,丝状真菌往往能够分泌多种酶类将原料中的淀粉、脂肪等降解,为酒醅的后期发酵提供多种前体物质。如曲霉属能够产生淀粉酶、蛋白酶等,是白酒发酵中淀粉等大分子物质分解的主要动力之一[16-17]。根毛霉属具有较强的产脂肪酶能力[18]。嗜热菌属和嗜热囊菌属同属于嗜热真菌类,能够生成具有更高热稳定性的木聚糖酶、脂肪酶等多种工业用酶类[19-20]。横梗霉属具有产α-淀粉酶、葡萄糖苷酶、纤维素酶和半纤维素酶的能力[21-23]。与丝状真菌相比,酵母类真菌在产香、产酒等方面具有较强作用,酵母属是白酒酿造过程中的优势酵母属之一,能够产生多种风味酯并贡献乙醇和其他有机酸[24-25]。毕赤酵母属、覆膜孢酵母属、假丝酵母属是大曲成熟过程中的优势菌属之一,在白酒酿造中具有潜在的风味贡献功能,其中覆膜孢酵母属具有较高的淀粉酶和糖苷酶活性,能将淀粉或多糖降解为低分子质量糖,最终水解为葡萄糖,在发酵前期起着至关重要的作用,同时覆膜孢酵母属还能够生成较多的多元醇,能够提高白酒纯甜感,改进白酒后味[26-28]。威克酵母属能够将原料中的前体物质转化成酯、酸、醇、醛等风味物质,对白酒风味形成有重要作用[29]。耐碱酵母属、双足酵母属在白酒微生物研究中也有报道,但功能性研究较少,如王鹏等[30]在中国白酒发酵过程核心微生物群研究中,将双足酵母属列为核心微生物之一;李凯敏等[31]研究表明,耐碱酵母属是特香型酿造过程中的优势菌之一,并在底糟中占到较高的比例。
3 结论
通过高通量测序分析发现,15份浓香型白酒样品中真菌群落的丰度和多样性存在较大差异,其中样品NX-1、NX-3、NX-4、NX-10、NX-11真菌组成相似,样品NX-2和NX-8真菌组成相似,其他样品真菌组成差异较大。15份大曲样品中共检测到393个操作分类单元(OTU),隶属于6个门19个纲和117个属,其中子囊菌门(Ascomycota)、酵母纲(Saccharomycetes)和散囊菌纲(Eurotiomycetes)在15份大曲样品中的相对丰度均较高。在属分类水平上,15份大曲样品出现明显差异,样品NX-1、NX-4、NX-11中的热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces),样品NX-3、NX-10、NX-13、NX-6和NX-14中的覆膜孢酵母属(Saccharomycopsis)、毕赤酵母属(Pichia),样品NX-5、NX-12、NX-15、NX-7中的曲霉属(Aspergillus),样品NX-9中的曲霉属和根毛霉属(Rhizomucor)、样品NX-2中的威克汉姆酵母属(Wickerhamomyces)、酵母属(Saccharomyces),及样品NX-8中的耐碱酵母属(Galactomyces)和双足酵母属(Dipodascus)相对丰度较高。本研究能够在一定程度上丰富人们对四川浓香型白酒大曲真菌菌群的认识,为进一步浓香型白酒大曲优势真菌微生物功能性研究及特色菌株应用提供一定理论支撑。

