miR-146a和miR-149多态性与子痫前期易感性*
黄丽莉,夏可辉,唐荣,郑林媚
海口市妇幼保健院 1产科,2检验科(海南海口570102);海南省人民医院、海南医学院附属海南医院 3肝胆外科,4产科(海南海口570102)
子痫前期是一种与高血压和蛋白尿有关的妊娠特有疾病,是导致孕妇及围生儿患病率及病死率高的重要原因之一。据估计,子痫前期在世界范围内的发病率为2% ~8%,在我国发病率为9.4% ~10.4%[1-2]。近年来,尽管对子痫前期有了较为深入的认识,但其具体发病原因尚未明确。由于子痫前期的异质性,基因遗传学和表遗传学等多种因素可能影响个体的易感性[3]。研究表明,在子痫前期母体中出生的男性,其所生的女性后代发生子痫前期的风险较高[4],提示遗传因素在子痫前期的发病过程中发挥了重要作用。近年来,子痫前期的表观遗传发病机制受到越来越多的重视。大量研究已经证实微小RNA(microRNA,miRNA)等表观遗传学变化参与子痫前期的发生和发展[5-6]。miRNAs是一类非编码RNA(20~24个核苷酸),在细胞凋亡、血管生成、生长、增殖和分化等生物学过程中发挥着重要作用,并通过对靶向mRNA的调控影响基因表达[7]。miR-146a是参与炎症过程中[8]最重要的miRNA之一。miR-149参与血管损伤应答过程,可调控循环系统血栓形成或炎症信号通路等相关基因表达[9-10]。rs2910164和rs2292832分别位于miR-146a和miR-149前体分子中,上述两个位点可能影响对应miRNA分子的成熟或其与靶基因核心序列的结合,最终诱发其调控靶基因功能紊乱。已有研究报道miR-146a和miR-149多态性与癌症[11]、缺血性中风(IS)[12]和心血管疾病等[13]有关,但miR-146a rs2910164和miR-149 rs2292832多态性对子痫前期影响的研究甚少。本研究旨在探讨miR-146a rs2910164和miR-149 rs2292832基因多态性与子痫前期的遗传易感性,从分子水平为子痫前期的病因学提供实验依据。
1 资料与方法
1.1 一般资料 经医院伦理委员会同意选取2016年7月至2018年7月在海口市妇幼保健院收治的子痫前期患者112例(病例组),其中轻度子痫前期患者70例(轻度组),重度子痫前期患者42例(重度组)。纳入标准:(1)均符合ACOG妊娠期高血压疾病指南(2015)中的标准:妊娠20周后血压≥140/90 mmHg,蛋白尿≥0.3 g/24 h(或试纸结果≥1+)。重度子痫前期表现为收缩压≥160 mmHg或舒张压≥110 mmHg或重度蛋白尿(24 h尿标本中蛋白≥5 g)。早发型子痫前期通常被定义为妊娠34周之前发生的疾病。(2)均为单胎妊娠,分娩方式均为子宫下段剖宫产术。(3)患者及家属知情同意并签署同意书。排除标准:胎儿畸形、肝功能障碍、肾脏疾病、自身免疫性疾病、糖尿病、慢性高血压和心脏病等疾病。同时选取正常妊娠孕妇(分娩方式为剖宫产)105例作为对照组。
1.2 方法
1.2.1 外周血DNA的提取 收集了纳入标准的PE患者和正常妊娠孕妇的外周静脉血,使用人类基因组DNA提取试剂盒提取DNA,放置于-80℃冰箱冻存备用。
1.2.2 PCR-RFLP测基因型 引物序列、退火温度、限制性内切酶、PCR产物长度见表1[14]。反应条件:(1)95℃预变性6 min;(2)95℃变性45 s;(3)在相应的温度下退火45 s;(4)72℃延伸45 s;(5)最终在72℃扩展6 min。上述过程持续35个循环,PCR产物上样于3%琼脂糖凝胶电泳进行电泳,并用DNA凝胶成像系统观察结果。
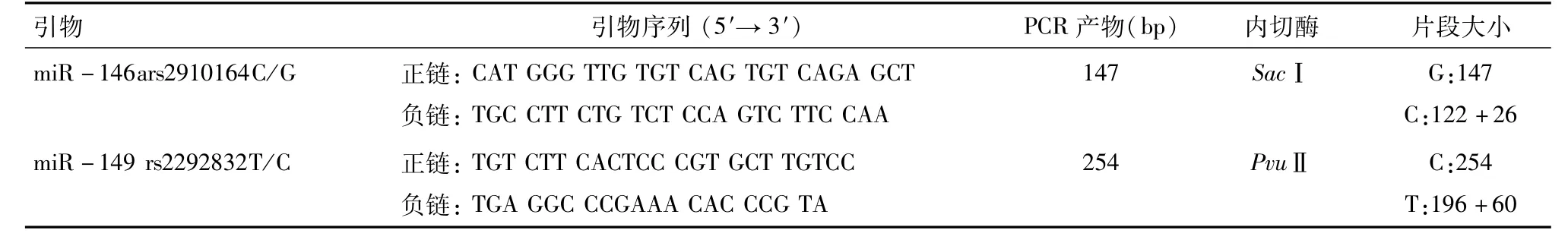
表1 引物序列
1.3 统计学方法 使用SPSS 17.0统计软件,采用Fisher精确测验和Student′s t检验比较病例组和对照组的临床特征。采用χ2检验对对照组内基因位点的平衡性进行检验,若P>0.05,则说明满足哈迪-温伯格平衡,相反,若P<0.05,则表明所选取的样本未达到随机平衡状态,不具有群体代表性。在logistic回归分析的基础上,采用优势比(OR)和95%置信区间(95% CI)测定子痫前期miRNA基因型之间的关系。采用logistic回归分析方法分析显性和隐性基因型中miRNA多态性与子痫前期的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 子痫前期组和正常妊娠组患者的临床资料 比较两组的年龄和初产妇所占比例,差异均无统计学意义(P>0.05),而子痫前期组中除收缩压和舒张压高于正常妊娠组(P<0.05),孕周和新生儿出生体重均明显低于正常妊娠组(P<0.01)。见表2。
表2 子痫前期组和正常妊娠组一般情况比较 ±s

表2 子痫前期组和正常妊娠组一般情况比较 ±s
变量 子痫前期组(n=112)对照组(n=105) P值年龄(岁)28.2±5.9 31.5±4.6 >0.05孕周(d) 247±11 270±13 <0.01出生体重(g) 2 614±198 3 109±215 <0.01收缩压(mmHg) 155±11 104±15 <0.05舒张压(mmHg) 99±10 72±13 <0.05初产妇[例(%)] 53(47) 47(45)>0.05
2.2 miR-146a rs2910164和miR-149 rs2292832多态性与子痫前期易感性的关系 miR-146a rs2910164位点基因型GG、GC和CC在子痫前期组和对照组中的频率分布比较差异均无统计学意义(P>0.05)。rs2910164位点多态性在等位基因型(P=0.038)和显性基因型(P=0.039)中与子痫前期的易感性有关。然而,在隐性基因型中没有发现此位点与子痫前期易感性之间的相关性(P=0.7)。miR-149rs2292832位点基因型或等位基因在子痫前期组和正常妊娠组中频率分布差异均无统计学意义(P>0.05)。见表3。

表3 miR-146a rs2910164和miR-149 rs2292832位点基因型和 等位基因在两组中的频率分布
另外,miR-146a rs2910164基因多态性分析结果显示,重度组患者的GC和CC基因型明显高于对照组(P=0.008;P=0.026)。此外,miR-146a rs2910164多态性在显性基因型与重度子痫前期的易感性相关(P=0.003),但未发现miR-146a rs2910164多态性与轻度子痫前期有相关性。miR-149 rs2292832基因多态性分析结果显示在不同的遗传基因型中均未见提高重度子痫前期的发病风险(P>0.05),rs2292832多态性与子痫前期严重程度无相关性。见表4。
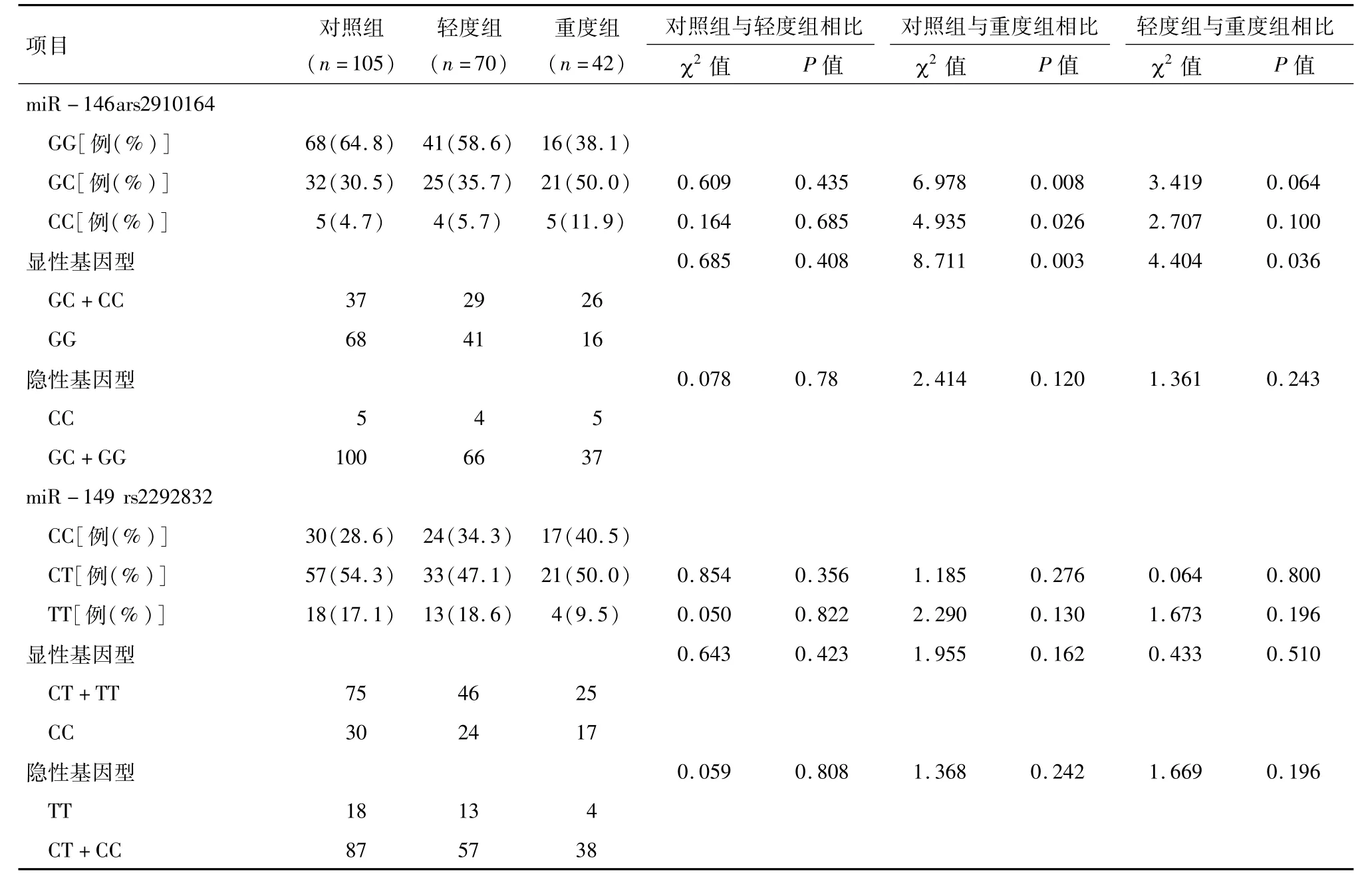
表4 对照组、轻度组和重度组miR-146a rs2910164和miR-149 rs2292832基因型频率分布情况
3 讨论
子痫前期是妊娠期特有的异质性疾病。除环境因素外,母体和胎儿(胎盘)遗传因素在子痫前期易感性中发挥着重要作用[15]。母体在妊娠期间表达大量具有特异性的miRNA,且miRNA表达量在不同孕周会发生相应的变化。有研究显示子痫前期患者的胎盘组织中可检测到miRNA表达的变化[16-17]。miRNA对血管生成、氧化应激、炎症、凋亡、胚胎发育等具有重要的调控作用,而这些生物学过程的异常均参与了子痫前期的发病机制。此外,已有研究证实miRNA在激活胎盘免疫效应和调节滋养细胞侵袭能力等几个过程中发挥一定的作用,而miRNA的功能受破坏或表达异常都有可能影响相关靶基因的表达[18]。
在正常妊娠中,多种miRNA在免疫调节中发挥着关键作用,包括miR-17-92簇、miR-146a、miR-155和miR-223,并且这些miRNA已被证实在子痫前期中表达失调[19]。有学者研究证实了miR-146a在调节Toll样受体(TLR)信号通路和炎症细胞因子机制中发挥重要作用[8]。目前miR-146a已作为产后心肌病[20]的生物标志物和治疗靶点。
在本研究中,我们发现与C等位基因相比,子痫前期患者的G等位基因频率更高。Abo-Elmatty等[21]研究显示妊娠期糖尿病合并子痫前期的患者miR-146a rs2910164位点等位基因C的频率更高。本研究还发现miR-146a rs2910164位点在等位基因型和显性基因型中均与子痫前期中存在统计学关联,此外,在显性基因型和隐性基因型中,miR-146a rs2910164多态性与重度子痫前期的易感性相关,说明此位点可能参与此病的发生、发展过程。因此miR-146a在炎症反应的发病机制中的作用可以部分解释其对子痫前期的可能影响。本研究结果与Salimi等[22]的研究结果一致。与Maharaj等[23]研究结果不同,该结果虽未证实miR-146a rs2910164多态性与子痫前期易感性之间存在关联,但发现GC/CC基因型可能会降低重度子痫前期的发病风险。造成各研究结果不同的可能原因与样本量小或纳入人群的地域、遗传背景、环境等因素差异有关。
MiR-149是另一种miRNA,在细胞中发现了2种成熟的miRNA亚型(miR-149-5p和149-3p)。人miR-149基因位于2q37.3,仅包含一个外显子。miR-149-5p可以预测多种涉及肿瘤进展所必需的相关因子的靶向基因,包括胰岛素、趋化因子和MAPK信号通路。有证据表明,miR-149可影响细胞凋亡、增殖、细胞周期进展。然而,miR-149在多种细胞[24]中可能发挥双重作用。在胎盘的发育[25]和癌症[26]的进展中发现了一些相似之处,包括快速增长、侵袭性生长和活跃的血管生成。在Guo等[27]的研究中,通过可调制模块性聚类(MMC)检测了子痫前期和宫内生长受限(IUGR)的一些分子标记,他们发现miR-149表达在子痫前期患者中有下调现象。但Yang等[28]发现,miR-149在子痫前期的母体血液和胎盘组织中均有升高。
目前尚无关于miR-149 rs2292832多态性和子痫前期可能影响的报道,但已有几项研究表明这种多态性对癌症、缺血性脑中风和心脑血管疾病的影响。Zou等[12]对亚洲人群进行的meta分析显示,miR-149 rs2292832 CC基因型与缺血性脑中风风险之间存在一定关系。在另一项研究中,Sung等[13]发现miR-149 rs2292832与心脑血管疾病相关。本研究结果显示miR-149 rs2292832位点的等位基因、基因型CT和TT在对照组和病例组中的频率分布差异均无统计学意义(P>0.05),进一步分析此位点在等位基因型、显性基因型和隐性基因型中均未见与子痫前期中存在统计学关联,此外,miR-149 rs2292832多态性与子痫前期和子痫前期严重程度之间无相关性,提示此位点可能不参与子痫前期中的发生过程,仅仅是一个遗传标记,非此病的遗传易感位点。
此外,本研究尚存在一些不足之处。首先,我们研究了miR-146a rs2910164基因多态性与子痫前期发病风险之间的关联性,但并没有对miRNA表达水平及其对相关的靶mRNA调控子痫前期的作用机制进行深入的探讨,因此,我们后续研究的主要方向将放在miRNA基因多态性与子痫前期的关系以及复杂的调控网络系统和机制上。其次,本研究样本量偏少,研究对象局限,下一步我们将扩大样本量和进行更多群裔群体的设计,采用大规模病例-对照研究,对研究miR-146a rs2910164与子痫前期的关系进行更深层次的探讨。
综上所述,本研究通过PCR-RFLP技术分别分析了miR-146a rs2910164和miR-149 rs2292832与子痫前期易感性的关系,结果显示,miR-149 rs2292832位点与子痫前期可能无关,但miR-146a rs2910164位点可能与子痫前期有关,可能是子痫前期的遗传风险易感因子。

