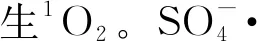Vis/LaFeO3/PDS复合高级氧化体系降解亚甲基蓝的机制
张连科,王 畅,李玉梅,樊 健,孙 鹏,韩剑宏
(内蒙古科技大学能源与环境学院,内蒙古 包头 014010)
LaFeO3是典型的钙钛矿型氧化物[1],具有独特的光、电、磁学性能及耐酸碱、耐高温等特性,在催化剂、光分解水制氢、电化学器件、燃料电池等方面有着广泛的应用[2]。作为磁性半导体材料,不同方法合成的LaFeO3的禁带宽度(Eg)基本在2.01~2.24 eV 之间,是一种便于磁回收和重复利用的可见光(Vis)响应型催化剂。然而LaFeO3价带电势(EVB)在2.10 eV左右,单独用于废水处理时除电子-空穴易于复合外,还因无法产生氧化能力较强的活性物质,使其在难降解有机污染物的处理领域中应用受限。
本研究以LaFeO3为催化剂,利用其窄带隙半导体的可见光催化能力和作为过渡金属复合氧化物对过二硫酸盐(PDS)的激发能力,构建Vis/LaFeO3/PDS复合高级氧化体系,探究复合体系对亚甲基蓝(MB)的降解机制,为复合高级氧化体系协同作用机制的研究提供参考。
1 材料与方法
1.1 试验试剂
试验所用试剂均为AR级,试验所用去离子水均为自制,电阻率为18.25 MΩ·cm。
1.2 LaFeO3的制备
称取0.01 mol硝酸铁、0.01 mol硝酸镧分别溶于20 mL的去离子水,磁力搅拌使其完全溶解。将硝酸镧溶液倒入硝酸铁溶液中,充分混匀后,加入0.03 mol柠檬酸,磁力搅拌使其完全溶解。将混合溶液在70 ℃水浴下每隔10 min用超声波辅助处理10 min,反复操作4次后继续在70 ℃水浴中加热并机械搅拌至形成溶胶。将所得溶胶置于105 ℃的干燥箱中干燥24 h形成黄褐色干凝胶。将此干凝胶研磨成粉末状后置于管式炉中,以10 ℃/min的升温速率升至600 ℃,以氮气作保护气烧结2 h,得到目标材料LaFeO3。
1.3 LaFeO3的表征
采用扫描电子显微镜(SEM,德式LEO 1530 VP型,德国ZEISS公司)对LaFeO3进行表面形貌特征和元素分析;采用X射线衍射仪(XRD, BRUKER D8 AA25型,德国Bruker公司)对LaFeO3进行物相分析;采用X射线光电子能谱仪(XPS, Thermo Scientific ESCALAB 250 XI型,英国Thermo公司)对LaFeO3反应前后表面元素化学态进行分析;采用紫外-可见光谱仪(UV-550,日本JASCA公司)测定LaFeO3的光吸收性能。
1.4 试验方法
在有效容积为250 mL烧杯中配制100 mL一定质量浓度的MB溶液,加入一定量的LaFeO3粉末,搅拌 30 min,使其达到吸附脱附平衡。将烧杯移入光反应器内,加入100 mL一定浓度的过硫酸钾溶液并开始计时,每隔一定时间取样,用0.45 μm的玻璃纤维滤膜过滤后,在625 nm波长下测定其吸光度。
2 结果与讨论
2.1 LaFeO3形貌分析
如图1所示,制得的样品整体呈现不规则的聚合片状形貌,平均厚度介于100~200 nm。利用EDS图像分析LaFeO3的组成成分,如图2所示,La和Fe的质量分数分别为31.69%和12.68%,比率约为2.48∶1,与LaFeO3化学式中La、Fe的理论配比相符。

图1 LaFeO3的SEM形貌图
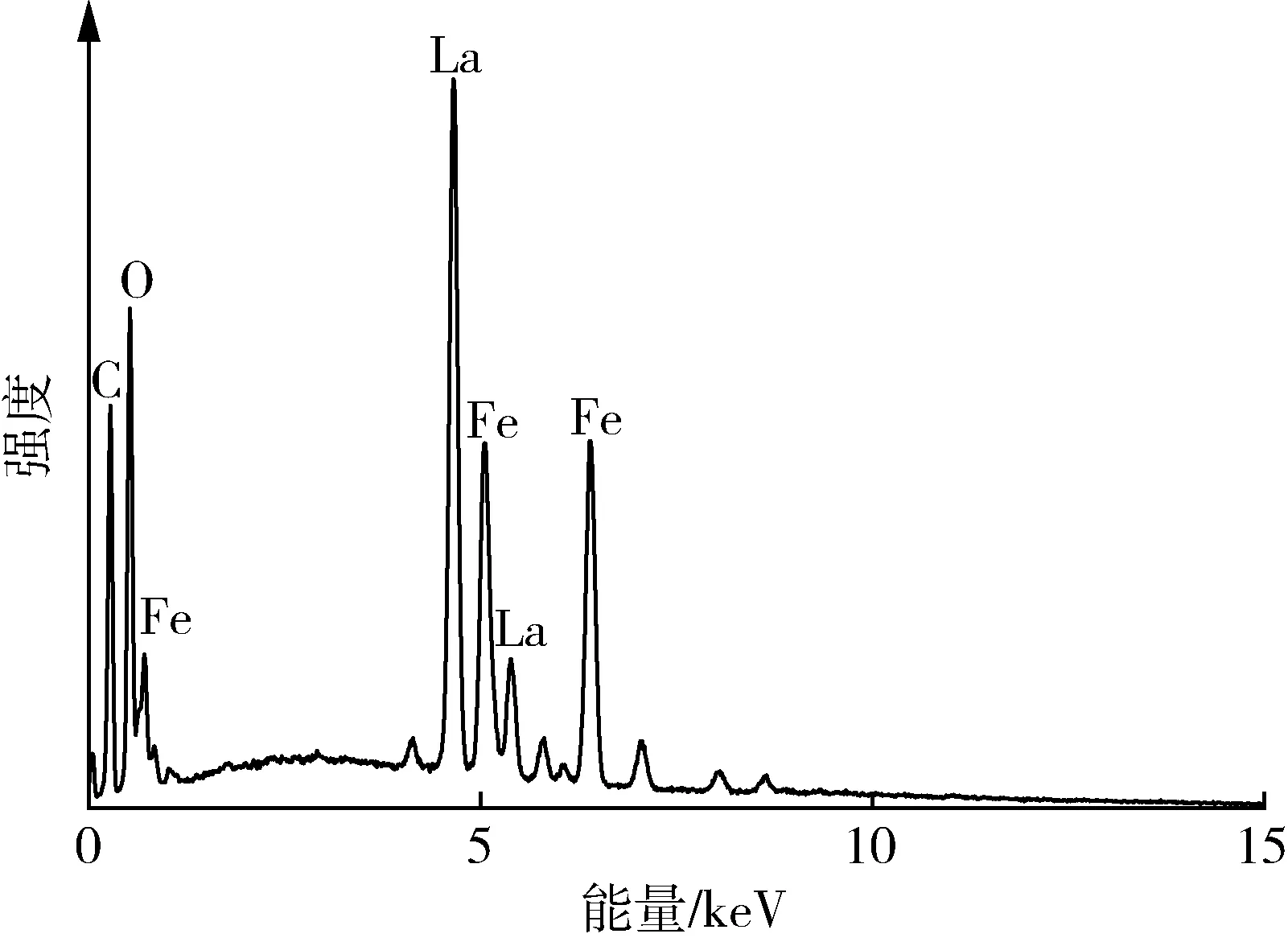
图2 LaFeO3的EDS图像
2.2 LaFeO3晶体结构表征和表面化学态分析
图3为LaFeO3的XRD图谱。谱线中2θ依次位于22.61°、25.30°、32.19°、39.67°、46.14°、52.00°、57.40°、67.35°、71.87°和76.64°,与LaFeO3所具有的特征衍射峰相吻合,且分别对应于钙钛矿型正交晶格LaFeO3的(101)、(111)、(121)、(220)、(202)、(141)、(240)、(242)、(143)和(204)衍射晶面,与PDF#88-0614标准卡片一致[12],说明本试验制备的LaFeO3晶体有较高的结晶度和纯度。

图3 LaFeO3的XRD图谱
图4为LaFeO3的XPS分析图谱。全谱图4(a)显示,结合能在0~900 eV范围内元素的能级轨道依次为:O 1s、Fe 2p和La 3d。图4(b)~(d)分别对应LaFeO3中La、O、Fe 3种元素的窄范围扫描。图4(b)中电子结合能834.9 eV与 851.6 eV 的两处峰分别对应未发生电荷转移的La 3d5/2和3d3/2自旋轨道,La 3d能级分峰是由于自旋轨道的相互作用和电子从氧配体2p轨道向La 4f轨道的转移;838.6 eV 与855.4 eV处的峰是由电荷转移所得最终态的反键和成键[13],上述结果表明La在LaFeO3中以+3价存在。图4(c)为LaFeO3中O 1s的XPS图谱,O 1s的峰位被分为529.9 eV、532.2 eV、533.9 eV处3个峰。低结合能529.9 eV处的峰对应于LaFeO3中的晶格氧,高结合能 532.2 eV 处的峰对应于吸附氧[14],二者与氧空位密切相关且影响着LaFeO3中Fe(Ⅲ)与Fe(Ⅱ)间的相互转换,从而影响LaFeO3的磁性。533.9 eV处的峰结合能最强,对应于LaFeO3表面吸附的水分子[15]。图4(d)中710.8 eV和724.8 eV处的双重峰对应Fe(Ⅱ)的2p3/2和2p1/2轨道。712.5 eV处的峰对应Fe(Ⅲ)的2p3/2轨道,719.9 eV处为Fe(Ⅲ)的伴峰[16]。合成LaFeO3显示很强的铁磁性,可能是由于LaFeO3纳米颗粒表面Fe磁矩的未补偿性自旋导致,而相邻颗粒表面间的吸附氧与Fe(Ⅲ)、Fe(Ⅱ)的相互交换作用可减弱LaFeO3内核的反铁磁性,增强其外壳的铁磁性。因此,本试验制备的LaFeO3便于通过外加磁场从处理水中快速回收和再利用。
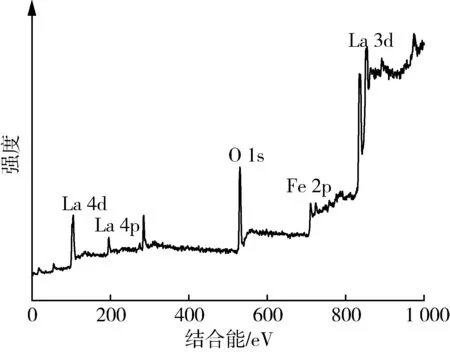
(a) LaFeO3
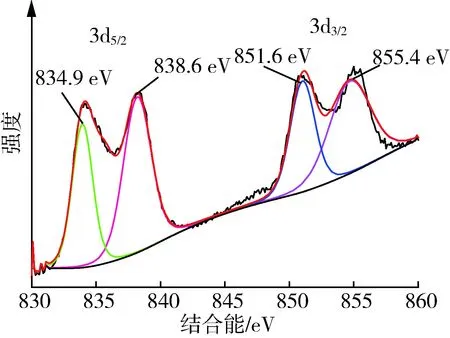
(b) La 3d

(c) O 1s

(d) Fe 2p
2.3 LaFeO3的紫外-可见漫反射分析
采用紫外-可见漫反射光谱法(UV-Vis)测定了制备的LaFeO3的光吸收性能,结果如图5所示,其中α为吸光度,h为普朗克常数,ν为光的频率。LaFeO3的吸收边界约为627 nm,对应的禁带宽度为2.04 eV,具有很好的可见光吸收性。LaFeO3的禁带宽度、价带电势、导带电势间的相互关系为[17]
EVB=X-EH+0.5Eg
(1)
ECB=EVB-Eg
(2)
式中:ECB为导带电势;EH为相对于氢电极电位的自由电子能量,EH=4.5 eV;X为半导体的绝对电负性,X=5.7 eV。由此得到LaFeO3的导带电势ECB=0.18 eV,价带电势EVB=2.22 eV。

(a) LaFeO3的UV-Vis图谱
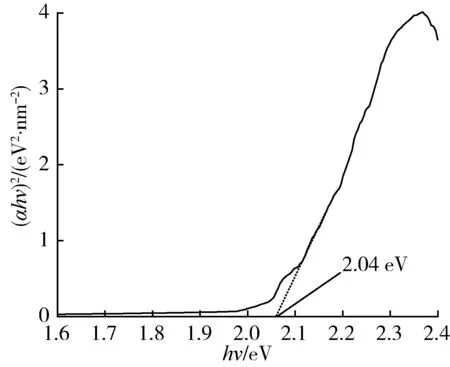
(b) LaFeO3的Tauc曲线
2.4 不同体系对MB的降解效果
Vis/LaFeO3、LaFeO3/PDS、Vis/LaFeO3/PDS 3种反应体系对MB的降解结果如图6所示。在MB质量浓度为30 mg/L、PDS浓度为0.5 mmol/L、LaFeO3投加量为0.5 g/L、不改变pH值的条件下,Vis/LaFeO3/PDS体系30 min对MB的去除率可达92.4%,较不添加氧化剂PDS的Vis/LaFeO3体系提升了75.2%,较LaFeO3/PDS体系提升了40.1%。
单独使用光催化技术的Vis/LaFeO3体系,由于LaFeO3的禁带宽度为2.04 eV,可直接吸收可见光并在LaFeO3表面形成电子-空穴对。LaFeO3价带电势为2.22 eV,低于·OH/H2O电对的电极电势(2.42 eV)[18],却远高于MB的氧化电位(0.53 eV)[19],故无法将H2O氧化成·OH,而仅在空穴(h+)的作用下使MB得以氧化降解。由于LaFeO3具有光催化技术的固有缺陷,即光生电子-空穴对产生后极易复合,致使能够迁移至LaFeO3表面发挥氧化作用的h+很少,因此Vis/LaFeO3体系对MB的去除率很低。
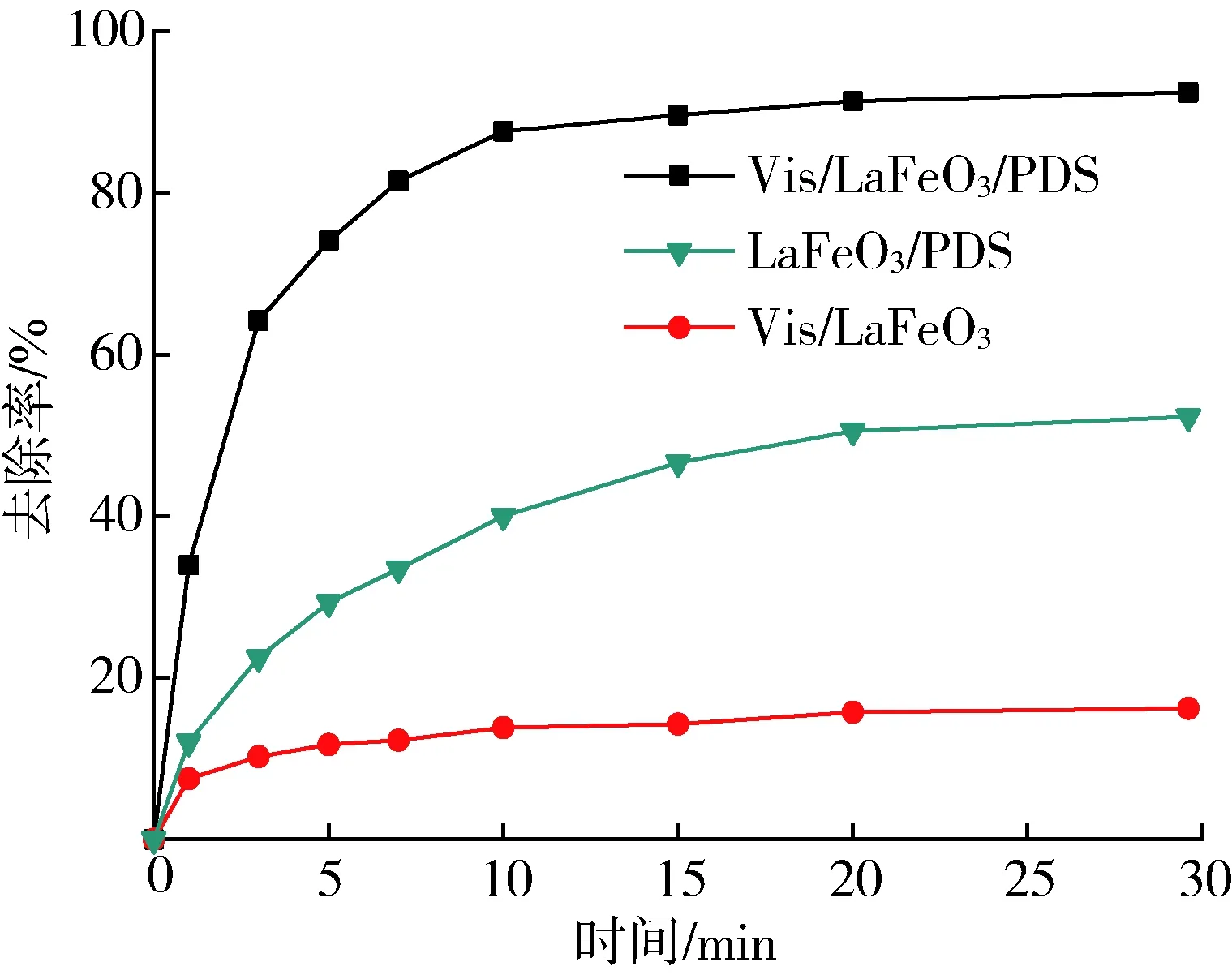
图6 不同体系中MB的去除率



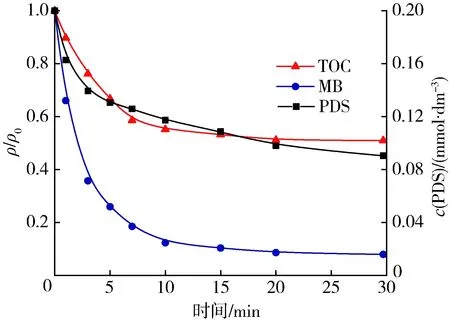
图7 MB、TOC相对质量浓度和PDS浓度变化
2.5 试验条件对Vis/LaFeO3/PDS体系降解MB效果的影响
不同试验条件下Vis/LaFeO3/PDS体系对MB的去除效果见图8。由图8(a)可见,当MB初始质量浓度为30 mg/L、LaFeO3投加量为0.25 g/L、PDS浓度为 0.2 mmol/L时,在溶液酸碱度呈中性、近中性条件下,MB的去除率相对较高;溶液偏酸或偏碱性时,MB的去除率均有小幅度下降,且碱性条件对MB的降解更加不利。这是因为初始pH值通常会影响催化剂的表面电荷和目标污染物的存在形态,进而影响非均相体系的催化活性[9]。PDS在不同pH值的溶液中一般都较为稳定,而催化剂中的金属离子在酸性条件下的浸出会导致催化活性降低[10]。当溶液碱性增强时(pH值大于5.7),LaFeO3的表面带负电荷,而MB的电离常数为4.52[11],故碱性条件下MB主要以带负电荷的去质子化形式存在,静电斥力使其与LaFeO3接触难度加大,致使体系中MB的去除率下降。


(a) 初始pH值

(b) LaFeO3投加量

(c) PDS浓度

(d) MB初始质量浓度


2.6 降解机理
2.6.1反应自由基的鉴定


图9 淬灭剂对MB去除率的影响
2.6.2Vis/LaFeO3/PDS体系降解MB的机制


图10 Vis/LaFeO3/PDS体系降解MB的机制
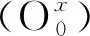
3 结 论
a.采用超声辅助溶胶-凝胶法合成了结晶度和纯度较高的聚合片状LaFeO3晶体,其平均粒径为100~200 nm,禁带宽度为2.04 eV,导带电势为 0.18 eV,价带电势为2.22 eV。
b.以LaFeO3为催化剂,利用可见光催化能力和其对PDS的激发能力,构建Vis/LaFeO3/PDS复合高级氧化体系降解MB。在PDS浓度为 0.5 mmol/L、LaFeO3投加量为0.5 g/L、MB质量浓度为30 mg/L条件下,Vis/LaFeO3/PDS体系反应 30 min 后,MB的去除率可达92.4%,Vis、LaFeO3、PDS三者具有明显的协同效果,复合体系有较强的pH值适应性,且便于磁性回收。