水飞蓟宾对糖尿病小鼠心肌损伤的治疗作用及机制探讨
刘鹏云,陈蕊蕊,纪兆乐,李泽霖,赵佩,秦超师,周海佳
空军军医大学唐都医院心血管内科,西安710038
糖尿病是导致心血管疾病发病率和病死率上升的主要原因之一[1]。糖尿病性心肌病是由糖尿病引起的与心脏结构和功能异常相关的临床疾病[2]。心肌肥厚、氧化应激、炎症、细胞凋亡和心肌间质纤维化是糖尿病心肌病的主要特征[3]。据估计,约有12%的糖尿病患者罹患有糖尿病心肌病,并可进一步演变为心力衰竭甚至导致患者死亡[4]。因此,临床上亟需寻找有效的治疗药物以延缓和减轻糖尿病心肌损伤。水飞蓟宾(SIL)是从乳蓟中分离的一种黄酮木脂素天然化合物[5]。近年来研究发现,SIL不仅有抗氧化、抗炎、抗菌和促进细胞再生等多种生物学活性[6],且有助于减轻多种病理因素导致的心血管疾病的病情[7-10]。然而,SIL对糖尿病心肌损伤的影响尚无研究报道。2020年8月—2021年7月,本研究观察了SIL对糖尿病心肌损伤的治疗作用,并初步探讨其机制,现报告如下。
1 材料与方法
1.1 实验动物与材料 雄性SPF级C57BL/6小鼠40只,8周龄,购自空军军医大学实验动物中心,使用许可证号SYXK(军)2012-0022,饲养于清洁级环境。SIL和链脲佐菌素(STZ)购自美国Sigma公司。原位末端转移酶标记技术(TUNEL)检测试剂盒购自瑞士Roche公司。二氢乙锭超氧化物阴离子荧光探针(DHE)检测试剂盒购自美国Abcam公司。超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所。cleaved Caspase-3、NF-κB、β-actin抗体购自美国Abcam公司。
1.2 动物分组及干预 将40只小鼠随机均分为正常对照组、药物对照组、模型组和实验组,每组10只。模型组和实验组小鼠制作糖尿病模型:将小鼠适应性喂养1周,连续5 d给予STZ 50 mg/kg腹腔注射[11],继续给予高脂饲料喂养12周后测量空腹血糖值超过16.6 mmol/L判定为糖尿病模型制作成功。实验组小鼠于STZ注射后、药物对照组小鼠于同一时点给予SIL 100 mg/(kg·d)灌胃,正常对照组和模型组小鼠每天给予等体积的生理盐水灌胃。在STZ注射完成并连续干预12周后麻醉并处死小鼠,随即收集相关实验标本。
1.3 心功能评价 采用Vevo2100成像系统测量心径并评价心功能,获得经胸二维M型超声心动图、脉冲多普勒超声心动图以评价心脏收缩和舒张功能。彩色多普勒测量心室早期充盈峰值速度(E波)和晚期充盈速度(A波),计算E/A。M型超声心动图测量左心室收缩末期内径(LVESD)和左心室舒张末期内径(LVEDD),计算左心室射血分数(LVEF)和左心室缩短分数百分比(LVFS)。
1.4 心肌组织纤维化观察及纤维化指标基因检测 采用Masson染色法。将心脏标本制备成石蜡切片,按常规Masson染色步骤对组织切片进行着色并固定,光学显微镜观察并拍片,显示各组心肌组织纤维化程度。使用Image Pro软件对纤维化程度进行相对定量分析。采用RT-PCR法检测心肌组织中的纤维化指标TGF-β1、Collagen Ⅰ、Collagen Ⅲ基因。使用TRIzol试剂从心脏组织中提取总RNA。采用PrimeScript RT试剂盒对RNA进行逆转录制备cDNA。采用ABI7500系统进行PCR反应。反应条件为95 ℃预变性30 s,95 ℃预变性5 s,60 ℃预变性34 s,共40个循环。以2-ΔΔCt计算基因相对表达量。引物序列见表1。

表1 目的基因和内参引物序列
1.5 心肌组织氧化应激指标检测 采用DHE染色测定心肌组织活性氧(ROS)水平。将心脏标本制备成冰冻切片,用DHE荧光染料干预后用经PBS冲洗,37 ℃水浴箱中黑暗环境下孵育30 min,使用激光共聚焦显微镜观察并采集图像。DHE染液与被氧化的DNA片段反应,产生亮红色荧光,测定荧光强度以反映ROS水平。取适量心脏组织,经预冷的PBS洗涤后制备成组织匀浆,按照SOD和MDA检测试剂盒说明检测SOD、MDA。
1.6 心肌组织炎症因子指标检测 采用RT-PCR法检测心肌组织中的TNF-α、IL-6、IL-1β mRNA。PCR方法和反应条件参考“1.4”。引物序列见表1。采用Western blotting法检测NF-κB蛋白。提取各组心脏标本总蛋白,用BCA法检测样品蛋白浓度;将50 μg蛋白通过SDS-PAGE分离,电转移到硝酸纤维素膜上;用5%脱脂牛奶封闭后,加入兔抗NF-κB和小鼠抗β-actin一抗孵育;洗涤后,用二抗再次孵育,使用增强化学发光试剂,通过Bio-Rad系统成像;采用Image J软件分析曝光蛋白条带的灰度值,以目的蛋白与β-actin蛋白灰度值比值表示目的蛋白相对表达量。
1.7 心肌细胞凋亡及凋亡相关蛋白检测 心肌细胞凋亡观察采用TUNEL染色法。将各组心肌组织石蜡切片按照TUNEL检测试剂盒说明书依次滴加TUNEL染液及DAPI染液,凋亡细胞核呈绿色。以TUNEL染色阳性细胞/全部细胞×100%计算细胞凋亡率。采用Western blotting法检测各组心肌组织中的cleaved Caspase-3蛋白,方法参考“1.6”。

2 结果
2.1 各组心功能指标比较 与正常对照组相比,模型组小鼠E/A、LVEF、LVFS显著减低,LVESD、LVEDD升高(P均<0.01)。与模型组相比,实验组小鼠E/A、LVEF、LVFS升高,LVESD、LVEDD减低(P均<0.01)。见表2。
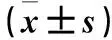
表2 各组小鼠心功能指标比较
2.2 各组心肌组织纤维化程度及纤维化指标基因表达比较 与正常对照组相比,模型组小鼠心肌间质胶原纤维明显增多且排列紊乱;与模型组相比,实验组小鼠心肌间质胶原纤维沉着显著减少。见图1。与正常对照组相比,模型组小鼠心肌组织纤维化比例及Collagen ⅠmRNA、Collagen ⅢmRNA、TGF-β1mRNA表达增高(P均<0.01);与模型组相比,实验组纤维化比例及Collagen ⅠmRNA、Collagen ⅢmRNA、TGF-β1mRNA表达降低(P均<0.01)。见表3。
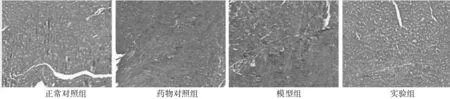
图1 各组小鼠心肌组织纤维化程度(Masson染色)
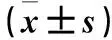
表3 各组小鼠心肌组织纤维化比例及纤维化指标基因表达比较
2.3 各组心肌组织氧化应激指标水平比较 与正常对照组相比,模型组小鼠心肌组织ROS、MDA水平增高,SOD活性下降(P均<0.01);与模型组相比,实验组ROS、MDA水平下降,SOD活性增高(P均<0.01)。见表4。
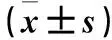
表4 各组小鼠心肌组织氧化应激指标水平比较
2.4 各组心肌组织炎症因子表达比较 与正常对照组相比,模型组小鼠心肌组织IL-1β、IL-6、TNF-α mRNA及NF-κB蛋白表达上调(P均<0.01);与模型组相比,实验组IL-1β、IL-6、TNF-α mRNA及NF-κB蛋白表达下调(P均<0.01)。见表5。
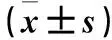
表5 各组小鼠心肌组织炎症因子表达比较
2.5 各组心肌细胞凋亡率及凋亡相关蛋白表达比较 正常对照组、药物对照组、模型组、实验组心肌细胞凋亡率分别为1.78%±1.03%、1.22%±0.71%、23.36%±3.53%、8.72%±2.62%,cleaved Caspase-3蛋白相对表达量分别为100.43±22.35、95.83±20.11、212.46±27.82、152.53±20.19。与正常对照组相比,模型组小鼠心肌细胞凋亡率、cleaved Caspase-3表达增高(P均<0.01);与模型组相比,实验组小鼠心肌细胞凋亡率,cleaved Caspase-3表达降低(P均<0.01)。药物对照组与正常对照组凋亡率及cleaved Caspase-3表达差异无统计学意义。
3 讨论
糖尿病心肌病是糖尿病的一种独立并发症,是在糖尿病患者未患有高血压、冠心病等其他心脏病的情况下发生的心肌结构和功能异常[1-2]。糖尿病持续的高血糖状态引起的心肌组织ROS过度生成和炎症反应异常放大在糖尿病心肌病的发生发展中起着关键作用[3,12]。因此寻找一种针对糖尿病心肌损伤过程的治疗药物,对减轻糖尿病心肌损伤及延缓糖尿病心肌病的发展具有重要意义。
SIL是从乳蓟中分离出来的一种黄酮木脂素天然化合物[5]。以往研究发现,SIL具有显著的抗氧化及抗炎活性,其对多种组织器官损伤的治疗作用已得到证实[6,13-14]。有证据显示,SIL也能够有效治疗多种心血管疾病。郑超等[7]发现,SIL可通过抑制氧化应激损伤和心肌细胞凋亡来缓解阿霉素的心脏毒性。曹旭丹等[8,15]发现,SIL对离体心脏缺血再灌注损伤具有一定的干预作用。陈旭等[9]认为,SIL可有效缓解内毒素血症心肌损伤。艾文[16]认为,SIL通过抑制心脏炎症和纤维化,最终抑制心肌肥厚的进展。本研究结果显示,SIL可明显减轻STZ诱导的糖尿病小鼠心脏收缩及舒张功能障碍,并显著抑制心肌纤维化进程,证明了SIL对糖尿病心肌损伤的治疗潜力。
高血糖促进心肌线粒体中ROS的生成,进而激活NADPH氧化酶,导致线粒体电子传递链功能和结构完整性缺陷[17]。过量的ROS促进脂质过氧化,从而导致氧化终产物MDA合成增加,改变心肌膜结构和酶活性[18]。SOD是生物抗氧化酶系的重要组成成员之一,也被报道在糖尿病心肌中活性显著下降[19]。本研究发现,与正常对照组相比,模型组小鼠心肌组织ROS、MDA水平增高,SOD活性下降,而给予SIL处理后ROS、MDA水平下降,SOD活性增高,提示SIL可能通过抗氧化应激发挥抗糖尿病心肌损伤的作用。
在糖尿病情况下,炎症反应对心肌产生明确的损伤作用。据报道,糖尿病心肌炎症形成的不同机制均与NF-κB分子的活化密切相关[20]。NF-κB是一种氧化还原敏感蛋白复合物,在炎症中起核心作用。一方面,高血糖可直接促进NF-κB的转录;另一方面,过量的ROS通过激活蛋白激酶C,进而促进NF-κB的活化[21]。NF-κB可促进TNF-α及炎症介质IL-1β、IL-6的转录和释放,引发心血管损伤,最终导致心肌炎症的发生[22]。本研究结果显示,与模型组相比,实验组小鼠心肌组织NF-κB蛋白表达下降,IL-1β、IL-6、TNF-α mRNA表达抑制,表明SIL还可能通过抗炎作用从而治疗糖尿病心肌损伤。
糖尿病患者心肌组织病理检查显示心肌胶原沉积异常增加,而氧化应激、炎症是糖尿病心肌纤维化的重要原因[23]。高血糖产生的过量ROS可诱导TNF-α激活,进而诱导心脏成纤维细胞增殖和胶原蛋白生成[24]。此外,心肌细胞和炎症细胞释放的细胞因子和促纤维化因子刺激糖尿病心脏纤维化,加速了心肌重构[25]。HAUDEK等[26]报道,TNF-α信号可同时刺激内在和外在的细胞死亡途径,增强Caspase-3的激活,促进心肌细胞凋亡。而TNF-α的促凋亡作用可能是通过NF-κB活化介导的。本研究结果显示,与模型组相比,实验组小鼠心肌间质胶原纤维沉着显著减少,CollagenⅠ、Collagen Ⅲ、TGF-β1mRNA表达明显被抑制,心肌细胞凋亡率减少,cleaved Caspase-3表达降低。这说明抑制心肌纤维化和心肌细胞凋亡也是SIL抗糖尿病心肌损伤的机制。
综上所述,SIL可改善糖尿病心肌损伤小鼠心功能,作用机制与减轻心肌组织纤维化、抑制心肌组织氧化应激损伤和炎症反应、抑制心肌细胞凋亡有关。

