DKK-1基因启动子甲基化与强直性脊柱炎病理性成骨的关系
陈慧 吴娟 邹宇聪
南方医科大学第三附属医院康复科(广州 510630)
强直性脊柱炎(ankylosing spondylitis,AS)是一种发病机制尚未明确的主要累及中轴骨骼的慢性炎症性疾病,特征是病理性成骨,最终可进展到脊柱或关节僵硬和永久性残疾[1]。因此AS 治疗的关键在于抑制病理性成骨。DKK-1 是Wnt/βcatenin 通路的天然抑制剂,其表达下调可促进大量骨质形成,是AS 病理性成骨的关键因子[2]。研究[3]表明AS 的骨赘形成与DKK-1 降低相关。然而DKK-1 表达下调机制尚未明确。
表观遗传学是在未改变DNA 序列情况下,研究基因可遗传性表达的一门学科[4],包括DNA 甲基化、非编码RNA、组蛋白翻译后修饰、染色质重塑[5]。DNA 甲基化是最常见的表观遗传修饰形式,通常基因高甲基化可导致基因“沉默”[6]。基因启动子区域富含CpG 岛,是发生DNA 甲基化的主要区域[7]。近期研究表明DKK-1 甲基化可促进子宫颈癌[8]、直肠癌[9]、白血病[10]等疾病的进展,而尚无DKK-1 甲基化与AS 的关联性研究。为了揭示在AS 中骨赘形成时DKK-1 下调的机制,选择髋关节强直的AS 患者为研究对象,检测骨化的髋关节囊的DKK-1 表达和甲基化状态,为AS 病理性成骨机制和治疗提供依据。
1 资料与方法
1.1 研究对象选取我院因髋关节强直需接受髋关节置换手术、成形术或病损切除术的AS 患者,均符合1984年修订的纽约诊断标准[11],此外选择因外伤致股骨颈骨折(FNF)需行髋关节置换手术的患者。
1.2 主要试剂及仪器组织DNA 抽提试剂盒(美基生物科技有限公司,广州);DNA 甲基化转化及纯化试剂盒(康为世纪生物科技有限公司,北京);PCR Master Mix(宝生物工程有限公司,大连);PCR仪(黑马医学仪器有限公司,珠海);引物(生工生物公司,上海);qPCR 试剂盒(invitrogen,美国);Anti-DKK1 antibody(abcam,美国);Goat Anti-Rabbit IgG(H+L)(southern biotech,上海)。
1.3 方法
1.3.1 髋关节囊滑膜组织获取无菌术中切除AS、FNF 患者髋关节囊滑膜组织,放置在含有冰袋的保温桶内保存并立即输送至实验室,将其放在液氮中保存。
1.3.2 DNA 样本的亚硫酸盐转化与纯化依照说明书严格进行髋关节囊滑膜组织的亚硫酸盐的转化和纯化。
1.3.3 MSP 和鉴定亚硫酸盐处理过的DNA 模板与M 和U 两对引物进行PCR 扩增。按照SYBR Green qPCR Super Mix 试剂盒,反应体系为20 μL:PCR Master Mix 10 μL,上、下游引物各0.5 μL,处理后的DNA 模板1.0 μL,余用蒸馏水补足。反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火20 s;72 ℃延伸30 s,共40 个循环。制备2%琼脂糖凝胶,电泳条件为120 V,30 min,在凝胶图像成像系统观察电泳结果。引物序列和大小见表1-2。

表1 DKK-1 引物序列和片段大小Tab.1 Primer sequence and fragment size of DKK-1
1.3.4 qPCR 检测DNMTs 的表达总RNA 完整性检测以及反应过程操作参照试剂盒流程。
1.3.5 Western Blot 检测DKK-1 表达总蛋白提取和实验步骤按常规进行。采用合适的稀释浓度的抗DKK-1 和内参蛋白抗β-actin 进行检测。使用ECL显影,条带结果利用Image J 8.0 软件分析结果。

表2 DNMTs、18s 引物序列Tab.2 Primer sequence DNMTs and 18s
1.4 统计学方法采用SPSS 26.0 统计软件处理数据,计量资料采用均数±标准差表示,比较行独立样本t检验,计数资料采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Western Blot 检测DKK-1 表达与FNF 组相比,AS 组DKK-1 明显下调(P<0.05)。如图1。
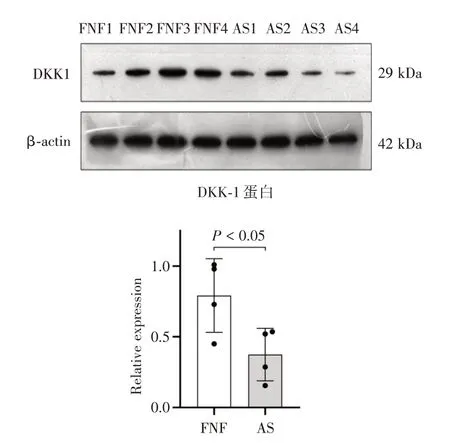
图1 DKK-1 表达Fig.1 Expression of DKK-1 protein
2.2 DKK-1 基因启动子甲基化状态比较FNF 组DKK-1 基因均为非甲基化状态,而AS 组呈现部分甲基化和完全甲基化状态。两组比较差异有统计学意义(P<0.05)。如图2。

图2 DKK-1 基因启动子甲基化Fig.2 Methylation status of DKK-1 gene promoter
2.3 qPCR 检测DNMTs 的表达与FNF 组相比,AS 组DNMT1 表达下降,DNMT3A、DNMT3B 表达升高,但两组比较差异无统计学意义(P>0.05)。如图3。

图3 DNMT1、DNMT3A、DNMT3B 表达Fig.3 Expressions of DNMT1,DNMT3A and DNMT3B
3 讨论
表观遗传修饰是调节基因表达的重要机制,研究表明DNA 甲基化在AS 的发生和发展中扮演着越来越重要的作用[12-14]。但AS 尚无DKK-1 甲基化的研究报道。本文首次检测了AS 患者的骨化髋关节囊的DKK-1 和甲基化水平,发现DKK-1 表达明显下调,甲基化水平明显升高,而DNMTs 表达无明显差异,提示DKK-1 高甲基化可能参与AS的病理性成骨的进展,对AS 的发病机制和诊疗具有重要意义。
本研究中AS 患者骨化的髋关节囊DKK-1 下调,这与前期研究[15]和DI 等[16]的发现一致,提示DKK-1 下调参与了AS 病理性骨化的进展。检测DKK-1 甲基化水平,发现DKK-1 高甲基化,提示DKK-1 下调可能源于高甲基化。目前大量研究以外周血DKK-1 为主,结果并不一致,表达增高、降低、不变但功能异常均存在,笔者认为主要与病程相关,因为AS 早期可出现溶骨性病变,其与DKK-1 水平升高相关,此外与样本来源、样本量、有无治疗等相关。该实验选择晚期AS 患者为研究对象利于DKK-1 与AS 异位骨化的关联。而目前DNA甲基化在疾病的诊断和治疗方面已取得进展,如结直肠癌的甲基化检测试剂盒[17]已上市。同时,去甲基化药物5-氮杂胞苷早已用于治疗白血病、MDS[18],近期也被投入肺癌、宫颈癌、类风湿关节炎等疾病的干预性基础研究[19-21]。因此DKK-1 甲基化可成为AS 的潜在生物标志物和提供新的治疗方案。
本研究中AS组与FNF组的DNMTs表达差异无显著性,提示DKK-1高甲基化可能源于DNMTs功能失调而非DNMTs表达升高。哺乳动物的靶基因甲基化水平调节依赖于DNMT1、DNMT3A 和DNMT3B,前者维持甲基化,后两者促进从头甲基化[22]。XU等[23]发现AS 患者的血浆DNMT1 mRNA 显著降低。ASLANI 等[14]发现AS 患者PBMCs 的DNMT1 下调且高甲基化,然而与AS 患者的ESR、BASDAI、BASFI等临床表现无明显相关性,提示DNMT1可能通过改变其他靶基因甲基化水平参与AS 的发生发展。另有研究发现AS 患者的全血样本的DNMT mRNA 相对于正常人明显下降[24]。上述结果均不一致,可能与样本量、是否接受治疗、AS 病程有关,因此仍需AS 骨化组织的DNMTs 的研究来支持笔者的推论。
本文存在部分局限性,一为样本量少,无法对年龄、性别、炎症水平、有无药物治疗等因素进行分层分析;二为无干预试验以验证5-氮杂胞苷的去甲基化作用是否可逆转DKK-1 下调及所致的异位骨化。日后将纵向观察DKK-1 和DKK-1 甲基化在AS 病情进展的变化,以及5-氮杂胞苷的作用,为AS 提供新的疾病标志物和诊疗方式。
综上所述,本研究推断DKK-1 高甲基化可能参与AS 的病理性骨形成,为AS 的发病机制、诊断和治疗提供新的线索。

