hBDNF-BMSCs局部移植对大鼠脊髓损伤的修复效果
连学辉 肖红利 邓江 韩子冀 齐维林
1贵阳市第一人民医院骨科(贵阳 550000);2遵义市第一人民医院骨科(贵州遵义 563000)
脊髓损伤(spinal cord injury,SCI)是脊柱外科常见的创伤,目前尚无确切的临床治疗方法,SCI及其继发性病理生理变化可导致神经功能的丧失,具有很高的致残率和病死率,因此SCI 的治疗仍然是个很棘手的难题[1-2]。近年来,研究者将基因治疗技术和干细胞移植联合应用于治疗SCI[3-5],一方面可以保护、挽救残存的神经元细胞;另一方面移植干细胞的存活、分化和迁移,可促进轴突再生并通过SCI 区[6]。
人脑源性神经营养因子(human brain-derived neurotrophic factor,hBDNF)为碱性蛋白质,在中枢神经系统的发育和维持正常生理功能起重要作用,还参与中枢神经系统损伤的修复,是一种重要的感觉和运动神经元营养因子[7]。研究[8-9]显示,hBDNF 在损伤脊髓的修复过程中,具有减轻炎症反应、抗凋亡、保护感觉及运动神经元的作用,可促进神经元轴突再生,参与突触联系的形成等。因此,hBDNF 已成为SCI 基因治疗首选的目的基因之一。骨髓间质干细胞(BMSCs)来源于成年人骨髓,属于非造血组织干细胞,有多能干细胞的特点,可向多种中胚层和神经外胚层组织细胞分化[10]。因此,BMSCs 可作为干细胞移植治疗SCI 的理想种子细胞。
综上,本研究拟应用干细胞移植技术联合基因治疗技术,将hBDNF 与BMSCs 结合,构建生物活性转基因干细胞hBDNF-BMSCs,并在SCI 节段局部注射移植,探讨hBDNF-BMSCs 在损伤大鼠脊髓内存活、分化、基因表达情况及其在损伤脊髓修复和神经功能改善中的作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂及材料重组腺病毒载体Ad5-hBDNF-EGFP(福建省骨科研究所);雄性SD 大鼠(质量100 ~150 g),上海斯莱克实验动物中心,许可证:SCXK(沪)2007-0005;DMEM/F12 和胎牛血清(Gibco,美国);青链霉素(HyClone,美国);CCK-8(biosharp,中国安徽);DAPI(索莱宝,中国北京);Rabbit Anti-hBDNF 和Mouse Anti-rabbit IgG/FITC(博奥森公司,中国北京);Rabbit Anti-NeuN/GFAP/p-NF-H/GAP-43,poly-HRP anti-Rabbit IgG(BD,美国)。
1.1.2 主要仪器CO2恒温培养箱(MCO-18AC,Panasonic,日本);低温高速离心机(centrifuge 5424R,Eppendorf,德国);透射电子显微镜(EM208,PHILIPS,荷兰);连续波长酶标仪(Synergy HTX,Bio Tek,美国);CountessⅡFL 全自动细胞计数仪(Thermo,美国);全自动化学发光凝胶成像系统(731BR03736,BIO-RAD,美国);倒置荧光显微镜(IX53,Olympus,日本);多道生理信号采集处理系统(RM6280,中国成都)。
1.2 方法
1.2.1 BMSCs 的提取、培养及扩增取成年SD 大鼠1 只,过度麻醉处死,无菌取股骨和胫骨,将骨髓冲到无菌培养皿中,经离心、重悬、淋巴细胞分离后,用完全培养基重悬,按1 × 104/mL 接种于培养瓶中,置于37 ℃、5%的CO2饱和湿度培养箱内静置培养。每天用倒置相差显微镜观察细胞,3 ~4 d 换液1 次,细胞生长至铺满瓶壁2/3 以上时传代,按1 × 105个/瓶进行传代。取第3 代BMSCs 进行实验。
1.2.2 重组腺病毒载体Ad5-hBDNF-EGFP 转染BMSCs取第3 代BMSCs,消化、离心、重悬后行细胞计数,将BMSCs 按5 × 104/孔接种于6 孔培养板中,待细胞长至50%汇合时,分别加入不同感染复数的Ad5-hBDNF-EGFP(MOI 分别为10、20、50、100、200)。转染24 h 后更换新的培养基,每天于荧光显微镜下观察,72 h 后提取总蛋白并采用BCA 法定量。
1.2.3 Western blot 法测定BMSCs 细胞中hBDNF蛋白的表达取1.2.2 中提取总蛋白,配制分离胶、浓缩胶,采用煮沸法制备各组待测样本及Marker,依次加入各电泳孔。常规电泳、转膜、封闭后,分别加入hBDNF 一抗(1∶500)及β-actin(1∶1 000)4 ℃孵育过夜,洗涤后将膜与辣根过氧化物酶标记的二抗(1∶2 000)室温孵育1 h,洗涤后,配制HRP超敏发光液,滴加显色,放入凝胶成像仪中曝光显色。
1.2.4 大鼠SCI 模型的建立及分组SD 大鼠96只,随机分为四组:假手术组、损伤对照组、空载体-BMSCs 组及hBDNF-BMSCs 组;每组分为4 个时相点,即损伤后1、2、4、6 周;每个时相点各6 只大鼠。在环境温度为(22 ± 2)℃,湿度为(55 ± 5)%的条件下饲养。保持室内通风良好,实验前预饲养1 周使其适应环境。本研究遵循美国科学院颁布的第八版实验动物使用指南,并且经过贵阳市第一人民医院伦理委员会审批。
采用改良Allen 重物打击法建立SCI 模型[11],使用直径2 mm 的无菌塑料垫片,将其放在脊髓胸10 节段,用质量为10 g 的无菌砝码由高5 cm 处落下打击垫片,导致胸10 节段SCI。模型构建成功表现:砝码撞击脊髓时,大鼠躯体出现抖动,双下肢出现回缩扑动,此后表现为迟缓性瘫痪,尾巴出现痉挛性摆动后,呈瘫痪状;损伤局部脊髓表面瘀血青紫,术后双下肢出现完全性瘫痪。模型构建成功后,每天挤压大鼠膀胱促进排尿2 次,持续7 d。假手术组手术切口及入路相同,仅暴露胸10 节段脊髓。
1.2.5 hBDNF-BMSCs 和空载体-BMSCs 悬液的制备选取转染最成功的hBDNF-BMSCs 和空载体-BMSCs,消化、离心、重悬后,PBS 洗涤2 次,用PBS 重悬后细胞计数,调整细胞浓度为1 × 106/mL备用。
1.2.6 大鼠SCI 处hBDNF-BMSCs 局部移植大鼠SCI 模型建立7 d 后行局部注射移植,操作如下:常规麻醉、消毒、铺巾后,取原皮肤切口,完全暴露胸10 节段脊髓,用10 μL 的玻璃微管注射器,以胸10 节段为注射部位,多点注射,每点注射0.5 μL,共2 μL,注射速度0.1 μL/min;同前方法行空载体-BMSCs 组局部注射;损伤对照组局部注射PBS 2 μL;假手术组同法显露胸10 节段,不作任何注射。移植后每天挤压大鼠膀胱促进排尿2 次,至大鼠能自行排尿为止。
1.2.7 大鼠的行为学变化采用BBB 评分法标准对大鼠SCI 后神经功能进行评判[12],各组大鼠分别在建模后24 h 和移植后第1、2、4、6 周时评分,观察大鼠的行为学变化。评判时将大鼠放在直径为1.5 m 的平面光滑场地自主活动5 min,由两名未参与移植手术的研究员观察并记录大鼠前后肢体运动的情况,并进行综合评分。
1.2.8 大鼠皮层体感诱发电位(cortical somatosensory evoked potentials,CSEP)的变化10%水合氯醛(0.3 mL/100 g)行腹腔内注射麻醉。用脑脊髓立体定位仪固定大鼠头部,在颅骨正中矢状线旁开约3 mm 及冠状线旁开约1.5 mm 处钻一直径约为3 mm 的圆孔,显露出硬脑膜,用直径为2 mm的银球引导电极置入圆孔,接触硬脑膜,用于大鼠CSEP 的记录,将银针参考电极置于皮肤切口处。于对侧下肢外侧游离出坐骨神经,安置双极钩状刺激电极于坐骨神经上。刺激后收集并记录电位变化,刺激参数:刺激强度为7.5 V、波宽1.6 ms 的单方波,平均叠加100 次。分析参数:时间常数为0.02 s、灵敏度为500 μV,滤波频率为100 Hz。
1.2.9 大鼠脊髓组织标本的获取与制备各组大鼠在各时相点用10%水合氯醛(0.3 mL/100 g)行腹腔内注射麻醉。麻醉成功后,活体下完整切取实验区脊髓,分别用作电镜检测、液氮保存、连续冰冻切片。各时相点其余大鼠用多聚甲醛经腹主动脉灌注固定24 h 后切取试验区脊髓,脊髓取出后常规甲醛固定、脱水及石蜡包埋。
1.2.10 各组大鼠损伤脊髓组织形态学观察取移植治疗6 周后的各组大鼠脊髓石蜡标本切片(层厚5 μm),制成病理切片,将切片脱蜡、水化,HE 染色后光学显微镜下观察大鼠损伤脊髓组织形态学变化。
1.2.11 各组大鼠损伤脊髓组织的超微结构变化取移植6 周后各组脊髓组织,用3%戊二醛-1.5%多聚甲醛-0.1 mol/L PBS(pH7.2),4 ℃条件下固定2 h;0.1 mol/L PBS(pH 7.2)漂洗3 次;再用1%锇酸-1.5%亚铁氰化钾,4 ℃条件下固定2 h,漂洗3 次;进行梯度乙醇-丙酮脱水,以无水丙酮+环氧树脂618 包埋剂包埋、聚合;最后用超薄切片机切取70 ~80 nm 的切片;用醋酸铀、柠檬酸铅进行染色5 min,在透射电镜(TEM)下观察各组大鼠脊髓组织的超微结构。
1.2.12 大鼠损伤节段脊髓中hBDNF 的表达取移植6 周后损伤对照组(Con-1)、空载体-BMSCs(Con-2)和hBDNF-BMSCs 组移植后(第1、2、4、6周)的大鼠实验区脊髓约50 mg,提取总蛋白,采用BCA 法测定浓度,检测BDNF 表达水平。
1.2.13 各组大鼠损伤脊髓组织NeuN、GFAP、p-NF-H、GAP-43 的变化取移植6 周后各组脊髓组织石蜡标本进行切片(层厚5 μm),制成病理切片,常规脱蜡、水化、抗原修复,以3% H2O2阻断内源性过氧化物酶。分别加入兔抗大鼠NeuN、GFAP、p-NF-H、GAP-43 一抗,室温孵育2 h,PBS 冲洗后滴加试剂1(Polymer Helper),常温孵育20 min,PBS 洗涤后滴加反应试剂2(poly-HRP anti-Rabbit IgG),常温孵育20 min,PBS 洗涤。将现配好的DAB 溶液滴加标本,常温显色时间为5 min,在显微镜下观察显色充分后,自来水洗涤终止反应。最后采用苏木紫复染组织后,采用中性树胶封片、显微镜观察,以PBS代替一抗设置阴性对照组。
1.3 统计学方法采用SPSS 18.0 进行统计分析。对于正态分布、方差齐的计量资料以均数± 标准差表示,两组间对比采用独立样本t检验,多组间比较采用单因素方差分析;计数资料的比较采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 hBDNF-BMSCs 构建及hBDNF 表达水平采用大鼠骨髓成功提取并培养高纯度BMSCs,并通过重组腺病毒载体Ad5-hBDNF-EGFP 转染BMSCs 获得hBDNF-BMSCs,并且随着MOI 的 增加,hBDNF 的表达逐渐增强,当MOI = 100 时,hBDNF 表达达到峰值(P<0.05),见图1。
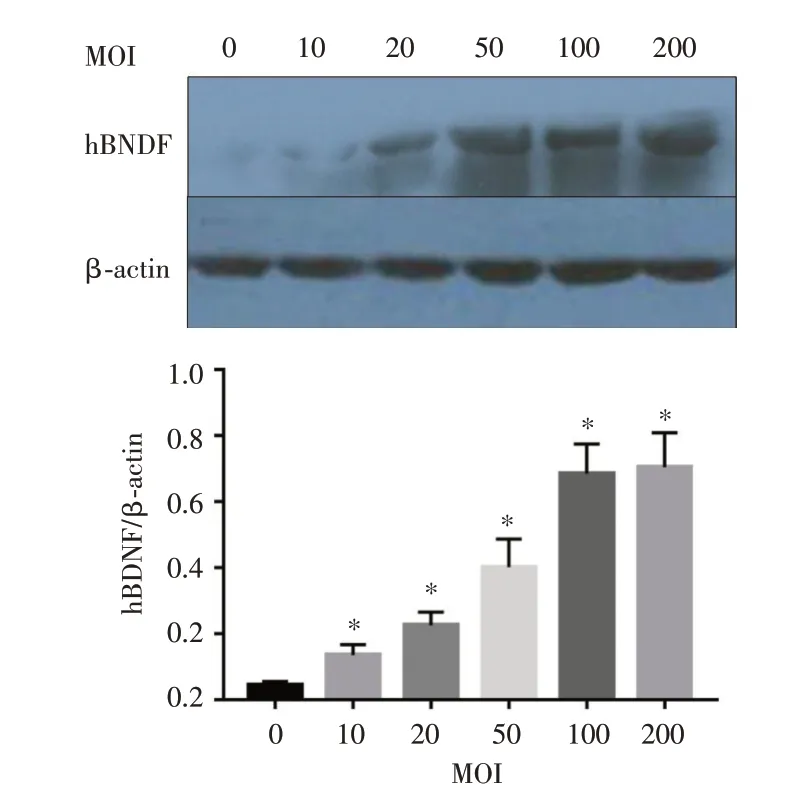
图1 不同MOI Ad-hBDNF-EGFP 转染后BMSCs 中hBDNF的表达水平Fig.1 The expression level of hBDNF in BMSCs transfectedwith different MOI Ad-hBDNF-EGFP
2.2 hBDNF-BMSCs 局部移植治疗大鼠SCI
2.2.1 hBDNF-BMSCs 移植后大鼠的行为学变化移植治疗后6 周,hBDNF-BMSCs 组、空载体-BMSCs 组及损伤对照组大鼠的运动功能均有不同程度的恢复;其中,hBDNF-BMSCs 组恢复最快,空载体-BMSCs 组其次,损伤对照组运动功能恢复较慢(P<0.05),见表1。
表1 移植后6 周各组大鼠行为能力BBB 评分Tab.1 BBB scores of behavioral ability of rats in each group 6 weeks after transplantation ±s,分

表1 移植后6 周各组大鼠行为能力BBB 评分Tab.1 BBB scores of behavioral ability of rats in each group 6 weeks after transplantation ±s,分
注:*与假手术组相比,#与损伤对照组相比,&与空载体-BMSCs组相比,P <0.05
损伤后24 h移植后1 周移植后2 周移植后4 周假手术组20.57±3.82 19.67±1.95 20.55±2.26 20.40±2.61损伤对照组1.80±0.22*5.28±0.90*6.44±1.41*8.60±1.49*空载体-BMSCs 组1.74±0.24*6.38±0.88 6.59±1.16*11.25±1.86*hBDNF-BMSCs 组1.72±0.15*6.68±0.73*9.81±1.95*#17.13±2.51#&
2.2.2 大鼠CSEP 的变化假手术组在各时间点均可记录到下肢CSEP 的P1波和N1波,hBDNF-BMSCs 组在损伤后24 h 及移植治疗后1、2 周,损伤对照组和空载体-BMSCs 组在损伤后24 h 及移植治疗后1、2、4 周,均记录不到CSEP。hBDNF-BMSCs组在移植治疗后4 周可记录到CSEP,但P1波潜伏期明显延长、P1-N1波幅小。在移植治疗后6周,各组均可记录到CSEP,与损伤对照组和空载体-BMSCs组相比,hBDNF-BMSCs 组大鼠CSEP 的P1波潜伏期明显缩短、P1-N1波幅显著加大(P<0.05),见表2。
表2 治疗6 周后各组大鼠CSEP 变化Tab.2 Changes of CSEP in rats of each group after 6 weeks treatment ±s

表2 治疗6 周后各组大鼠CSEP 变化Tab.2 Changes of CSEP in rats of each group after 6 weeks treatment ±s
注:与假手术组比,*P <0.05,△P <0.01 ;与损伤对照组比,#P <0.05;与空载体-rMSCs 组比,&P <0.05
组别假手术组损伤对照组空载体-BMSCs 组hBDNF-BMSCs 组P1 波潜伏期(ms)8.84±1.59 30.32±3.40△13.65±1.08*10.61±2.09#&P1-N1波幅(μV)306.88±53.10 53.10±6.97△114.34±15.03△#228.64±18.25*#&
2.2.3 大鼠损伤脊髓组织形态学观察移植治疗6 周后各组脊髓组织HE 染色及TEM 显示:假手术组脊髓灰质和白质组织结构清晰,脊髓灰质见较多神经元细胞,呈多形性,胞质染色均匀,可见细胞核和核仁,胞膜完整,胞浆内见较多结构完整的粗面内质网、线粒体、高尔基复合体、糖原、核糖体等细胞器;损伤对照组组织结构疏松、紊乱,可见明显的结构空白区,并见较明显的胶质瘢痕形成,脊髓灰质中神经元细胞较少,胞膜不完整,细胞核内染色质溶解,胞浆内线粒体肿胀,部分细胞器崩解;空载体-BMSCs 组组织结构较损伤对照组清晰,坏死区及胶质瘢痕较少,脊髓灰质中可见较少量神经元细胞,形态及结构较规则,胞膜完整,细胞核大,核仁可见,胞浆内可见较完整的各种细胞器;hBDNF-BMSCs 组组织结构较清晰,坏死区较小,胶质瘢痕少,脊髓灰质中可见较多神经元细胞,形态及结构较规整,胞膜完整,细胞核大,核仁可见,胞浆内见较多结构完整的细胞器,见图2-3。

图2 移植治疗6 周后各组大鼠损伤脊髓组织形态学变化(HE×40)Fig.2 The morphological changes of the injured spinal cord.of rats in each group after 6 weeks transplantation treatment(HE×40)

图3 TEM 下观察移植治疗6 周后各组损伤脊髓组织超微结构变化Fig.3 Observation of the ultrastructural changes of injured spinal cord tissue in each group after 6 weeks of transplantation under transmission electron microscope
2.2.4 大鼠损伤节段脊髓中hBDNF的表达水平与对照组相比,移植后1 周时hBDNF 表达水平最高,随时间延长,hBDNF 的表达逐渐趋于稳定,6 周后仍可见明显的hBDNF 表达;损伤对照组和空载体-BMSCs 组损伤脊髓节段均未能检测到明显的hBDNF 的表达,见图4。
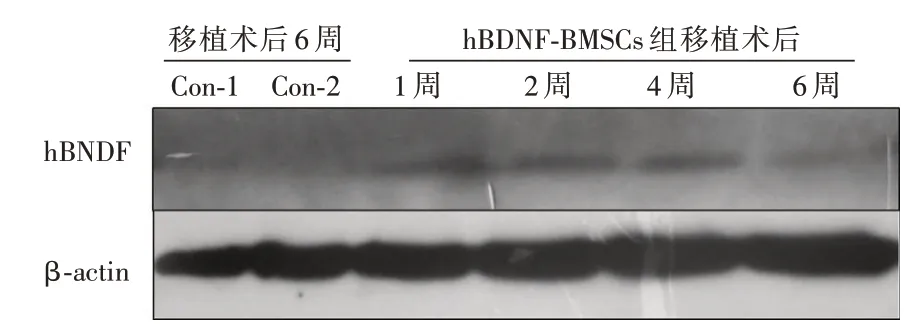
图4 hBDNF-BMSCs 移植后各组大鼠损伤脊髓节段中hBDNF 表达变化Fig.4 Changes in hBDNF expression in injured spinal cord segments of rats in each group after hBDNF-BMSCs transplantation
2.2.5 NeuN 的表达情况各组脊髓灰质前角均可见NeuN 阳性表达的神经元,胞核深染,成棕褐色,核仁可见。与损伤对照组和空载体-BMSCs 组比较,hBDNF-BMSCs 移植组NeuN 阳性表达明显增高(P<0.05),见表3 及图5。
表3 各组大鼠损伤脊髓组织每高倍镜视野中NeuN 阳性细胞表达Tab.3 The expression of NeuN positive cells in each high-power field of the injured spinal cord tissue of each group of rats ±s

表3 各组大鼠损伤脊髓组织每高倍镜视野中NeuN 阳性细胞表达Tab.3 The expression of NeuN positive cells in each high-power field of the injured spinal cord tissue of each group of rats ±s
注:*与假手术组比,#与损伤对照组比,&与空载体-BMSCs 组比,P <0.05
组别假手术组损伤对照组空载体-BMSCs 组hBDNF-BMSCs 组细胞数11.25±3.3 5.50±2.08*6.25±2.21*10.25±3.40#&
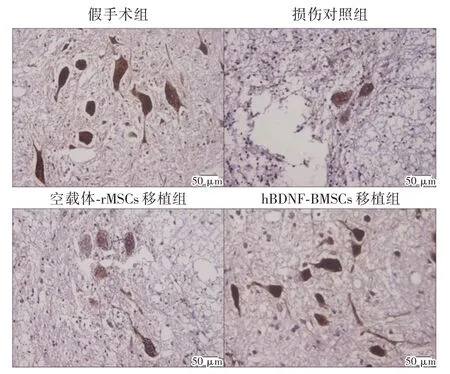
图5 移植治疗后6 周各组大鼠损伤脊髓组织NeuN 的表达情况(×200)Fig.5 The expression of NeuN in injured spinal cord tissue of rats in each group at 6 weeks after transplantation(×200)
2.2.6 GFAP 的表达情况各组均可见GFAP 阳性表达的星形胶质细胞,损伤对照组脊髓组织GFAP 阳性表达最高,空载体-BMSCs 组次之。与损伤对照组和空载体-BMSCs 组比较,假手术组和hBDNF-BMSCs 组脊髓组织的GFAP 阳性表达明显减少,hBDNF-BMSCs 组和假手术组之间无明显差异,见图6。
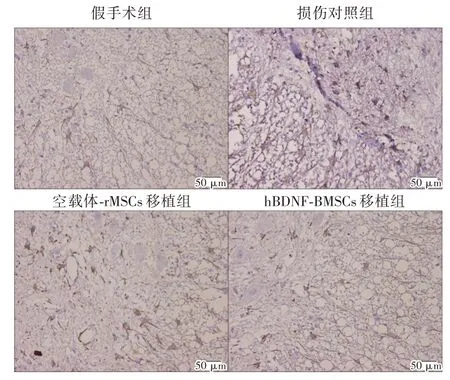
图6 移植治疗后6 周各组大鼠损伤脊髓组织GFAP 的表达情况(×200)Fig.6 The expression of GFAP in injured spinal cord tissue of rats in each group at 6 weeks after transplantation(×200)
2.2.7 p-NF-H 的表达情况各组SCI 节段纵切片免疫组化染色均可见p-NF-H 表达阳性的棕褐色纤维。hBDNF-BMSCs 组可见大量表达,纤维较长且粗大,多呈纵向排列,与脊髓长轴平行,其表达及排列明显优于损伤对照组及空载体-BMSCs 组,但低于假手术组,见图7。

图7 移植治疗后6 周各组大鼠损伤脊髓组织p-NF-H 的表达情况(×200)Fig.7 The expression of p-NF-H in injured spinal cord tissue of rats in each group at 6 weeks after transplantation(×200)
2.2.8 GAP-43 的表达情况各组SCI 节段纵切片免疫组化染色均可见GAP-43 表达阳性的棕褐色纤维。hBDNF-BMSCs 组可见大量GAP-43 表达,纤维较长且粗大,排列较整齐,与脊髓长轴平行,部分交织成网状,其表达及排列明显优于损伤对照组及空载体-BMSCs 组,见图8。

图8 移植治疗后6 周各组大鼠损伤脊髓组织GAP-43 的表达情况(×200)Fig.8 The expression of GAP-43 in injured spinal cord tissue of rats in each group at 6 weeks after transplantation(×200)
3 讨论
目前,动物实验研究显示BDNF 在损伤脊髓的修复过程中,具有减轻炎症反应、抗凋亡、保护感觉及运动神经元的作用,可促进神经元轴突再生[13]。BDNF 不仅具有诱导神经突起定向生长、决定感觉及交感神经纤维生长方向等作用,研究显示BDNF 还有运动神经的营养活性,可保护运动神经元,使其在SCI 后仍能存活[14]。MSCs 来源丰富,获取方便,体外培养扩增快速,具有多向分化潜能,在宿主组织中可长期生存并进行整合,可采用自体MSCs 进行体外培养、扩增并移植,可避免组织配型、免疫排斥反应等问题[15]。因此,采用自体MSCs 体外培养并移植治疗SCI 的方式,引起了广大SCI 修复研究者的关注。研究显示,SCI 后在损伤部位移植MSCs,MSCs 可在局部长期存活,并且与损伤脊髓组织整合良好,可促进SCI 修复,从而可改善SCI后的肢体功能[16]。
本研究成功提取、分离、培养、扩增获得BMSCs,并将重组腺病毒Ad5-hBDNF-EGFP 成功地转染第3 代大鼠BMSCs,结果显示BMSCs 的转染率及转染后hBDNF的表达水平呈MOI浓度依赖性和时相性,并对BMSCs细胞增值能力无明显影响,成功获取高表达hBDNF的hBDNF-BMSCs基因工程干细胞。
将hBDNF-BMSCs 局部注射移植治疗SCI,结果显示,与对照组和空载体-BMSCs 组相比,hBDNFBMSCs组大鼠神经功能和结构均明显改善:(1)BBB评分较移植前明显提高,大鼠行为能力明显改善;(2)CSEP 的P1波潜伏期明显缩短、P1-N1波幅大,脊髓神经传导功能明显改善;(3)各时相点均损伤脊髓中均可见BNDF 阳性表达,局部神经营养与保护功能持续存在;(4)损伤脊髓组织中脊髓灰质和白质组织结构较清晰,坏死区较小,胶质疤痕少,脊髓灰质中细胞形态、细胞核和核仁均清晰可见;(5)透射电镜下观察脊髓灰质,见大部分神经元结构正常,细胞形态、细胞器数量及形态均接近正常;(6)NeuN表达明显增多,GFAP 表达明显减少,提示hBDNFBMSCs 局部移植后可持续稳定地分泌BDNF,从而保护残留神经元存活并促进移植的BMSCs 转化为神经元样细胞,并且可使胶质反应和胶质疤痕形成减少;p-NF-H、GAP-43 表达均明显增加并排列规整,提示大量轴突再生并延长通过SCI区。
综上表明,携带外源性hBDNF 目的基因的hBDNF-BMSCs 基因工程干细胞局部注射移植治疗大鼠SCI,可保护、挽救神经元细胞,减轻神经元细胞的损伤和凋亡,促进移植干细胞的存活和向神经元样细胞分化,以及促进神经轴突再生并通过SCI 区域,进而促进大鼠损伤脊髓修复和神经功能恢复。其机制可能包括:(1)BMSCs 分化为神经细胞,从结构上修复SCI,再通受损的神经通路;(2)构建并维持抑制胶质细胞再生和胶质反应的微环境,减少胶质疤痕形成及炎性反应,利于轴突再生及通过损伤区;(3)hBDNF-BMSCs的营养支持作用:分泌损伤修复因子,如BDNF、NGF、VEGF 等,可保护神经并促进神经周围微血管再生,促进损伤脊髓血管新生、神经再生和损伤脊髓重构。
此外,本研究亦存在不足之处。本研究旨在研究“hBDNF-BMSCs 局部移植对大鼠SCI 的修复效果”,对hBDNF-BMSCs 移植后在大鼠SCI 中所发挥的功能机制,如分泌功能、修复功能、保护机制及趋化效应等,未行进一步的研究及分析,本课题组在后续研究中,将对上述功能进行深入研究,以明确其在SCI 中的修复机制。
综上,本研究显示hBDNF-BMSCs 局部注射移植治疗SCI,可在局部持续稳定分泌hBDNF,保护神经元存活并促进移植的BMSCs 转化为神经元样细胞,在损伤局部形成大量NeuN 表达阳性的神经元,减少胶质反应和胶质疤痕的形成,促进轴突再生并延长通过SCI 区,从而促进大鼠损伤SCI 后的修复。本研究展现了干细胞和神经营养因子的双重治疗作用,可加快损伤脊髓神经结构的修复及神经功能的恢复,为SCI 的再生及修复研究提供一定实验依据。

