circPTPRA靶向miR-556-3p对乳腺癌MDA-MB-231细胞增殖、迁移和侵袭的影响
白文辉 李英 李宗龙
青海红十字医院乳腺外科(西宁 810000)
乳腺癌严重威胁女性生命健康,其发生发展是多因素共同作用的结果[1-3],探究乳腺癌中异常表达的基因及其对该肿瘤发展的影响,可为其治疗提供新策略。circPTPRA是一种在肺癌中表达下调的环状RNA(circular RNA,circRNA),上调其表达可阻碍肺癌细胞上皮间质转化,降低小鼠异种移植瘤转移,抑制肺癌发展进程[4]。然而,circPTPRA 对乳腺癌发生发展的影响还未知。StarBase生物在线软件预测显示,circPTPRA 与miR-556-3p之间可能存在靶向调控关系。有报道称,miR-556-3p 在膀胱癌中表达升高,上调miR-556-3p 可促进膀胱癌细胞增殖、迁移、侵袭和集落形成[5]。但是,miR-556-3p 对乳腺癌发生发展的影响尚不明确。本研究主要观察circPTPRA 和miR-556-3p 对乳腺癌细胞MDA-MB-231 增殖、迁移和侵袭的影响及circPTPRA 能否靶向miR-556-3p 发挥作用,报道如下。
1 资料与方法
1.1 临床资料选择2015年10月至2018年5月于本院行手术治疗的41 例乳腺癌患者为研究对象,患者平均年龄(53.26±8.75)岁;TNM 分期Ⅰ期9 例,Ⅱ期17 例,Ⅲ期15 例;依据病理类型不同分为导管原位癌(8 例)、浸润性导管癌(28 例)和浸润性小叶癌(5 例)。纳入标准:首次确诊;术前未行任何治疗;经病理检查确诊。排除标准:同时患有其他肿瘤;自身免疫疾病、血液系统疾病等患者。研究符合《赫尔辛基宣言》。
1.2 细胞和试剂MDA-MB-231 细胞株,中国科学院上海细胞库;RPMI 1640 培养基、细胞计数试剂盒-8(cell counting kit-8,CCK-8)和双荧光素酶活性检测试剂盒,北京索莱宝;胎牛血清,美国Hyclone 公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、circPTPRA 过表达载体(pcDNAcircPTPRA)、空载体(pcDNA)、miR-556-3p 抑制剂(anti-miR-556-3p)和模拟物(mimcs)、抑制剂阴性序列(anti-miR-NC)及模拟对照序列(miR-NC),上海生工;RNA 抽提试剂盒、逆转录试剂盒和PCR 试剂盒,大连宝生物;LipofectamineTM2000 试剂盒,美国Invitrogen 公司。
1.3 方法
1.3.1 实时定量PCR(real-time quantitative PCR,RT-qPCR)检测circPTPRA 和miR-556-3p 表达充分研磨组织样本,用RNA 抽提试剂盒提取组织中总RNA,逆转录为cDNA 后,行PCR 扩增。2-△△Ct法计算circPTPRA、miR-556-3p的表达量。
1.3.2 细胞培养和转染用含10 %胎牛血清的RPMI 1640 培养基(完全培养基)培养MDA-MB-231 细胞。取6 孔板,接种MDA-MB-231 细胞(1×105个/孔),培养12 h 后,弃培养基。将LipofectamineTM2000 试剂与等体积终浓度为100 nmol/L 的pcDNA(pcDNA 组)、pcDNA-circPTPRA(pcDNA-circPTPRA 组)、anti-miR-NC(anti-miR-NC 组)、antimiR-556-3p(anti-miR-556-3p 组)、pcDNA-circPTPRA 与miR-NC(pcDNA-circPTPRA+miR-NC 组)、或pcDNA-circPTPRA 与miR-556-3p mimics(pcDNAcircPTPRA+miR-556-3p 组)混合均匀,缓慢加至6 孔板中。孵育6 h 后,换为完全培养基。再培养24 h,收集细胞用于后续实验。
1.3.3 CCK-8 法检测细胞增殖取96 孔板,接种各组细胞(1.0×104个/孔)。培养24 h,加10 μL CCK-8。孵育2 h,酶标仪450 nm 处测光密度(OD)值。
1.3.4 Transwell检测细胞迁移和侵袭迁移实验:于Transwell 上室接种各组细胞(1.0×104个/室),下室加500 μL 完全培养基。培养24 h,弃培养基,经多聚甲醛固定、结晶紫染色后,显微镜观察,记数。侵袭实验:除预先在Transwell 上室铺Matrigel基质胶外其余步骤同迁移实验。
1.3.5 双荧光素酶报告基因实验由上海生工根据StarBase 生物在线软件预测显示的circPTPRA 与miR-556-3p 的结合位点,分别构建circPTPRA 野生型荧光素酶载体(WT-circPTPRA)及突变型荧光素酶载体(MUT-circPTPRA)。取6 孔板,接种MDAMB-231 细胞(1×105个/孔),培养12 h 后,弃培养基。将LipofectamineTM2000 试剂与等体积终浓度为100 nmol/L 的WT-circPTPRA 与miR-556-3p mimics、WT-circPTPRA 与miR-NC、MUT-circPTPRA 与miR-556-3p mimics 或MUT-circPTPRA 与miR-NC 混合均匀,缓慢加至6 孔板中。孵育6 h 后,换为完全培养基。再培养24 h,弃培养基,裂解细胞。将裂解液离心(3 500 r/min、5 min)后,取上清,检测荧光素酶活性,结果以萤火虫与海肾的荧光强度比值表示。
1.4 统计学方法SPSS 22.0 软件分析数据。计量资料以均数±标准差表示。两组间比较用独立样本t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 circPTPRA 和miR-556-3p 在乳腺癌组织中的表达乳腺癌组织中circPTPRA 表达低于癌旁组织(P<0.05),miR-556-3p 表达高于癌旁组织(P<0.05),这说明circPTPRA 在乳腺癌组织中表达上调,miR-556-3p 表达下调。见图1。

图1 circPTPRA 和miR-556-3p 在乳腺癌组织中的表达Fig.1 The expression of circPTPRA and miR-556-3p in breast cancer tissues
2.2 过表达circPTPRA 抑制乳腺细胞增殖与pcDNA 组比较,pcDNA-circPTPRA 组MDA-MB-231细胞中circPTPRA 表达升高(P<0.05),OD值降低(P<0.05),说明过表达circPTPRA 可阻碍MDAMB-231 细胞增殖。见图2。

图2 过表达circPTPRA 对MDA-MB-231 细胞增殖的影响Fig.2 The effect of overexpression of circPTPRA on the proliferation of MDA-MB-231 cells
2.3 过表达circPTPRA 抑制乳腺癌细胞迁移和侵袭与pcDNA 组比较,pcDNA-circPTPRA 组MDAMB-231 细胞迁移和侵袭数降低(P<0.05),说明过表达circPTPRA 可阻碍MDA-MB-231 细胞迁移和侵袭。见图3。
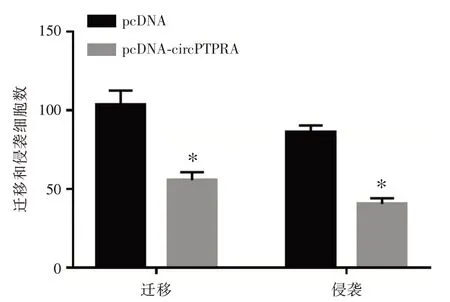
图3 过表达circPTPRA 对MDA-MB-231 细胞迁移和侵袭的影响Fig.3 The effect of overexpression of circPTPRA on the migration and invasion of MDA-MB-231 cells
2.4 circPTPRA 靶向调控miR-556-3p 的表达共转染WT-circPTPRA 与miR-556-3p mimics 的细胞荧光素酶活性为(0.55±0.05),明显低于共转染WT-circPTPRA 与miR-NC 的细胞荧光素酶[(1.01±0.08),t=14.628,P<0.05];共转染MUT-circPTPRA与miR-556-3p mimics 的细胞荧光素酶活性为(1.02± 0.06),与共转染MUT-circPTPRA 与miR-NC 的细胞荧光素酶比较差异无统计学意义[(1.04±0.04),t=0.832,P=0.418],说明circPTPRA 可靶向结合miR-556-3p。pcDNA-circPTPRA组MDA-MB-231细胞中miR-556-3p表达量低于pcDNA组[(0.47±0.04)vs.(1.00±0.04),t=28.107,P<0.05],说明过表达circPTPRA 抑制miR-556-3p 表达。
2.5 敲减miR-556-3p 抑制乳腺癌MDA-MB-231细胞增殖、迁移和侵袭anti-miR-556-3p 组MDAMB-231 细胞中miR-556-3p 表达、细胞OD值、迁移和侵袭数低于anti-miR-NC 组(P<0.05),说明敲减miR-556-3p 可阻碍MDA-MB-231 细胞增殖、迁移和侵袭。见图4。
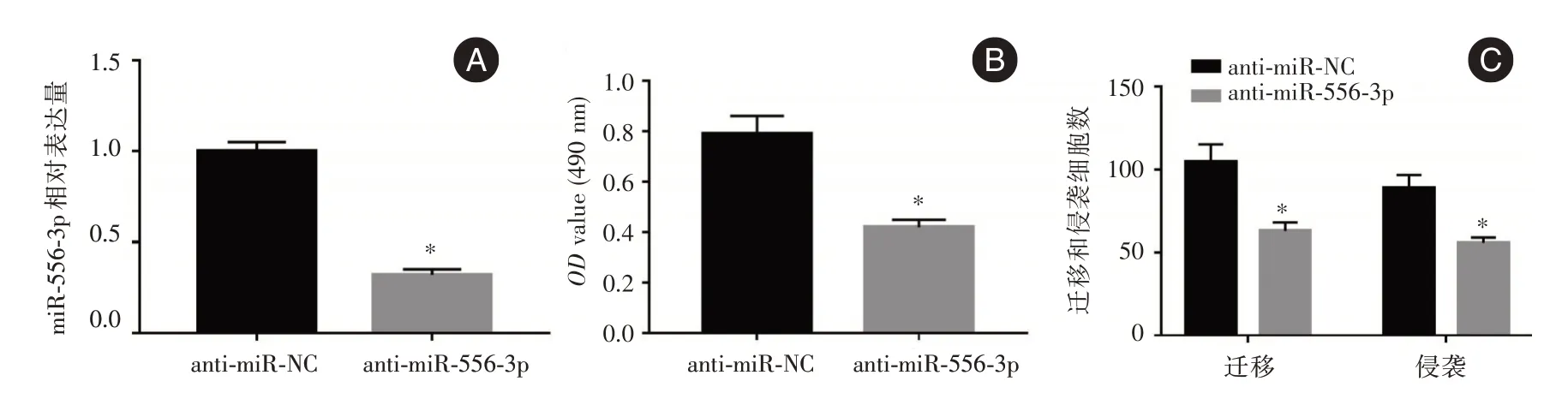
图4 敲减miR-556-3p 对MDA-MB-231 细胞增殖、迁移和侵袭的影响Fig.4 The effect of knocking down miR-556-3p on the proliferation,migration and invasion of MDA-MB-231 cells
2.6 过表达miR-556-3p 逆转过表达circPTPRA对乳腺癌MDA-MB-231 细胞增殖、迁移和侵袭的影响pcDNA-circPTPRA+miR-556-3p 组MDA-MB-231 细胞中miR-556-3p 表达、细胞OD值、迁移和侵袭数均高于pcDNA-circPTPRA+miR-NC 组(P<0.05),说明过表达miR-556-3p 逆转了过表达circPTPRA 对MDA-MB-231 细胞增殖、迁移和侵袭的抑制作用。见图5。

图5 过表达miR-556-3p 逆转过表达circPTPRA 对MDA-MB-231 细胞增殖、迁移和侵袭的影响Fig.5 Overexpression of miR-556-3p reversed the effect of overexpression of circPTPRA on the proliferation,migration and invasion of MDA-MB-231 cells
3 讨论
circRNA 呈闭合环状结构,结构稳定,且高度保守。近年来,随着高通量测序技术的发展,发现肺癌、胃癌、结肠癌等肿瘤中存在大量异常表达的circRNA,这些circRNA 参与调控肿瘤细胞恶性表型,为肿瘤治疗提供了潜在分子靶点[6-8]。研究已表明,多种circRNA 参与乳腺癌的发展进程,其中circAHNAK1、circAMOTL1、circNFIC 和circKDM4C等circRNA 在乳腺癌中表达下调,对乳腺癌发展起抑制作用[9-12];circ_0067934、circRNA-CER、circ-MMP11 和circ_100876 等[13-16]在乳腺癌中表达上调,作为促癌基因促进乳腺癌的发展进程。作为一种circRNA,circPTPRA 在膀胱癌组织中表达降低,且其低表达与肿瘤分期、肿瘤大小及预后密切相关,上调其表达可减弱膀胱癌细胞的增殖能力,可作为膀胱癌的预后生物标志物和治疗靶标[17]。本研究显示,乳腺癌组织中circPTPRA 的表达明显低于癌旁组织,提示circPTPRA 可能在乳腺癌中也发挥抑癌基因作用;过表达circPTPRA 抑制了乳腺癌细胞的增殖、迁移和侵袭能力,提示circPTPRA也可作为乳腺癌治疗的分子靶点。
circRNA 可发挥miRNA 分子海绵作用调控miRNA靶基因表达,进而发挥生物学调控作用[18-20]。为了探究circPTPRA 影响乳腺癌发生发展的调控机制,本研究证实了circPTPRA 可靶向结合并负调控miR-556-3p,这与本文结果中乳腺癌组织中circPTPRA 表达降低而miR-556-3p 表达升高的结果一致。研究显示,miR-556-3p 在食管癌组织中呈高表达,且其高表达的患者预后较差,过表达miR-556-3p 阻碍食管癌细胞增殖和侵袭,为食管癌的治疗提供了新的治疗靶标[21];miR-556-3p在肺癌中表达下调,上调miR-556-3p 可延缓肺癌发展进程,并增强肺癌细胞对顺铂的敏感性[22]。这提示miR-556-3p 可能在不同肿瘤中发挥的作用不同。本研究显示,敲减miR-556-3p可有效阻碍乳腺癌细胞增殖、迁移和侵袭,提示miR-556-3p 可能对乳腺癌发展起促进作用,靶向下调其表达可抑制乳腺癌的发展进程;此外,过表达miR-556-3p 降低了过表达circPTPRA 对乳腺癌细胞增殖、迁移和侵袭的抑制作用,进一步提示circPTPRA 通过靶向抑制miR-556-3p来促进乳腺癌细胞的恶性生物学行为。
综上所述,乳腺癌组织中circPTPRA表达降低,而miR-556-3p 表达升高;过表达circPTPRA 可阻碍乳腺癌细胞MDA-MB-231 细胞增殖、迁移和侵袭,其作用机制与靶向结合并负调控miR-556-3p 表达有关,circPTPRA/miR-556-3p 轴可能为乳腺癌的治疗提供了新的靶点。但是,miR-556-3p 下游靶基因及信号通路对乳腺癌发生发展的影响尚需进一步探究,且需要通过裸鼠移植瘤实验在体内验证circPTPRA/miR-556-3p 轴在乳腺癌发生发展中的作用。

