NF-κB/miR-21/PDCD4通路在砷致BRL-3A细胞毒性作用中的研究
邓斌,任庆新,李述刚
(1 石河子大学医学院预防医学系,新疆 石河子 832000;2 首都医科大学公共卫生学院,北京 100069)
砷中毒是世界范围内最严重的生物地球环境化学疾病之一。在急性和慢性砷暴露后,会对人体造成炎症、遗传毒性、致突变和致癌作用等不良健康损害[1],其中砷对肝细胞的损伤是最严重的砷毒性之一,如用100 mg·L-1NaAsO2以自由饮水方式染毒昆明种雌性小鼠12个月后发现,肝细胞结构遭到破坏,炎性细胞浸润,IL-1β、IL-6和TNF-α的mRNA水平明显增加[2]。暴露于砷后可造严重的肝细胞毒性,但砷的毒性和机制并未完全被阐明。
NF-κB(Nuclear transcription factor kappa B)是一种几乎存在于所有细胞类型中的真核转录因子,NF-κB是炎症反应的重要调节分子[3]。二甲基砷酸能够激活大鼠膀胱上皮细胞NF-κB信号通路,增加大鼠膀胱上皮细胞TGFβ表达和尿中IL-1β的表达[4],说明NF-κB在砷的毒性中具有重要作用。近期的研究发现,砷染毒肝L-02细胞后,细胞活性下降并伴随着miR-21 的表达增高[5]。YANG Y Z等研究发现NF-κB可以调控miR-21[6]。此外,miR-21作为一种非编码miRNA可以靶向调节多种基因[7]。PDCD4(Programmed cell death protein 4)是一种抑癌基因,作为miR-21的靶基因,有研究报道PDCD4基因的缺失可使结肠炎小鼠肠道局部TNFα和IL-6表达水平上调,和让小鼠巨噬细胞IL-6分泌増加[8]。NF-κB/miR-21/PDCD4通路是否参与了砷诱导的细胞毒性,目前未见报道。本研究用亚砷酸钠染毒大鼠正常肝细胞BRL-3A,探究砷对肝细胞的毒性及NF-κB/miR-21/PDCD4在其中发挥的作用,以期为砷的毒性研究和防治提供理论参考。
1 材料与方法
1.1 主要试剂及仪器
亚砷酸钠(北京化工厂,批号890314),大鼠正常肝细胞BRL-3A(中科院上海细胞库,订单号:160807),兔二抗(中杉金桥),鼠二抗(中杉金桥),PDCD4(CST),IIKKα(CST),IKKβ(CST),IκB(CST),pIκB(CST),P65(CST),p-P65(Abcam),β-actin(CST),Annexin V-FITC/PI apoptosis kit(联科生物),增强型CCK-8检测试剂盒(上海尚宝生物科技有限公司),IL-6(联科生物),IL-1β(联科生物),活性氧检测试剂盒(Solarbio),LPO(上海将来实业股份有限公司),BAY-117082(Abcam),miR-21 inhibitor/Negative Control(吉玛),Plasmid Transfection Medium(Santa Cruz Biotechnology),Lip2000(Invitrogen),Opti-MEM(GIBCO)。
1.2 细胞培养和砷处理
细胞培养于完全培养基(培养基按照10%的胎牛血清,89%的DMEM,1%的青霉素链霉素配制),置于37 ℃恒温和5%CO2的无菌培养箱中培养。根据本课题组前期MTT和CCK-8的实验结果,用0、5、10、20 μmol·L-1的亚砷酸钠(亚砷酸钠用完全培养基配制)处理24、48、72 h后进行后续相应实验。
1.3 细胞活性检测
根据CCK-8试剂盒说明书和参考相关文献[9]进行操作,测定不同药物浓度和各个时间点BRL-3A细胞的活性。
1.4 ROS的测定
根据活性氧检测试剂盒说明书参考相关文献[10]进行操作进行操作。最后用荧光显微镜观察每组细胞ROS产生情况并拍照。
1.5 LPO、IL-1β和IL-6的测定
采用ELISA试剂盒(双抗体夹心酶联免疫吸附检测),根据LPO、IL-1β和IL-6试剂盒说明书和参照相关文献[11]进行操作,最后根据标准品拟合标准曲线计算出各样品组的LPO、IL-1β和IL-6浓度。
1.6 RT-qPCR
细胞砷处理后,用Trizol法进行RNA的提取,然后用茎环法进行逆转录(逆转录体系:RNA(2μg)、Oligo(dT)、dNTP、5×Hiscript Buffer、Hiscript Reverse Transcriptase、Ribonuclease Inhibitor、miR-21(U6)primer、H2O(Rnase free),总体积至20 μL,反应条件:42 ℃-60 min,70 ℃-5 min,4 ℃保存),逆转录后进行PCR荧光定量,PCR反应体系:2 μL的cDNA、1 μL的primer、10 μL的SYBR Green Master Mix、0.5 μL的50×ROX Reference Dye 2,加H2O(Rnase free)至20 μL,PCR反应条件:95 ℃、5 min,(95 ℃、10 s;60 ℃、30 s,40 cycles),95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。最终数据以2-ΔΔCt法进行分析。miR-21的引物序列如下:Rat-miR-21-5p的正义链5′-ACGTTGTGTAGCTTATCAGACTG-3′,反义链5′-AATGGTTGTTCTCCACACTCTC-3′;U6的正义链 primer5′-CAGCACATATACTAAAATTGGAACG-3′,正义链5′-ACGAATTTGCGTGTCATCC-3′。
1.7 Western blot检测蛋白表达
在六孔板中用砷处理细胞24 h后,提取蛋白定量配平煮沸后放于-80 ℃保存备用。制备浓缩胶和10%的分离胶,向制胶板上样孔加入适量蛋白样品后于80 V恒压电泳150 min,电泳结束取出凝胶按照“三明治”法用湿转法转膜,转膜结束后用脱脂奶粉或BSA进行封闭,然后一抗孵育过夜后洗膜后二抗孵育两小时后洗膜进行曝光,最后用Image J定量蛋白灰度值后进行统计学分析。
1.8 转染
转染根据miR-21 inhibitor的说明书和相关文献[12]进行操作,miR-21 inhibitor和miR-21 Negative Control 转染4 h后用10 μmol·L-1的砷继续处理24 h后进行后续实验,miR-21 inhibitor的序列为5′-UCAACAUCAGUCUGAUAAGCUA-3′,miR-21 Negative Control的序列为5′-CAGUACUUUUGUGUAGUACAA-3′。
1.9 统计方法
2 结果
2.1 砷对BRL-3A细胞的毒性
2.1.1 砷对BRL-3A细胞活性的影响
用0、5、10、20 μmol·L-1的砷处理BRL-3A细胞24、48、72 h后。
结果显示,相比于空白对照组,5、10、20 μmol·L-1砷组细胞活性逐渐降低(P均<0.05),呈现出剂量-效应关系,且砷处理48 h和72 h后细胞活性也呈现出和24 h时的类似趋势(表1)。
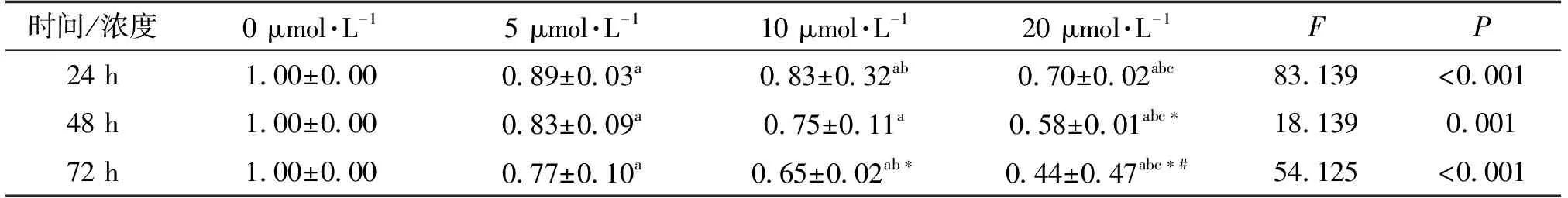
表1 不同浓度砷干预BRL-3A不同时间后细胞活性变化 n=3
2.1.2 砷对BRL-3A细胞氧化损伤的影响
用0、5、10、20 μmol·L-1的砷干预BRL-3A细胞24 h后,结果发现,相比于空白对照组(图1A),砷处理24 h后随着砷浓度的升高(图1B、C、D),细胞内绿色荧光逐渐增多,显示砷可明显诱导ROS的表达。
同样,相较于空白对照组,砷可诱导BRL-3A细胞产生脂质过氧化(F=91.608,P<0.001),细胞上清中LPO表达水平随砷浓度的升高而升高(P均<0.05)(图1E)。
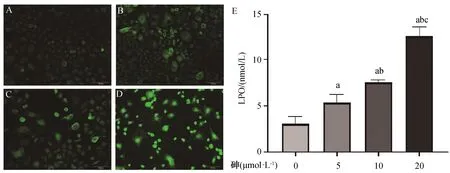
图A、B、C和D分别为0、5、1.和20 μmol·L-1砷组中ROS的变化,图E为LPO的变化。
2.1.3 砷对BRL-3A细胞炎性损伤的影响
用0、5、10、20 μmol·L-1的砷处理BRL-3A细胞24、48、72 h后测细胞上清中IL-1β和IL-6的表达水平。
结果显示,随着砷浓度的增加及时间的延长,砷的干预可使BRL-3A细胞上清中IL-1β和IL-6的表达逐渐增加(P均<0.05),且呈现出一定的剂量和时间-效应关系(表2)。
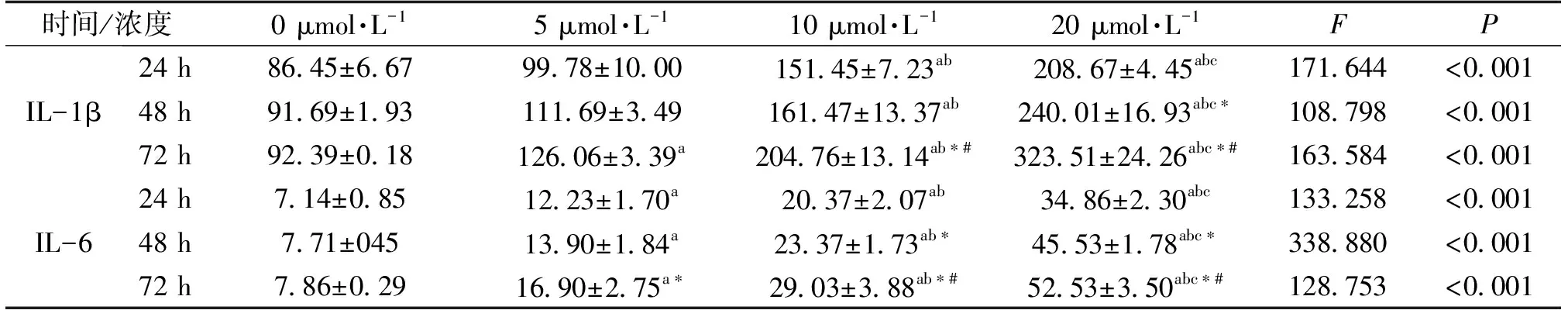
表2 不同浓度砷干预BRL-3A不同时间后细胞上清中IL-1β和IL-6的变化(pg·mL-1) n=3
2.2 砷对BRL-3A细胞中NF-κB/miR-21/pdcd4表达的影响
2.2.1 砷对BRL-3A细胞NF-κB表达的影响
用0、5、10、20 μmol·L-1的砷处理BRL-3A细胞24 h后,检测细胞内NF-κB信号通路的表达水平,结果发现,相比于空白对照组,随着砷浓度的增加可促进IκBα激酶IKKα(F=9.145,P=0.006)和IKKβ(F=51.214,P<0.001)的表达,增加p-IκBα和(F=36.457,P<0.001)p-IκBα/IκBα(F=70.124,P<0.001)的表达,激活NF-κB,上调p-P65(F=42.230,P<0.001)和P65/p-P65(F=37.528,P<0.001)的表达(P均<0.05),而IκBα(F=7.286,P<0.001)和NF-κB P65(F=0.537,P=0.670)的表达则无明显变化(图2)。
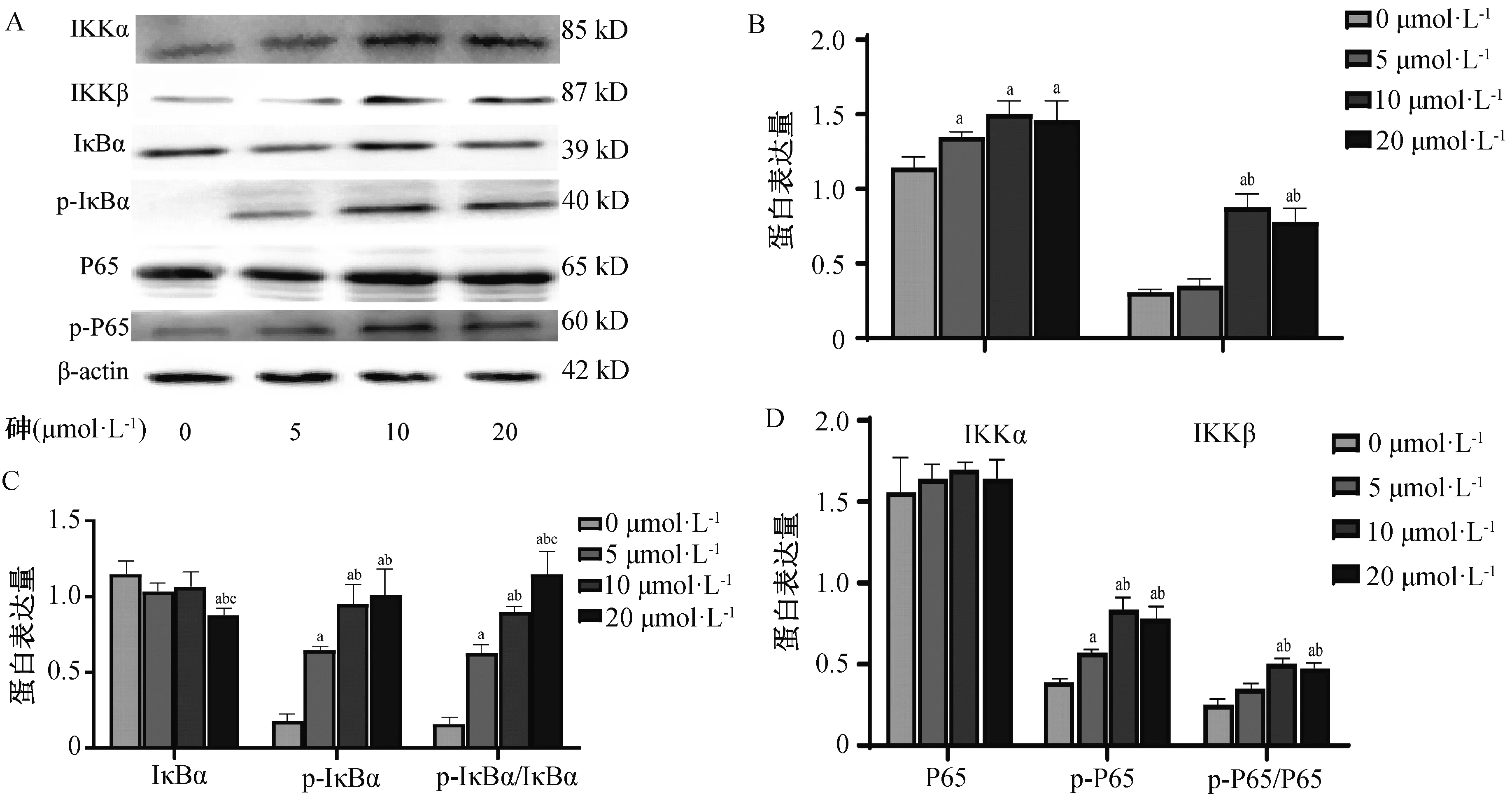
a为与空白对照组比较,P < 0.05,b为与5 μmol·L-1组比较,P < 0.05,c为与10 μmol·L-1组比较,P < 0.05。
2.2.2 砷对BRL-3A细胞miR-21表达的影响
用0、5、10、20 μmol·L-1的砷处理BRL-3A细胞24 h后检测细胞内miR-21的表达水平,结果发现,相较于空白对照组,10和20 μmol·L-1砷可诱导BRL-3A细胞促进miR-21的表达(F=57.830,P<0.001),且miR-21表达水平随砷浓度的升高而升高(P均<0.05)(图3)。
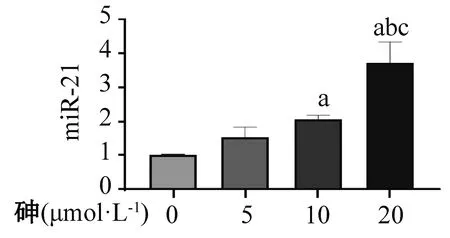
a代表与空白对照组比较,P < 0.05,b代表与5 μmol·L-1组比较,P < 0.05,c代表与10 μmol·L-1组比较,P < 0.05。
2.2.3 砷对BRL-3A细胞PDCD4表达的影响
用0、5、10、20 μmol·L-1的砷处理BRL-3A细胞24小时后检测细胞内PDCD4的表达水平,结果发现,相较于空白对照组,5、10、20 μmol·L-1的砷均可降低BRL-3A细胞PDCD4的表达(P均<0.05)(F=75.498,P<0.001)(图4)。
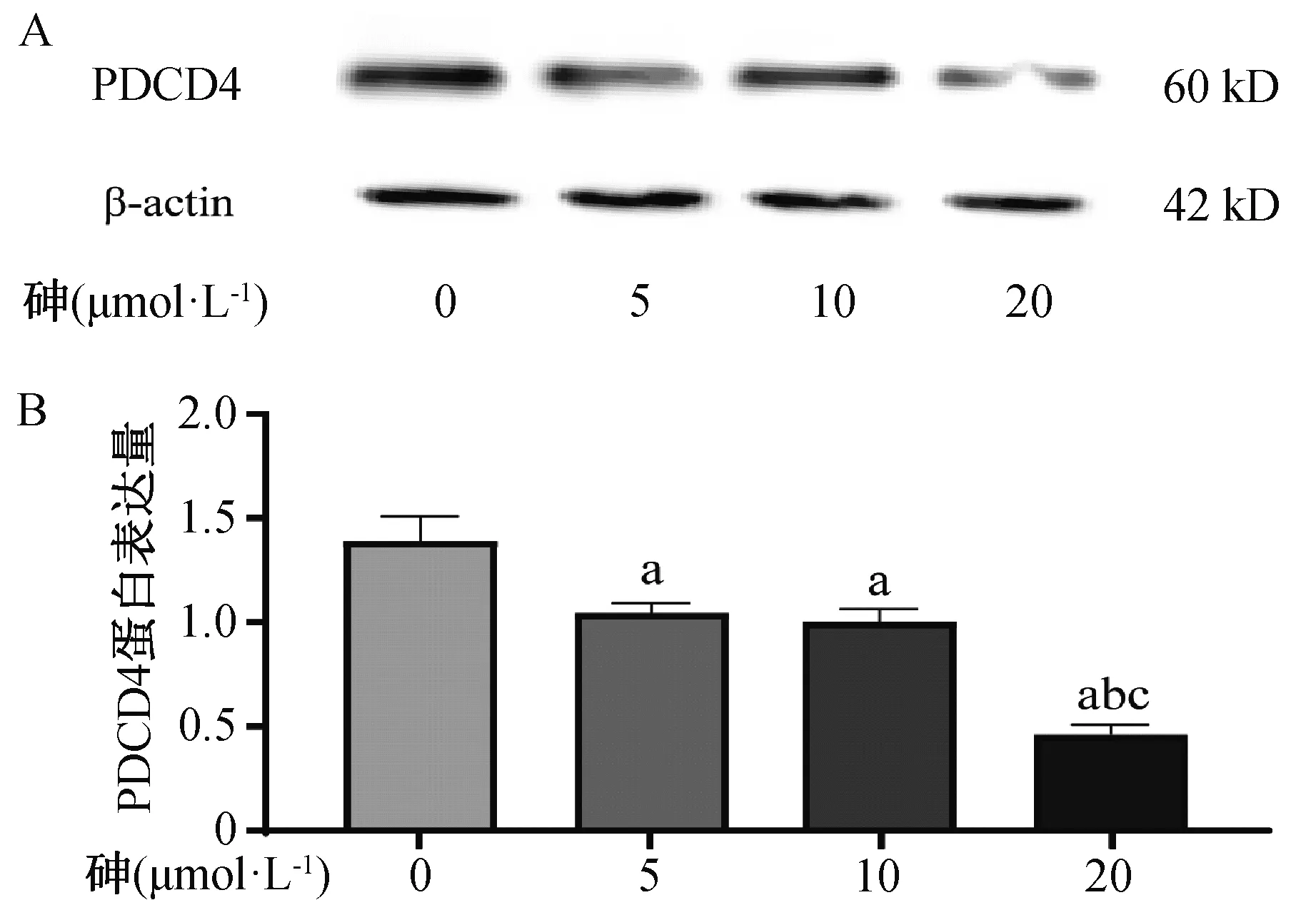
a为与空白对照组比较,P< 0.05,b为与5 μmol·L-1组比较,P < 0.05,c为与10 μmol·L-1组比较,P< 0.05。
2.3 抑制NF-κB后砷对miR-21和PDCD4表达的影响
以上结果发现,砷可促进NF-κB和miR-21的表达,下调PDCD4的表达,为探究其三者间的潜在的相互作用关系,本研究用NF-κB的抑制剂BAY11-7082和10 μmol·L-1的砷处理联合处理BRL-3A细胞24 h后探究NF-κB对miR-21和PDCD4的影响。为确定BAY11-7082的使用剂量,本研究用0、5、10 μmol·L-1的BAY11-7082处理BRL-3A细胞24 h,结果发现相比于空白对照组,5、10 μmol·L-1的BAY11-7082干预后,p-IκBα(F=32.729,P=0.001)和p-P65(F=13.410,P=0.006)表达均有所下降(P均<0.05)(图5A,B)。本研究进一步用10 μmol·L-1的BAY11-7082和10 μmol·L-1的砷处理联合处理BRL-3A细胞24 h后,检测miR-21和PDCD4的表达。结果发现,BAY11-7082和砷联合处理组miR-21的表达高于单独施加BAY11-7082组,低于单独施加砷组(P均<0.05)(F=154.553,P<0.001)(图5C)。而BAY11-7082和砷联合处理组的PDCD4则高于单独施加砷组(P<0.05)(F=5.664,P=0.022)(图5D,E)。
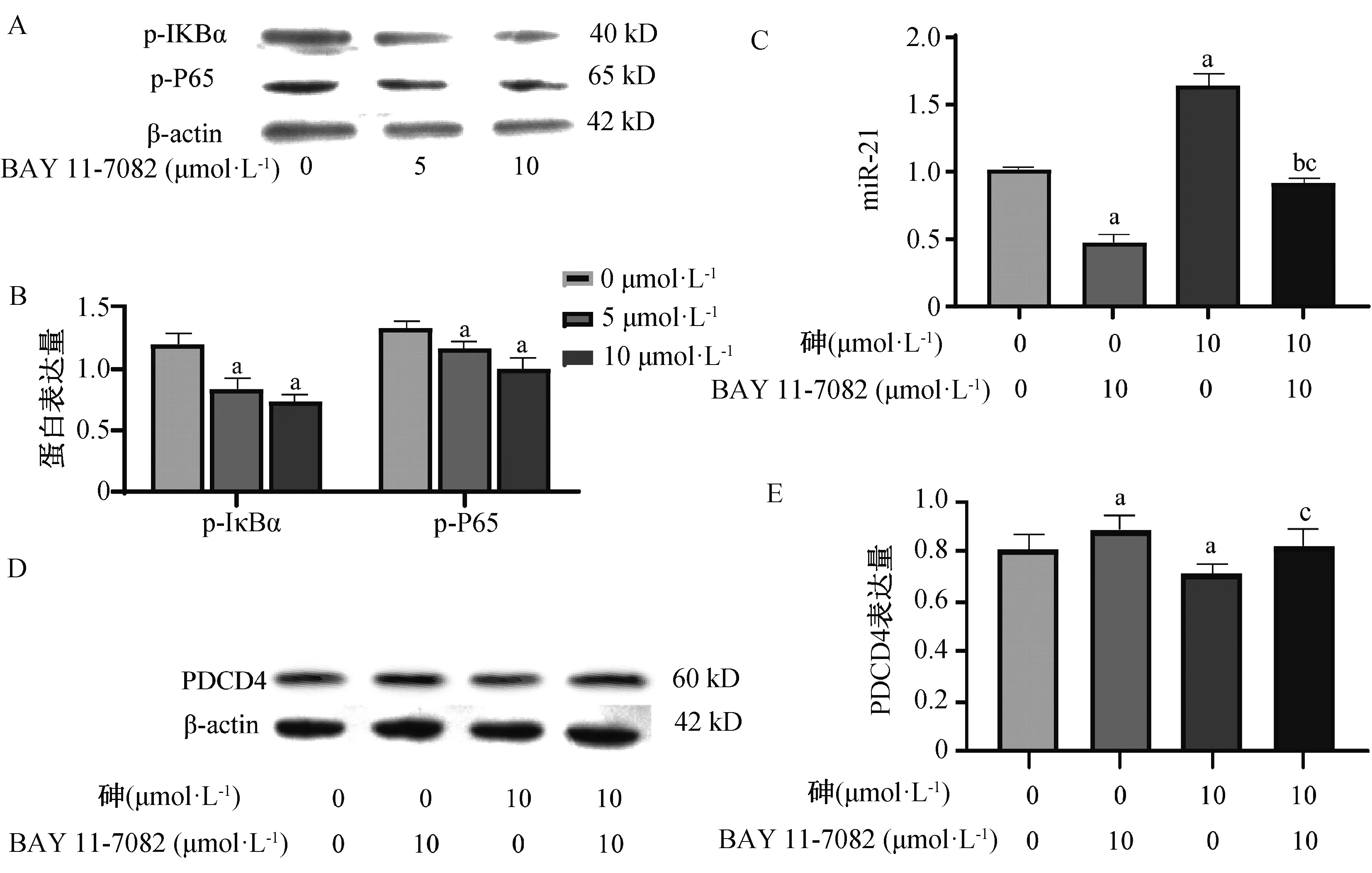
A、B:0、5和10 μmol·L-1的BAY11-7082处理BRL-3A细胞24 h后细胞内p-IκBα和p-P65的变化,C为10 μmol·L-1的BAY11-7082和砷单独或联合处理24 h后miR-21的变化,D、E:10 μmol·L-1的BAY11-7082和砷单独或联合处理24 h后PDCD4的变化蛋白条带图和定量图。
2.4 敲低miR-21后砷对PDCD4表达的影响
在targetscan网站预测miR-21靶分子发现PDCD4是其下游靶基因(图6A),因此本研究用miR-21inhibitor转染并用10 μmol·L-1的砷处理BRL-3A细胞,探究PDCD4是否参与了砷对BRL-3A的细胞毒性。用miR-21inhibitor和miRNAs Negative Control转染细胞4 h后,再用10 μmol·L-1的砷处理BRL-3A细胞24 h,检测细胞内miR-21和PDCD4的表达水平。结果发现,相比于miR-21 inhibitor组,miR-21inhibitor转染联合10 μmol·L-1砷处理组的miR-21表达升高(P<0.05)(F=105.135,P<0.001)(图6B),而miR-21inhibitor转染联合10 μmol·L-1砷处理组的PDCD4表达降低(P<0.05)(F=20.751,P<0.001)(图6C,D)。
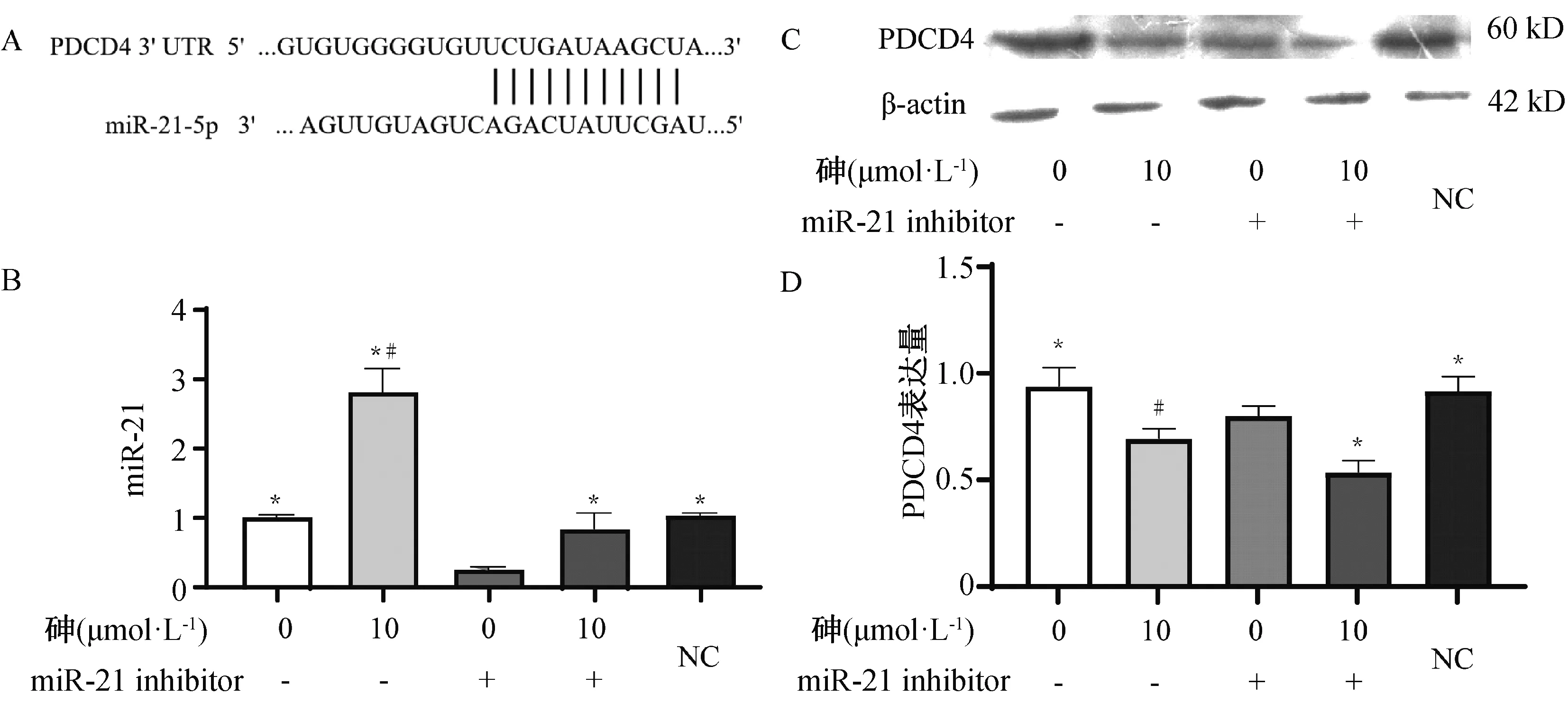
A:在targetscan网站预测的miR-21和PDCD4的碱基配对序列,B:单独用10 μmol·L-1的亚砷酸钠和miR-21inhibitor或联合处理BRL-3A细胞24 h后miR-21的表达情况,C和D:单独用10 μmol·L-1的亚砷酸钠和miR-21inhibitor或联合处理BRL-3A细胞24 h后PDCD4的表达情况,*为与单用miR-21inhibitor组比较,P < 0.05,#为与空白对照组比较,P < 0.05。
3 讨论
据报道,全球有超过一亿人口生活在高砷地区[13],在慢性和急性砷暴露后可导致多器官多系统的损害[14]。肝脏作为人体的主要代谢和解毒器官,在砷暴露后可导致肝脏出现脂肪变性、氧化炎性损伤、坏死,纤维化和凋亡等[15],然而砷的毒性和机制并未完全研究清楚。本研究发现,0、5、10和20 μmol·L-1亚砷酸钠干预BRL-3A 24小时后,相比于空白对照组,砷可降低BRL-3A细胞的活性,导致ROS和LPO增高,促炎性因子IL-1β和IL-6表达增多,且NF-κB信号通路被激活,miR-21表达增加和PDCD4表达下降;用BAY11-7082和砷同时处理以后,相比于单独砷处理组,miR-21的表达水平下降,PDCD4表达增加;用miR-21 inhibitor和砷同时处理以后,相比于单独miR-21 inhibitor处理组,PDCD4表达下调,这些结果提示砷可能通过激活NF-κB上调miR-21抑制PDCD4进而诱导了肝细胞毒性。
NF-κB是一种几乎存在于所有细胞类型中的真核转录因子,在未受刺激的情况下,与细胞中IκB蛋白结合形成复合体,在接收到刺激信号时,IκB激酶IKK可使NF-κB抑制蛋白IκB磷酸化从而使IκB/NF-κB复合体解离,进而导致核转录因子NF-κB进入到细胞核参与转录[16]。NF-κB可被遗传毒物、氧化和炎症应激等激活,激活后可促进多种基因的转录,增加炎性细胞因子、趋化因子和粘附分子的产生直接靶向炎症,而且还可调节细胞的增殖、凋亡、形态发生和分化等[17]。砷处理C57BL/6小鼠和293T细胞后,可以诱导ROS,激活NF-κB和STAT3,进而促进炎性因子IL-1β和IL-6的产生和促进caspase3和bax的表达,诱导细胞凋亡[18]。此外,在砷干预Wister大鼠4个月后可导致大鼠肝脏损伤,同时伴随着TLR4、MYD88和NF-κB的mRNA及蛋白表达水平的增加[19]。而在 YANG Y Z的研究中发现,核梭杆菌可通过上调TLR4和MYD88的表达,激活NFκB通路,促进miR-21的表达,进而促进小鼠大肠癌细胞的增殖和肿瘤的发展[6]。以上结果提示砷还可能通过TLR4/MYD88/NF-κB/miR-21信号通路诱导肝细胞毒性。
miRNAs是一类小的非编码RNA分子,通过翻译阻断靶mRNA或促进mRNA的衰减来下调靶蛋白的表达[20]。来自体内和体外的研究表明,砷暴露可以上调miR-21和miR-190,下调miR-155和miR-119等多种miRNAs分子[21]。miR-21是一种早期在肿瘤中发现的miRNAs,参与了多种细胞的增殖和凋亡过程。亚砷酸钠干预L-O2细胞可引起miR-21高表达诱导肝损伤[22],三氧化二砷处理肝星状细胞时,可上调TGF-β1和smd2/3,进而导致炎性损伤和纤维化[23],而在肾纤维化和炎性反应的过程中发现,TGFβ1可激活smd2/3,随后上调miR-21的表达,进而激活ERK/MAPK[24]。本研究也发现砷可使BRL-3A细胞中miR-21升高,本研究发现用miR-21 inhibitor和砷同时处理以后,相比于单独miR-21 inhibitor处理组,PDCD4表达下调。而LI X C等[25]用双荧光素酶报告实验也证实miR-21靶向调节PDCD4,PDCD4作为miR-21的靶基因,在细胞的炎性过程中也发挥着重要作用,如PDCD4基因的缺失可使结肠炎小鼠肠道局部TNFα和IL-6表达水平上调,使小鼠巨噬细胞IL-6分泌増加[8]。以上研究提示通过调节TGF-β1/samd2/miR-21/PDCD4通路可能是砷诱导肝细胞毒性的重要途径之一。
综上所述,砷可能通过激活NF-κB上调miR-21抑制PDCD4通路进而诱导肝细胞发生氧化炎性损伤和使细胞活性下降。但本研究仅为体外细胞实验,只用了一种肝细胞和单一类型的亚砷酸钠进行实验,故后续还应进行体内实验进一步阐明砷的毒性作用和潜在的分子机制。

