小鼠耳芥CONSTANS-like基因家族的鉴定及响应干旱胁迫表达分析
刘丹青,金玉环,郭力,李永光,黄先忠,2*
(1 石河子大学生命科学学院/特色植物基因组学实验室,新疆 石河子 832003;2 安徽科技学院/农学院,作物生物技术中心,安徽 凤阳 233100)
由于固定生长的特点,植物极度依赖其所在的生存环境,因此环境因素对植物生长发育有着深远的影响[1]。转录因子(transcription factors,TFs)是一类重要的调控子,一般通过结合在胁迫相关基因的顺式作用元件,参与植物对干旱、高盐、低温等非生物胁迫的响应[2]。CONSTANS(CO)和FLOWERINGLOCUST(FT)是拟南芥(Arabidopsisthaliana)光周期途径的重要的转录因子[3]。在长日诱导条件下,AtCO诱导FT在叶片中的表达[4]。CO基因在进化时通过基因复制产生两个及以上的拷贝,形成COL(CONSTANS-like)基因家族[5]。COL基因属于植物BBX转录因子家族,N端有1或2个B-box结构域,主要参与蛋白互作;C末端含有由43个氨基酸组成的CCT(CO,CO-like,TOC1)结构域,主要参与CO蛋白的核定位[6-7]。除了B-box和CCT结构域外,一些COL蛋白的近C末端还包含一个缬氨酸-脯氨酸(VP)基序(-I/V-V-P-S/T-F)[7]。COL基因家族的锌指结构域的核酸多样性显著高于CCT结构域,在进化过程中B-box结构变异较大,而CCT结构域在进化过程中非常保守[8]。
根据B-box的数量和保守性,可以将拟南芥CO基因家族的17个成员划分成3个亚组。亚组Ⅰ包括CO、COL1、COL2、COL3、COL4和COL5基因,这组基因在N端含有2个B-box结构;亚组Ⅱ包括COL6、COL7、COL8和COL16基因,近N端只有1个B-box结构;亚组Ⅲ包括COL9、COL10、COL11、COL12、COL13、COL14和COL15基因,含有1个B-box结构和1个保守性较低的锌指结构域[5]。
COL家族基因通过光周期途径整合昼夜节律以及光信号相关基因来调节开花时间,在调控植物开花过程中发挥重要作用[9]。过表达AtCOL7和AtCOL12调节拟南芥的开花时间[10-11]。OsCOL10、OsCOL13、OsCOL15和OsCOL16对水稻开花有调控作用[12-15]。此外,COL家族基因参与植物生长发育、影响植株的形态发育以及响应多种非生物胁迫。例如,AtCOL3促进侧根发育[16],拟南芥AtCOL4通过ABA依赖途径正向调控植物对非生物胁迫的耐受性[17]。香蕉(MusaacuminataL.)MaCOL1参与了果实的成熟[18]。
近年来,对拟南芥近缘种的研究已成为一个热点,而新疆是拟南芥近缘种的分布中心。小鼠耳芥(Arabidopsispumila)属于十字花科鼠耳芥属早春短命植物,广泛分布于新疆,具有体型小,生长周期短,后代多等特点[19-20]。新疆小鼠耳芥具备光合作用强,繁殖率高,抗逆能力较强等优点,是研究生物与环境相适应机制理想的材料。本研究以小鼠耳芥为对象,完成了ApCOL转录因子家族在全基因组水平上的鉴定以及响应干旱胁迫的表达分析,为进一步探究小鼠耳芥ApCOL蛋白功能及遗传应用提供理论依据。
1 材料与方法
1.1 实验材料及处理
本研究中所用到的小鼠耳芥种子为本实验保存。小鼠耳芥种子灭菌和植株室内的培养方法参照文献[19]中的方法。
首先将小鼠耳芥种子灭菌后播撒在1/2 MS培养基平板上,于4 ℃冰箱春化2~3 d,然后置于22 ℃光照培养箱中培养(16 h光照,8 h黑暗,光照强度200 μmol·m-2·s-1),待长出2~3片真叶后,将幼苗移栽至含有营养土和蛭石(1∶1)的盆钵中,放置于植物生长间培养。PEG胁迫处理:将生长30 d的小鼠耳芥幼苗培养在15% PEG6000的营养液中,分别在0、12、24、48 h取样并立即置于液氮速冻,-80 ℃保存以备提取RNA。
1.2 小鼠耳芥COL基因家族的全基因组鉴定与理化性质分析
从TAIR网站(https://www.arabidopsis.org)下载拟南芥的基因组信息文件(包括DNA序列文件、CDS序列文件、蛋白质序列文件和gff3文件),小鼠耳芥全基因组数据为本实验室提供(数据暂未公开)。从Pfam 33.1数据库(http://pfam.xfam.org/)中下载CCT(PF06203.15)和zinc finger B-box(PF00643.25)的保守结构域模型,利用该模型在HMMER3.0软件中对基因组功能注释的蛋白质序列进行本地化检索,最高e值设为1×10-10。将得到的同源核苷酸序列分别通过Pfam(E-value=0.001)以及SMART数据库(http://smart.embl-heidelberg.de/)检验其是否同时具有CCT和zf-B_box结构域[5,7]。
利用在线网站ExPASy Proteomics Server(http://web.expasy.org/protparam/)对ApCOL氨基酸序列进行分子量、等电点预测。利用Cell-Ploc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对ApCOL蛋白进行亚细胞定位预测。
1.3 小鼠耳芥COL基因结构及染色体定位分析
利用perl程序解析小鼠耳芥基因组数据的gff3文件,选取ApCOL基因的结构信息和染色体位置信息,并利用在线网站MapGene2Chromosome v2(http://mg2c.iask.in/mg2c_v2.1/)和GSDS(http://gsds.cbi.pku.edu.cn/)进行染色体定位分析和基因结构作图。
1.4 系统进化树的构建与蛋白质保守结构域序列比对分析
采用MEGA X软件中的邻接法(neighbor-joining,NJ)构建COL基因家族系统进化树,Bootstrap值设置为1 000次循环[21],构建拟南芥和小鼠耳芥的系统进化树。并将进化树文件导入在线网站iTOL(https://itol.embl.de/)进行调整。根据COL蛋白的结构特性,利用ClustalX1.8(https://www.onlinedown.net/soft/38221.htm)分析拟南芥和小鼠耳芥COL氨基酸序列比对,结合GeneDoc(https://genedoc.software.informer.com/)调整并绘制COL氨基酸序列比对图。
1.5 小鼠耳芥与拟南芥COL基因的共线性分析
使用Perl脚本标记每个COL基因在染色体上的位置,利用TBtools的one step MCScanX获取COL基因家族物种间的共线性关系[22]。使用OrthoVenn2(https://orthovenn2.bioinfotoolkits.net/home)鉴定小鼠耳芥与拟南芥之间的直系同源基因。利用Circos(http://circos.ca/software/)对2个十字花科植物间的共线基因对和直系同源基因对进行作图。
1.6 ApCOL基因启动子区的顺式作用元件分布
检索小鼠耳芥基因组数据库,提取每个ApCOL基因起始密码子上游的2 000 bp区域作为启动子序列信息,通过在线预测软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测ApCOL启动子区的顺式作用元件。并将预测结果整理筛选出顺式作用元件,并利用Gene Structure Display Server(http://gsds.gao-lab.org/)进行可视化分析。
1.7 总RNA提取及cDNA反转录
以小鼠耳芥叶为材料,使用FastPure Plant Total RNA Isolation Kit试剂盒提取小鼠耳芥所取材料的总RNA。使用M-MLV(H-)Reverse transcriptase试剂说明书进行反转录合成cDNA,-20 ℃保存备用。qRT-PCR按照Fast SYBR Mixture试剂盒(康为世纪)操作,反应在Applied Biosystems 7500/7500 Fast Real-time PCRSystem(ABI,Foster City,CA,USA)上进行。此外,本实验均进行3次独立性重复操作。采用Primer 3.0软件(https://bioinfo.ut.ee/primer3-0.4.0/)设计候选基因的qRT-PCR特异性引物(表1),以小鼠耳芥ApGAPDH作为内参基因,采用2-ΔΔCt计算候选基因相对表达量[23]。利用Excel 2019和SPSS软件进行数据处理和差异显著性检验[24],采用GraphPad Prism 8软件对候选基因的定量结果进行柱形图分析[25]。

表1 本研究qRT-PCR引物序列
2 结果与分析
2.1 小鼠耳芥COL家族基因的鉴定及染色体分布
以Pfam数据库中PF06203和PF00643为参照,在小鼠耳芥中鉴定出34个COL基因家族成员,并根据每个ApCOL与拟南芥CO和COL的相似程度为其命名(表2)。ApCOL氨基酸数目在290~435之间,分子量介于31.67~47.96 kDa,理论等电点在4.8~8.3之间。亚细胞定位预测结果显示,34个ApCOL蛋白均位于细胞核内。染色体图谱显示,34个ApCOL不均匀地分布在14条染色体上,每条染色体上有1~4个基因,各染色体的分布比例为2.94~11.76%(图1)。其中Chr1、Chr3、Chr4、Chr6、Chr7和Chr8染色体上均含有3个ApCOL基因,Chr2、Chr9、Chr10、Chr14和Chr15染色体各含有2个ApCOL基因,Chr5和Chr11染色体有1个ApCOL基因,Chr13染色体含有4个ApCOL基因。
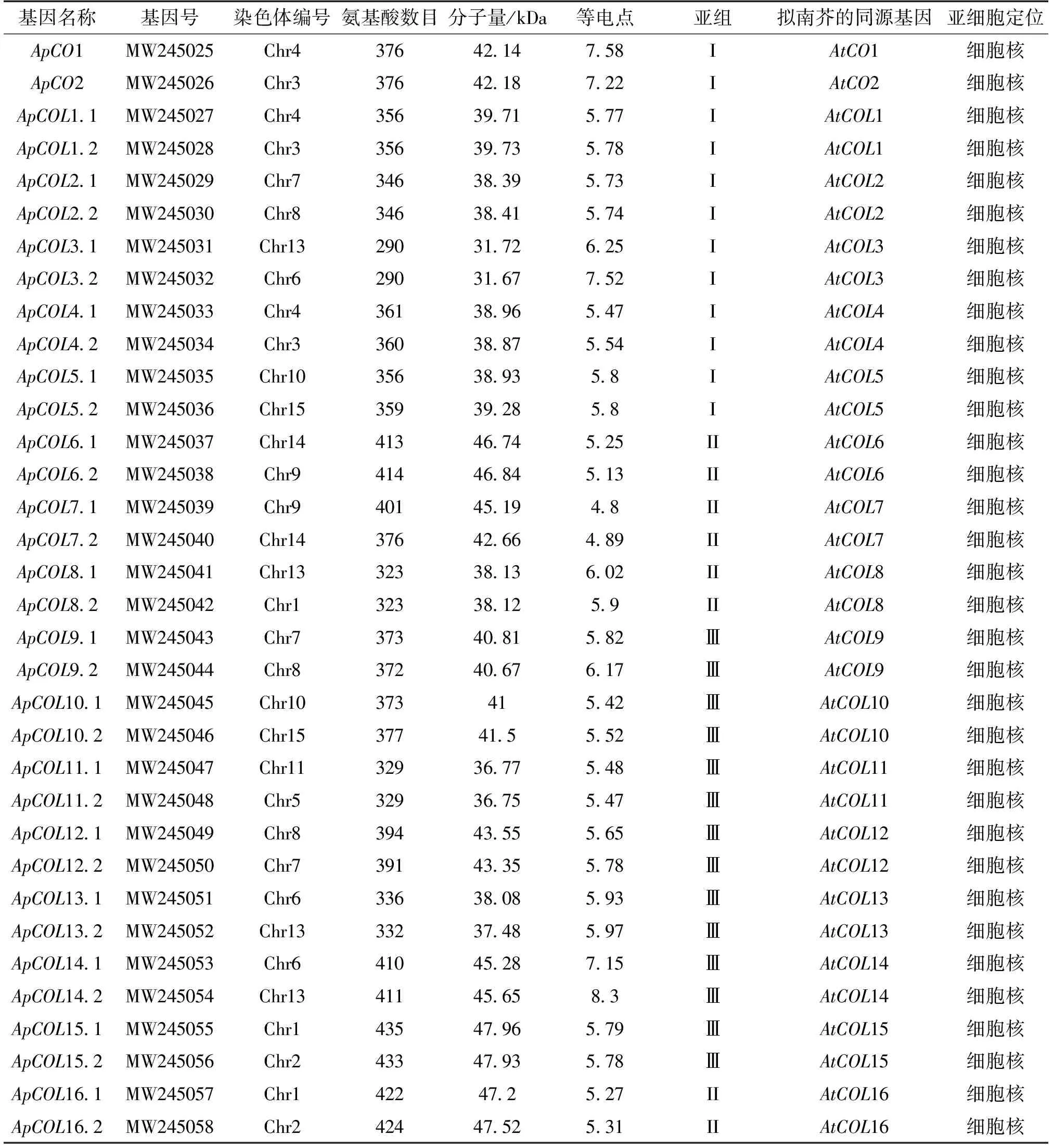
表2 小鼠耳芥COL基因家族简况
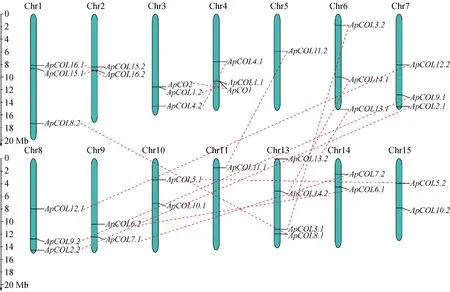
红色虚线连接着ApCOL复制基因对。
2.2 小鼠耳芥COL基因家族分类与进化树构建
为鉴定34个ApCOL和17个AtCOL的系统发育关系,借助MEGA X软件构建系统发育进化树,进化分析结果显示小鼠耳芥和拟南芥的51个COL基因家族可分为3个亚组(Ⅰ~Ⅲ),其中最大的类群是亚组Ⅲ(21个成员),亚组Ⅰ含有18个COL基因,亚组Ⅱ含有12个成员(图2)。小鼠耳芥和拟南芥的系统进化树显示,小鼠耳芥COL基因家族成员在拟南芥中均有分枝,这也说明了两个物种中COL家族基因具有很大的同源性。
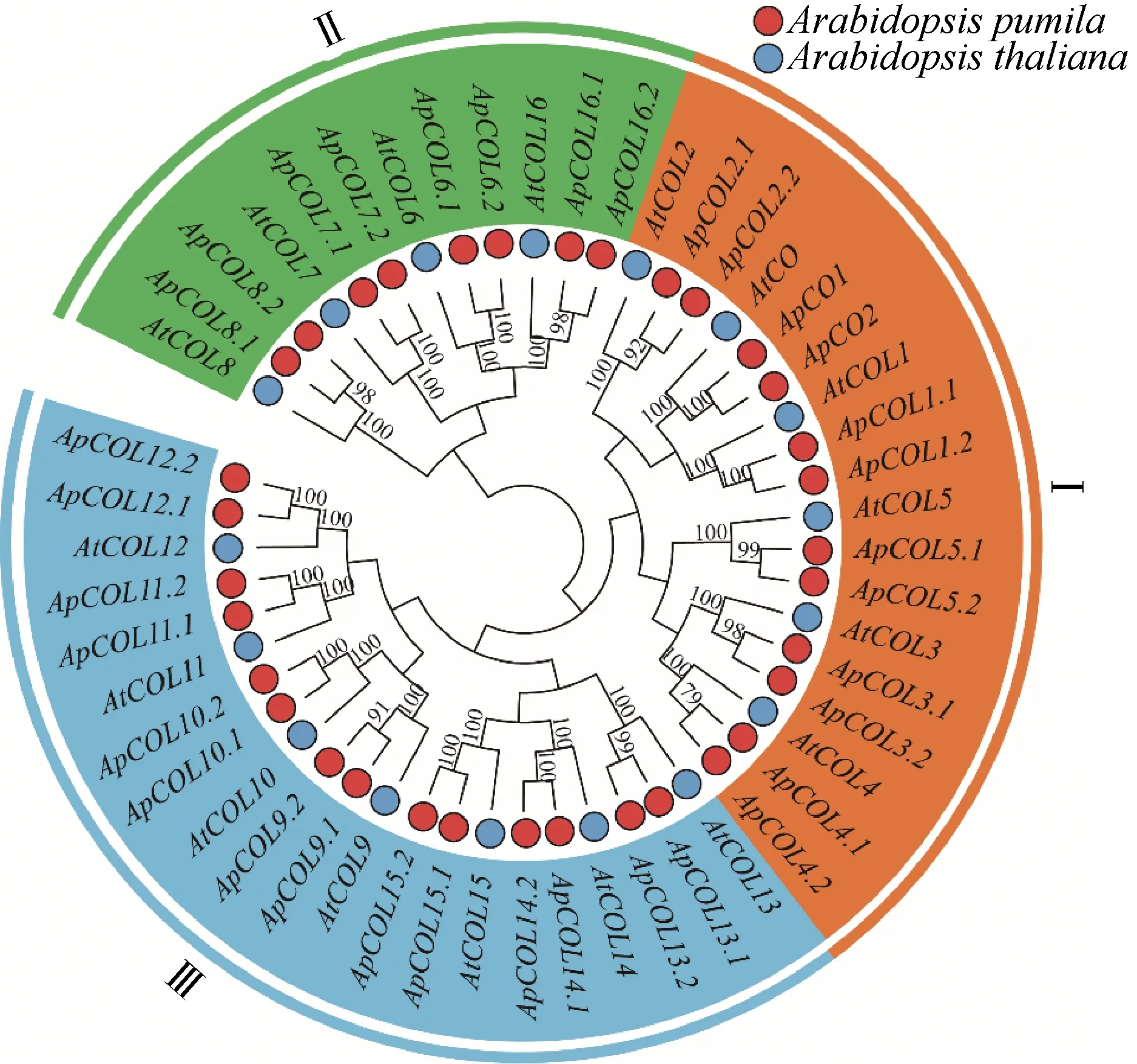
图2 拟南芥和小鼠耳芥COL家族成员构建的系统进化树
2.3 ApCOL家族基因结构、基序及保守结构域分析
为了解ApCOL基因家族的结构,根据其系统发育关系(图3A),利用GSDS构建小鼠耳芥ApCOL家族基因的结构,比较ApCOL外显子和内含子(图3B)。ApCOL基因中存在2~4个外显子和1~3个内含子(图3B)。分析发现,亚组Ⅰ的12个ApCOL基因和亚组Ⅱ的8个ApCOL基因高度保守,均含有2个外显子和1个内含子,亚组Ⅲ中的ApCOL11.1和ApCOL11.2含有3个外显子和2个内含子,而另外12个ApCOL基因含有4个外显子和3个内含子。结构域注释和多个氨基酸序列比对表明(图3C),亚组I的ApCOL包含一个B-box 1、一个B-box 2、一个附加的VP基序和一个CCT结构域。
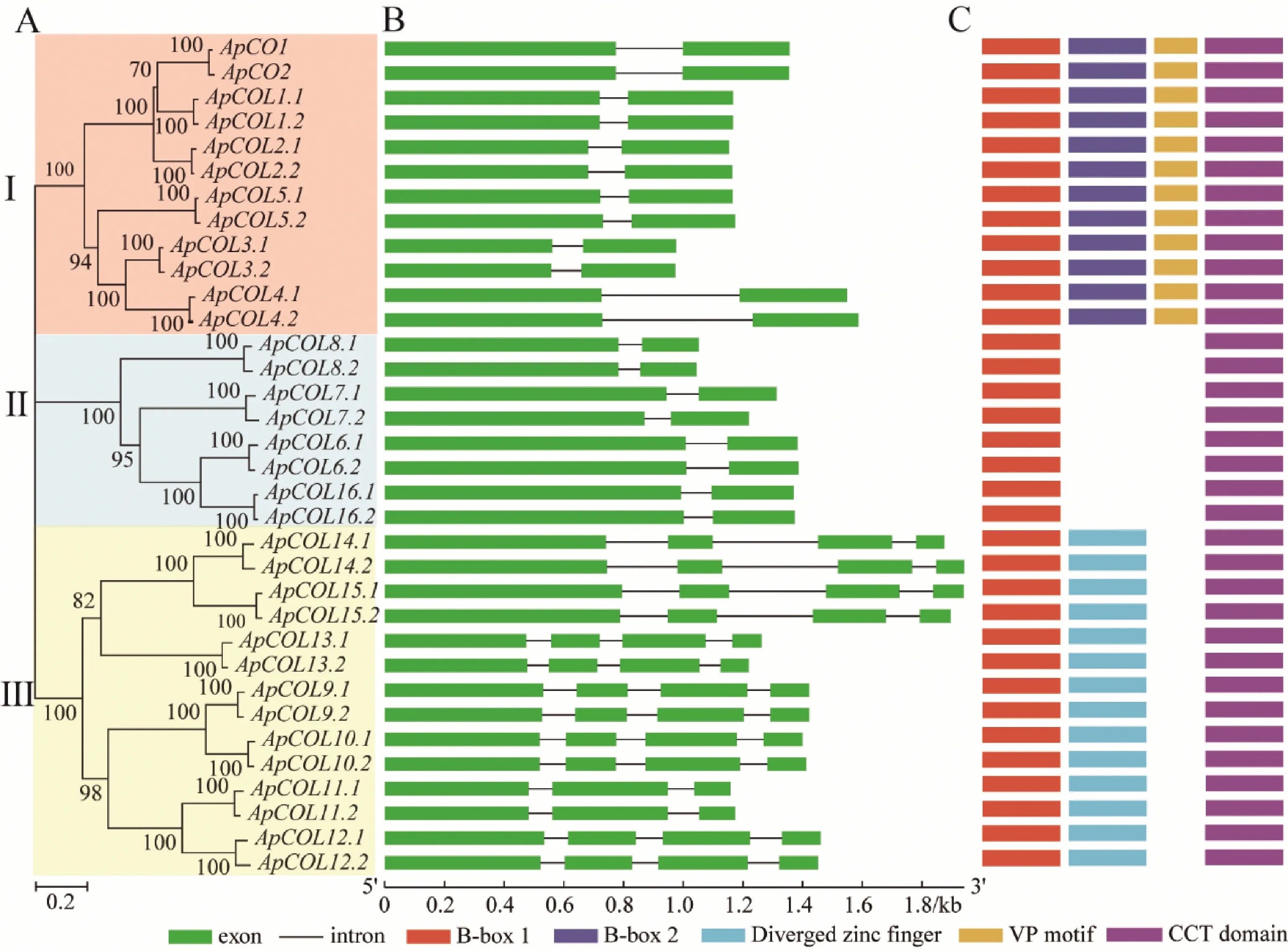
图3 小鼠耳芥COL基因家族的系统发育关系和结构
其中B-box 1结构域位于N端由半胱氨酸组成的保守性较高的锌指结构域;B-box 2的保守性低于B-box 1;VP基序距离CCT结构域约16~20个氨基酸残基;CCT结构域位于C末端由43个氨基酸组成[5]。但ApCOL5.1和ApCOL5.2的B-box 1结构发生了氨基酸序列丢失的现象(图4 A)。
亚组II中的8个ApCOL仅有1个B-box 1结构域和CCT结构域,其中ApCOL7.2的B-box 1结构不完整(图4B)。亚组III组14个ApCOL均含有1个B-box 1结构域、1个保守性较低的锌指结构域和1个CCT结构域(图4C)。

A:亚组Ⅰ,B:亚组Ⅱ,C:亚组Ⅲ。
2.4 小鼠耳芥和拟南芥COL基因成员的共线性分析
物种间共线性区域是不同物种中一些在位置上靠近的基因共同从同一个祖先基因组中进化而来。为进一步研究COL的进化关系,鉴定了2种十字花科植物小鼠耳芥和拟南芥之间的COL基因,在小鼠耳芥和拟南芥之间总共有30对共线性基因(图5),其中22对是小鼠耳芥与拟南芥之间的直系同源基因,说明小鼠耳芥和拟南芥的关系较近。此外,8个ApCOL(ApCO1、ApCOL1.2、ApCOL9.1、ApCOL9.2、ApCOL10.1、ApCOL11.2、ApCOL12.1和ApCOL12.2)与拟南芥AtCOL不存在共线关系。
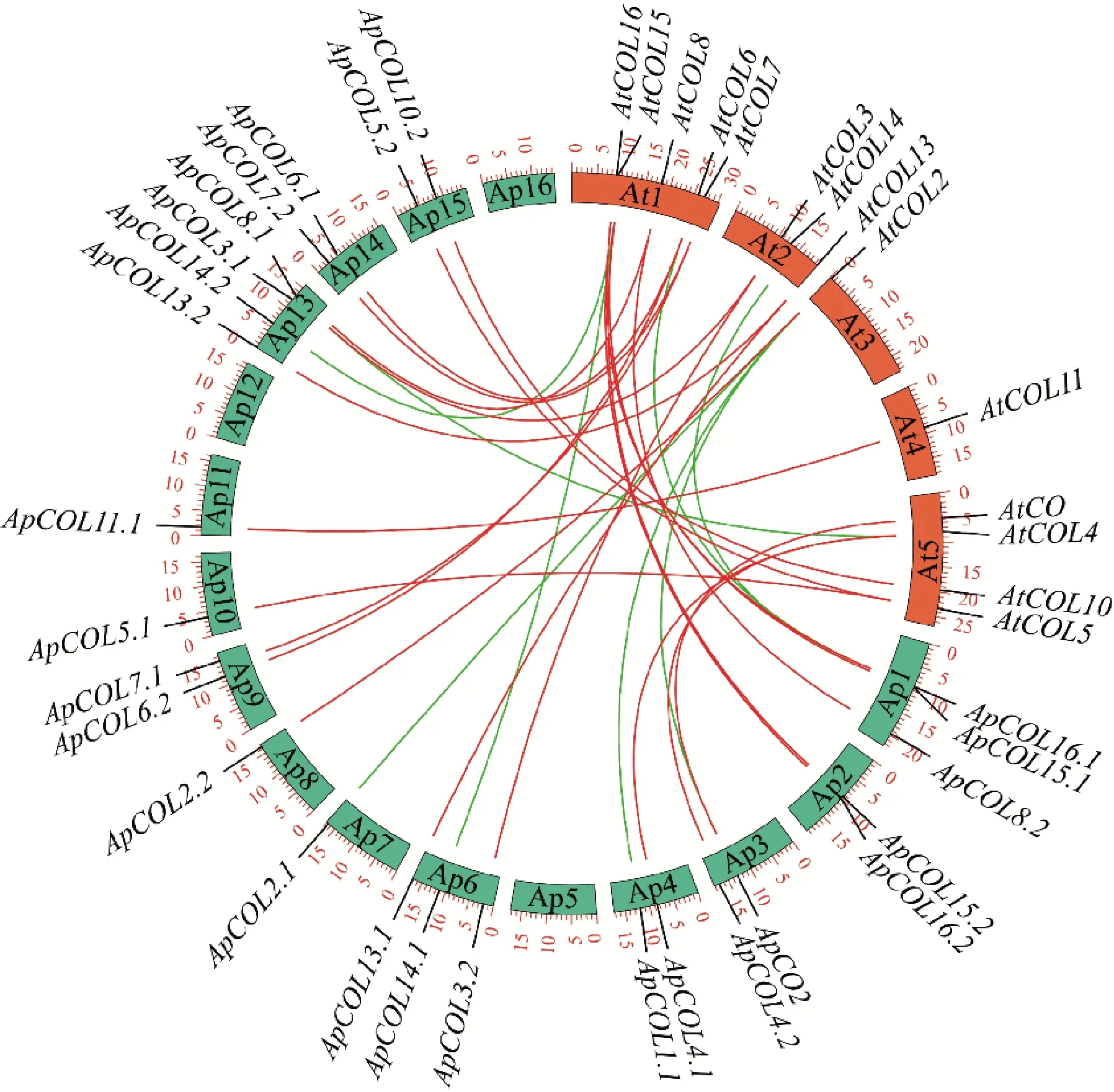
At1-5为拟南芥的染色体编号;Ap1-16为小鼠耳芥的染色体编号;绿线和红线连接拟南芥和小鼠耳芥之间的共线性基因对;红线连接小鼠耳芥和拟南芥之间的直系同源基因对。
2.5 小鼠耳芥中COL基因启动子顺式作用元件分析
为解析小鼠耳芥COL基因家族成员的调控模式,进一步分析了小鼠耳芥的ApCOL基因启动子区域的顺式作用元件分布,采用其转录起始位置上游2 000 bp序列在PlantCARE网站查找各类顺式作用元件(图6)。顺式作用元件分析结果表明,ApCOL基因家族含有较多的光响应、激素应答、胁迫响应和生长调节相关的元件(图6A)。34个小鼠耳芥COL家族基因共含有27种光信号响应元件,例如:G-Box、Box 4、TCT-motif、GT1-motif、GATA-motif、AE-box、ATCT-motif、I-box、circadian、MRE等顺式作用元件。其中ApCOL12.1的光信号元件数量最多,共有27个,而ApCOL4.2仅含有4个光信号元件(图6A),说明ApCOL家族成员的启动子具有光诱导的特性,可能参与光周期调控途径。其次,ApCOL基因启动子区域存在大量激素应答和胁迫响应元件(图6B),例如低温响应元件(LTR)、抗氧化响应元件(ARE)、防御与胁迫响应元件(TC-rich repeats)、生长素响应元件(TGA-element、AuxRR-core、TGA-box和AuxRE)、脱落酸响应元件(ABRE)、赤霉素响应元件(P-box、GARE-motif和TATC-box)、水杨酸响应元件(TCA-element)和茉莉酸甲酯响应元件(CGTCA-motif)(表3)。15个ApCOL基因(ApCO1、ApCO2、ApCOL1.1、ApCOL1.2、ApCOL3.1、ApCOL4.2、ApCOL5.1、ApCOL6.1、ApCOL8.1、ApCOL11.2、ApCOL12.1、ApCOL14.2、ApCOL15.2、ApCOL16.1和ApCOL16.2)共含有20个干旱响应元件(MBS),提示ApCOL基因在干旱胁迫中可能具有重要功能(图6B)。
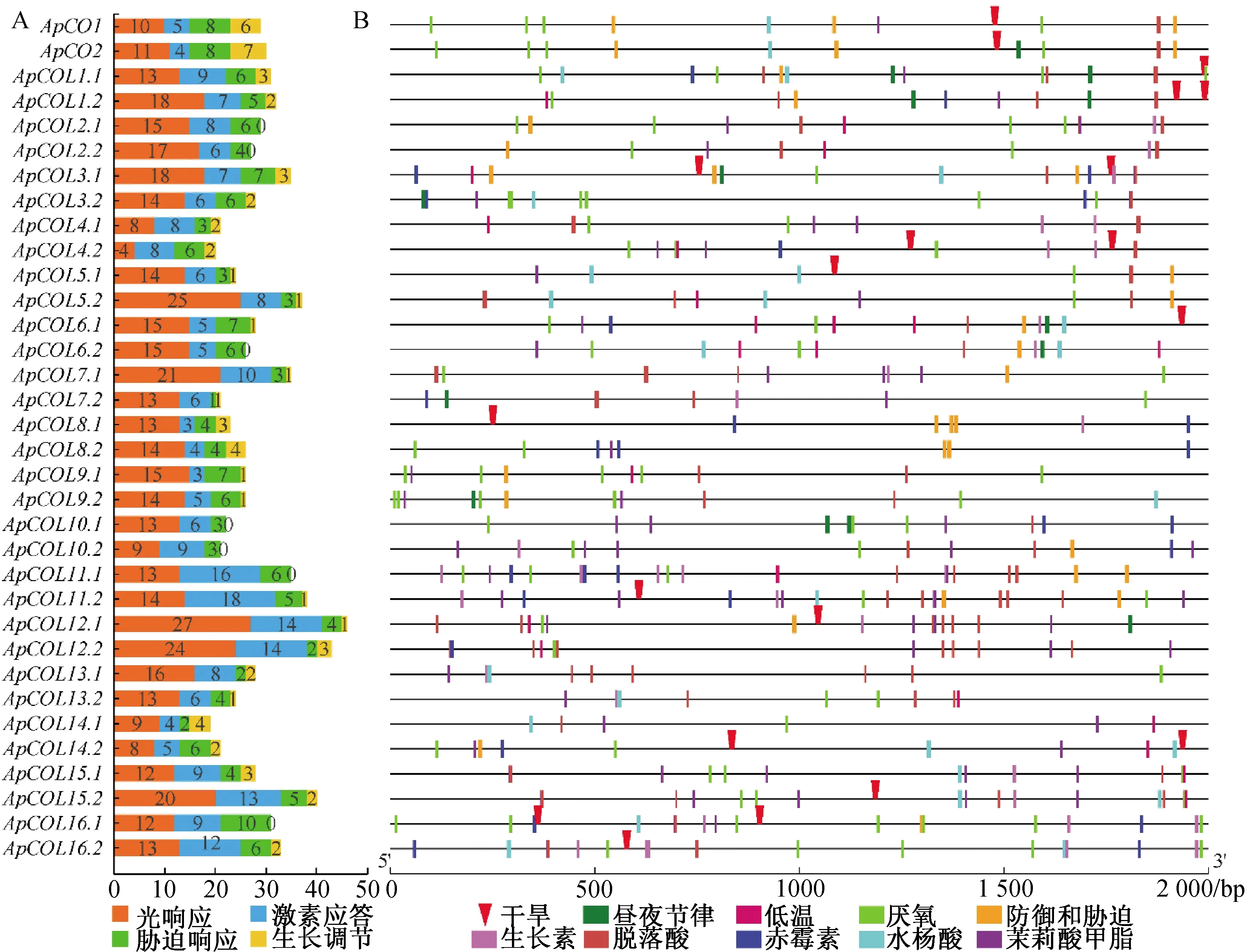
A—统计ApCOL基因顺式作用元件B—激素应答和胁迫响应顺式作用元件的分布图
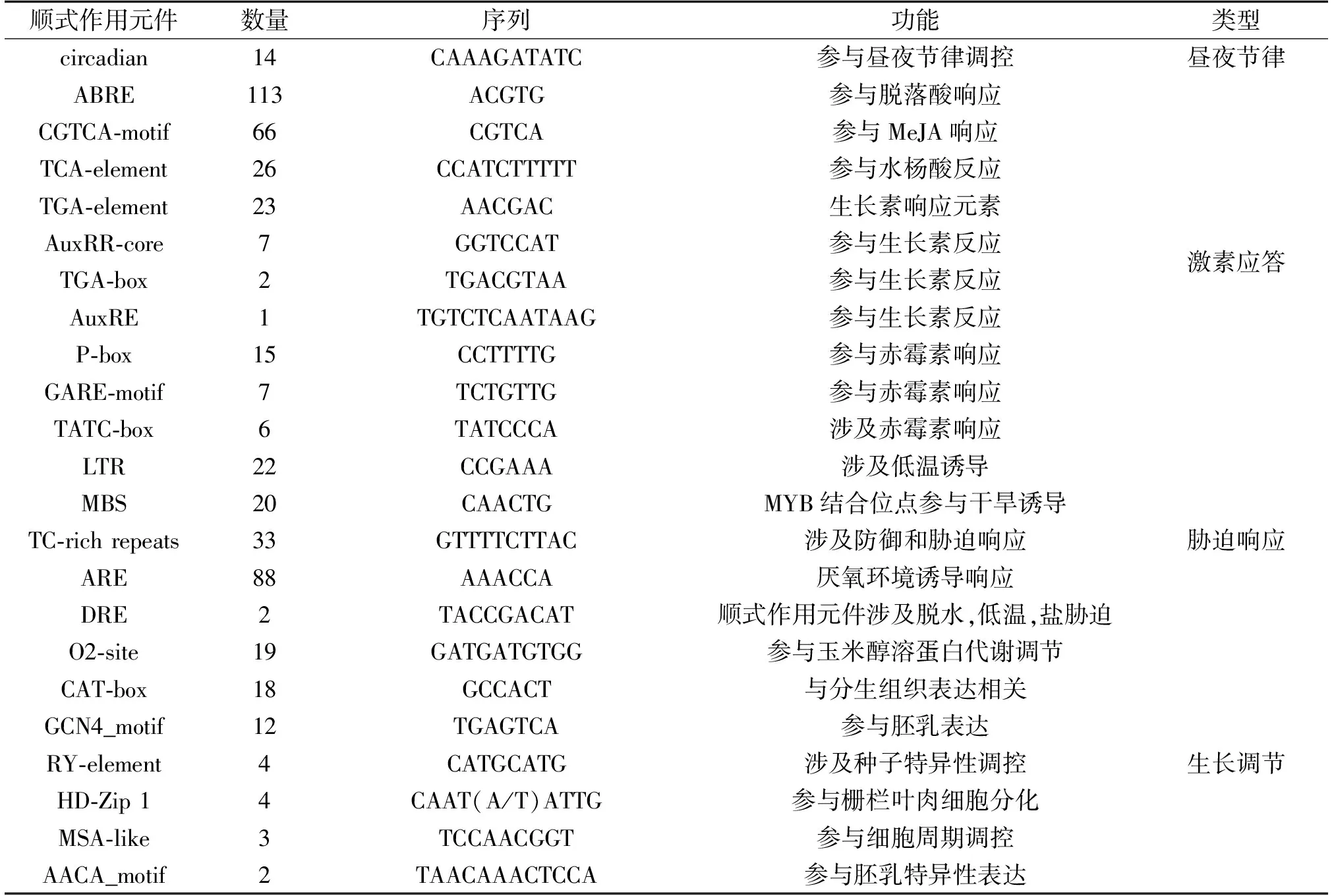
表3 ApCOL启动子顺式作用元件
2.6 ApCOL在干旱胁迫下的表达模式
为了揭示COL家族基因在非生物胁迫下的表达模式,利用15%渗透压PEG溶液(PEG6000)模拟干旱胁迫,本研究对14个ApCOL基因在PEG胁迫下的基因表达进行qRT-PCR验证,结果如图7所示,PEG模拟干旱胁迫促进大多数ApCOL基因发生的差异表达(图7)。ApCO1、ApCO2、ApCOL1.1和ApCO1.2在PEG胁迫下的表达量不同,但是其表达趋势完全一致,ApCO1、ApCO2、ApCOL1.1和ApCO1.2表达量均在PEG胁迫处理48 h后出现峰值,分别为对照的6.39、11.23、7.81和3.98倍。ApCOL2.1在PEG胁迫处理12和24小时后显著上调37.57%和28.42%,48 h较对照显著下调20.88%;ApCOL2.2在PEG处理12和48 h较对照分别显著上调29.75%和56.04%。ApCOL8.1和ApCOL8.2表达量均在PEG胁迫处理24 h后显著下调,较对照分别下调33.43%和45.90%;其中PEG胁迫处理48 h,ApCOL8.2表达量较对照显著上调61.11%,而ApCOL8.1在48 h表达量与对照无显著差异。ApCOL11.1和ApCOL11.2在PEG胁迫处理12和24 h出现下调,而在处理48 h较对照显著上调1751.37%和1491.15%。ApCOL13.1在PEG处理24和48 h出现显著性峰值,较对照分别上调56.30%和207.56%;与ApCOL13.1相比,ApCOL13.2在PEG胁迫下的表达水平均较低,但是其表达趋势与ApCOL13.1相似,ApCOL13.2在处理24和48 h较对照分别显著上调19.25%和12.62%。与对照相比,ApCOL16.1和ApCOL16.2在PEG处理各个时间点均出现显著下调表达,ApCOL16.1分别下调58.42%、36.05%和80.89%,ApCOL16.2分别下调74.81%、53.31%和91.40%。此外,除了ApCOL2.1/2.2和ApCOL13.1/13.2外,其它复制基因对响应PEG胁迫的表达特征相似,由此表明,在PEG模拟干旱胁迫响应过程中,ApCOL复制基因对之间对响应干旱胁迫的模式存在相似性和特异性,进一步说明干旱胁迫调控小鼠耳芥ApCOL家族基因的表达。此外,小鼠耳芥ApCOL响应干旱处理的表达模式分析结果有助于筛选重要候选功能基因,ApCOL基因的干旱响应功能及作用机制有待深入研究探讨。
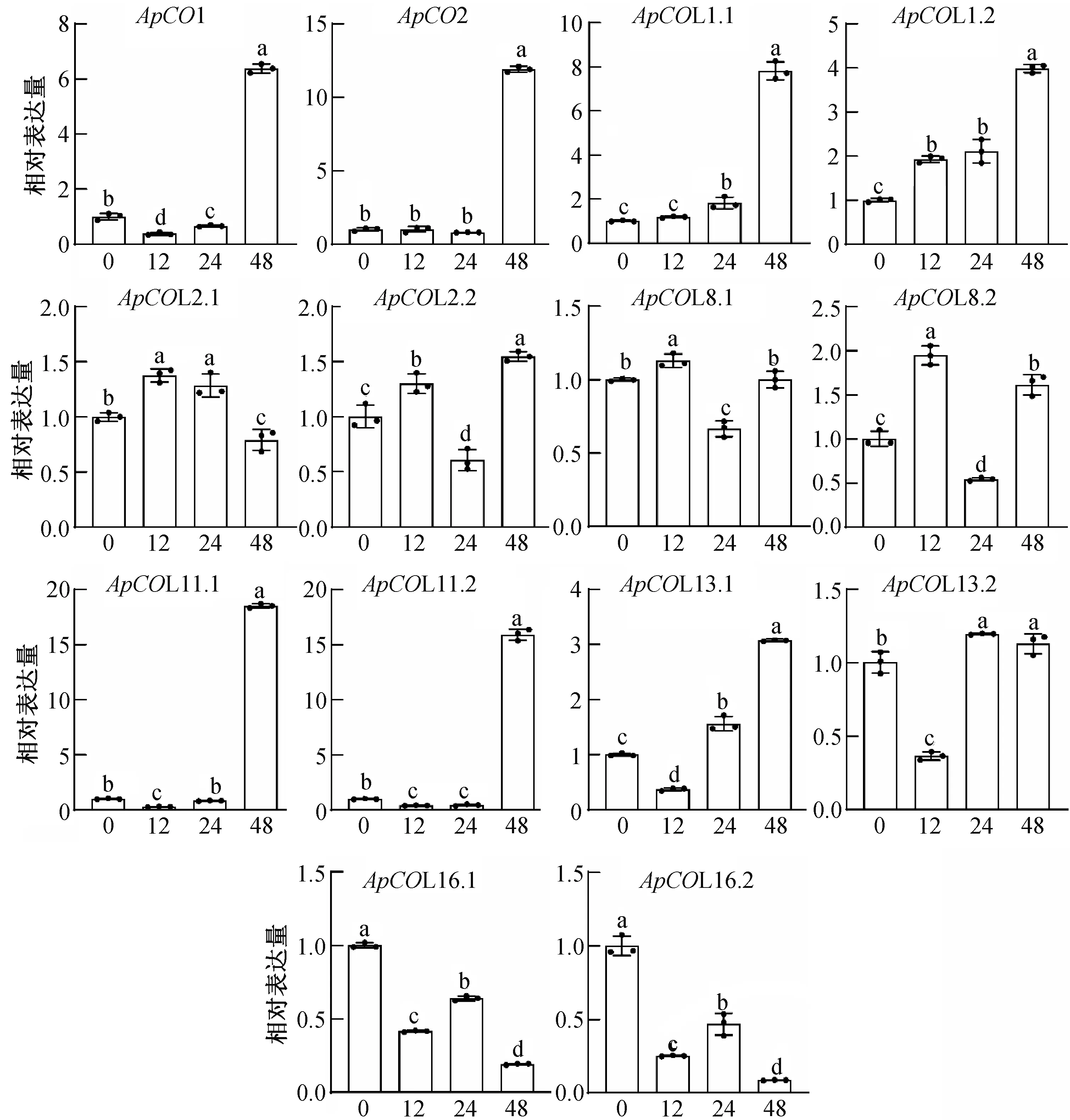
小写字母表示在P<0.05水平有显著性差异。
3 讨论
随着植物基因组研究的深入,转录因子调控植物基因表达的研究为现今植物基因功能研究的热点之一。随着多种物种基因组测序的完成,许多植物的COL基因家族成员及大小已得到分析,其中拟南芥、水稻(Oryzasativa)、葡萄(Vitisvinifera)、白菜(Brassicapekinensis)和陆地棉(Gossypiumhirsutum)中分别含有17、16、12、25、42个COL基因。本研究利用最新组装的小鼠耳芥全基因组数据,通过生物信息学方法鉴定34个小鼠耳芥COL家族基因(12个亚组Ⅰ,8个亚组Ⅱ,14个亚组Ⅲ)。结果显示小鼠耳芥COL家族基因数量远多于拟南芥COL基因的数量。
染色体定位结果显示,34个ApCOL基因不均匀地分布于小鼠耳芥的14条染色体上。内含子和外显子的组成可为基因在进化分析研究中提供重要证据,同一亚组间的外显子-内含子结构和长度相似,说明进化中位于同一亚组ApCOL蛋白质的外显子数目、长度以及内含子相位是相对保守的。这一结果表明这些基因可能具有相同的固定剪接模式,而个别ApCOL蛋白质的内含子-外显子结构发生异化的现象,可能是在进化过程中基因功能发生了分化所导致的。相似性极高的基因结构与序列说明了小鼠耳芥COL基因进化的高度保守性,且不同亚组间的ApCOL基因一定程度上具有结构多样性。说明COL基因家族进化过程中,COL基因结构的多样性保证了一些新功能基因的出现。此外,小鼠耳芥与拟南芥的共线性分析表明,两种十字花科植物间COL直系同源基因间存在着较为复杂的进化关系。顺式作用元件对于基因表达是必不可少的,其数量与基因表达水平呈正相关。启动子顺式作用元件检测发现,ApCOL基因上游存在多种光响应元件,以及参与生长调节、激素调控和逆境胁迫的顺式调控元件,说明ApCOL家族成员可能通过参与不同的信号通路在植物生长发育和应对逆境胁迫中发挥作用。
非生物胁迫的调控机制依赖于大量胁迫相关基因的激活和调控[26]。Ghd2是一种水稻COL基因,Ghd2能促进发育和黑暗诱导的衰老,通过加速干旱诱导的叶片衰老,赋予水稻对干旱的敏感性[27]。通过qRT-PCR分析发现ApCOL16.1和ApCOL16.2表达水平受干旱胁迫处理表达水平明显降低。而12个ApCOL(ApCO1、ApCO2、ApCOL1.1、ApCOL1.2、ApCOL2.1、ApCOL2.2、ApCOL8.1、ApCOL8.2、ApCOL11.1、ApCOL11.2、ApCOL13.1和ApCOL13.2)基因在干旱胁迫处理表达水平显著上升,表明这些基因都是潜在的干旱胁迫相关基因,在非生物胁迫的调控过程中可能扮演重要的角色。研究结果为更深入和全面的解析短命植物小鼠耳芥响应非生物胁迫下的调节机制及适应荒漠环境生存及发育的机制提供了基础。
4 结论
本研究分析了小鼠耳芥基因组中ApCOL基因家族成员的理化性质、基因结构、保守结构域、顺式作用元件、染色体分布以及共线分析,推测了小鼠耳芥ApCOL基因家族成员数量的进化历程。利用qRT-PCR对小鼠耳芥ApCOL家族基因在PEG模拟干旱胁迫处理下的表达模式进行研究,初步分析了ApCOL家族基因的功能,为进一步探究ApCOL蛋白功能及遗传应用提供理论依据。

