MnO2-CeO2复合催化剂制备及室温下催化降解甲醛性能研究*
张 鹏,牛惠翔,李 茹
(西安工程大学 环境科学与工程系,陕西 西安710600)
甲醛被广泛应用于室内装潢材料制造当中,但其具有致癌和致畸性且释放期长[1],是室内污染性气体之一[2]。目前,对室内甲醛降解的方法中,催化氧化法净化效率高、无二次污染,不存在吸附饱和等优点,且对低浓度甲醛污染亦有良好的净化效果,因此,被认定为最有效的室内甲醛去除技术之一,而催化氧化法中催化剂的催化性能直接影响甲醛降解效率。Mn氧化物是一种结构多样的过渡金属氧化物,其原材料廉价易得,资源丰富,且Mn氧化物催化剂对甲醛降解催化效果较好[3,4]。在Sekine[5,6]等人的研究中,用MnO2作为催化剂降解甲醛,在高温条件下转化率最高达91%。Tang X F[7]等人采用沉淀法制备的MnOx-CeO2催化剂在100℃反应温度下甲醛完全催化氧化,但100℃反应温度对于降解室内甲醛,反应条件苛刻。因此,制备出在室温下能快速催化降解甲醛的催化剂对于解决室内甲醛污染问题具有重要意义。
本文以Ce(NO3)3·6H2O和KMnO4为原料,采用络合法制备MnO2-CeO2复合催化剂,应用于降解室内甲醛。通过正交试验优化催化剂制备参数;通过扫描电镜(SEM),X-射线能谱(EDS),X-射线衍射仪(XRD),N2吸附-脱附分析(BET)和氢气程序升温还原(H2-TPR)分析了催化剂的表面形貌、表面元素、比表面及孔容孔径和催化活性。
1 实验部分
1.1 药品及仪器
KMnO4、无水乙醇,均为分析纯,天津市天力化学试剂有限公司;Ce(NO3)3·6H2O(AR上海山浦化工有限公司);甲醛水溶液(37%国药集团化学试剂有限公司)。
78HW-1型恒温磁力搅拌机(杭州仪表电机有限公司);DKZ-2型恒温水浴震荡箱、DHG-9247A型电热恒温干燥箱,上海精密实验设备有限公司;BSQ-BCH20型甲醛分析仪(上海本衫仪器设备有限公司);TDL-40B型离心机(上海安亭科学仪器厂);KSL-1400X型马弗炉(合肥科晶材料科技有限公司);FlexSEM 1000型扫描电镜(日本日立新科技公司);MiniFlex600型台式X射线衍射仪(日本理学);ASPS2020型比表面积孔径分析仪(美国麦克公司)。
1.2 复合催化剂的制备
取不同摩尔比的Ce(NO3)3·6H2O和KMnO4溶于20mL去离子水中,均匀搅拌溶解30min。溶解后将溶液转移到50mL反应釜中,将反应釜置于烘箱中,进行水热反应,待反应结束冷却至室温,将反应釜中液体倒出,经抽滤,离心(转速为2000r·min-1),80℃烘干,研磨制得前驱体。将前驱体放入坩埚中,经马弗炉以10℃·min-1升温焙烧,制得MnO2-CeO2复合催化剂。
1.3 室温下催化降解甲醛实验
降解甲醛实验装置见图1。

图1 降解甲醛实验装置示意图Fig.1 Schematic diagram of experimental device for degradation of formaldehyde
甲醛盛放在锥形瓶中,将锥形瓶放置于水浴箱中并调节温度,轻微加热加速甲醛挥发。气态甲醛经橡胶软管输送至反应室,反应室为边长0.2m的玻璃正方体,反应室的另一侧有两个气孔,由橡胶软管与甲醛分析仪和气压平衡袋连接。待反应室内甲醛浓度达到1.0mg·m-3后,迅速将均匀装有0.1g催化剂的培养皿放置反应室内并夹紧甲醛进气管,开始在室温下催化降解甲醛,12h后再次测量甲醛浓度。整个实验应保证甲醛初始浓度为1.0mg·m-3,所有接口均涂抹凡士林密封,且在通风橱内完成。12h甲醛降解率计算公式为:

式中F:12h甲醛降解率;C0:甲醛起始浓度;Ce:12h后甲醛浓度。
催化剂的催化稳定性通过连续降解甲醛实验考察,第1次12h降解实验后,得到甲醛催化降解率,打开甲醛进气夹,待反应室内甲醛浓度恢复到1.0mg·cm-3时夹紧进气管,不对催化剂做任何处理,直接开始第2次降解甲醛,降解12h后得到第2次甲醛催化降解率。重复上述实验操作得到第3、4、5次甲醛催化降解率。
1.4 催化剂表征
催化剂的表面形貌由Quanta-450-FEG型(American FEI Company)场发射扫描电子显微镜分析,放大倍数8000倍;催化剂表面元素组成由XMAX50型能谱仪测定;催化剂微观结构由Mini-Flex600型(日本理学公司)XRD分析仪检测,选用Cu靶射线管,管电压为40kV,管电流为40mA,扫描速度为4°·min-1,扫描2θ范围为10°~80°;催化剂比表面积采用SPS2020型(American micromeritics Company)N2吸附比表面积孔径分析仪测试,催化剂样品在测试前,先进行200℃的预处理,时间为2h,预处理后在-196℃下进行分析测量;催化氧化活性由ChemisorbⅡ2920型(American micromeritics Company)化学吸附仪测试,样品测试前经N2预处理,升温速度10°·min-1,最高为700℃。
2 结果与讨论
2.1 催化剂制备参数优化
在催化剂制备过程中对催化活性的影响有4个重要的因素:Mn/Ce摩尔比、水化热温度、焙烧温度和焙烧时间。在单因素实验结果的基础上,并结合相关文献[8-10],各自选定3个水平见表1。

表1 四因素三水平正交试验设计Tab.1 Four factors and three levels selected for orthogonal experiment
设计了A1B1C1D1,A1B2C2D2,A1B3C3D3,A2B1C2D3,A2B2C3D1,A2B3C1D2,A3B1C3D2,A3B2C1D3和A3B3C2D1共9组实验方案,以获取最佳制备参数。
正交实验结果见表2。

表2 正交实验结果Tab.2 Property results for orthogonal experimental
k1,k2和k3分别为各因素各水平下制备的催化剂12h室温下甲醛降解率的平均值,R为同一因素各水平下平均值的极差,R越大表示该因素的水平变动对实验影响越大,反之越小。由表2结果表明,样品2室温下12h甲醛降解率最高,为74.7%,因此,确定催化剂的制备参数为:Mn/Ce摩尔比1∶1,水热反应温度120℃,焙烧温度400℃,焙烧时间4h,各因素的极差关系为:R1B>R1C>R1D>R1A,说明催化剂制备因素对催化剂催化效果的影响程度为:水化热温度>焙烧温度>焙烧时间>Mn/Ce摩尔比。
最后,通过连续降解甲醛实验考察了改性催化剂的稳定性,结果见图2。
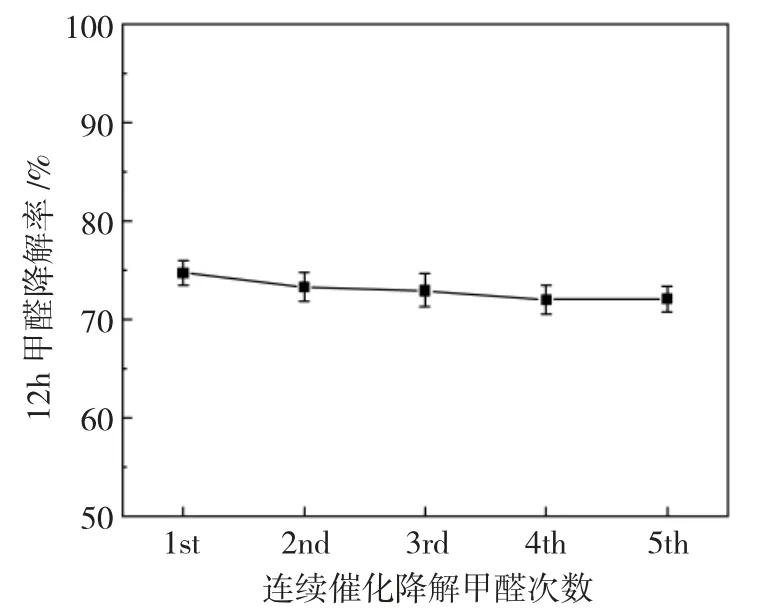
图2 MnO2-CeO2复合催化剂的催化稳定性Fig.2 Catalytic stability of MnO2-CeO2 catalyst
由图2可见,改性后催化剂连续5次降解甲醛,室温下12h甲醛降解率均在72%以上,可见催化剂的催化稳定性较高。在本研究中,MnO2-CeO2复合催化剂在室温下12h甲醛降解率虽达到74.7%且催化性能稳定,但降解时间和降解率仍需进一步提高。后期将尝试对催化剂进行改性,进一步增强等离子体改性效果,期望在室温下能在较短时间实现甲醛完全催化降解。
2.2 改性前后催化剂表征分析
催化剂表面形貌见图3。
由图3可见,催化剂表面相对光滑紧实,催化剂表面未形成明显的大孔。而通过N2吸附-脱附分析所得催化剂的平均孔径为6.7nm,比表面积为129.16m2·g-1。这表明,所制备的催化剂是形成以介孔为主的多孔表面,这种结构使催化剂具有更大的比表面积以及规则有序的孔道结构,从而保证催化剂的催化效果。
催化剂XRD分析结果见图4。

图4 MnO2-CeO2复合催化剂XRD图Fig.4 XRD patterns of MnO2-CeO2 catalyst
由图4可见,其中2θ为33.04°,47.48°,56.33°为CeO2单晶衍射峰,37.33°,42.5°为MnO2单晶衍射峰。因此,可确定制备的催化剂为MnO2-CeO2复合催化剂。但2θ为28.54°处衍射峰既可能为CeO2的单晶衍射峰也可能为MnO2的单晶衍射峰,催化剂的主体物相结构难以确定。催化剂表面元素占比分析结果为:O 46.13%,Mn 12.53%,Ce 7.45%。从元素占比上来看,MnO2应为催化剂的主要成分。
催化剂催化活性由H2-TPR测定,结果见图5。

图5 MnO2-CeO2复合催化剂H2-TPR曲线Fig.5 H2-TPR profiles of MnO2-CeO2 catalyst
在256和338℃出现还原峰,254℃处低温还原峰反映MnO2→Mn2O3→Mn3O4转化过程[11],338℃高温还原峰反映CeO2→Ce2O3和Mn3O4→MnO转化过程[12]。可以明显看出,MnO2的低温还原峰面积大于CeO2和Mn3O4的高温还原峰,这进一步表明,催化剂是以MnO2为主体。
3 结论
(1)催化剂的最佳制备参数为:Mn/Ce摩尔比1∶1,水化热温度120℃,焙烧温度400℃,焙烧时间4h,水化热温度为制备最关键影响因素;在室温下12h甲醛催化降解率最高为74.7%。并且连续5次催化降解甲醛,降解率均在72%以上,催化剂稳定性强。
(2)MnO2-CeO2复合催化剂是以MnO2为主体的Mn-Ce-O混合氧化物,其表面形成以介孔为主的多孔表面,具有较大比表面积,在室温下对甲醛具有良好催化降解性能。

