基于思维导图联合定量化预测模型对缺血性脑卒中合并吞咽障碍病人的护理实践
周南香,冯国琴,刘美华,明雨雁,李 浩,吴玉琴,于小敏,钱志慧
脑卒中是一种因脑血管阻塞或破裂引起脑组织损害的脑血液循环障碍性疾病,具有高发病率、高致残率、高致死率的特点,目前中国承担着世界上最大的卒中负担[1]。缺血性脑卒中是指脑动脉局部供血突然减少或完全中断致使脑组织软化坏死,占所有脑卒中病人的75%~85%[2]。缺血性脑卒中会引起病人神经系统功能缺损,其中吞咽障碍是最常见的临床症状和后遗症之一。卒中后吞咽障碍指卒中导致支配吞咽运动的神经、肌肉及口、咽、喉、食管等处病变引起的吞咽运动障碍,临床常表现为饮食障碍或不便、饮水呛咳、进餐时间延长、自主咳嗽等,可导致营养不良、脱水、心理障碍、吸入性肺炎等并发症,甚至出现窒息危及生命,因此如何防控卒中后吞咽障碍一直是临床研究的热点[3-4]。
列线图是一种建立在多因素回归方程基础上,纳入多个危险指标并以直观图形来预测风险的模型,其定量化预测结局事件的临床价值受到越来越多的关注[5]。思维导图是一种应用于记忆、学习的思考辅助工具,可通过中心关键词以辐射的方式将零散的知识点逐级连接,有利于知识点的记忆和理解[6]。目前尚未有思维导图联合列线图预测模型用于临床护理的报道,基于此,本研究拟在单因素和logistic回归多因素分析的基础上建立预测缺血性脑卒中后吞咽障碍的列线图模型,并设计相关思维导图,旨在为改善卒中病人预后提供科学参考。
1 对象与方法
1.1 研究对象 顺序选取2017年6月至2019年6月我院收治的缺血性脑卒中病人作为研究对象。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》[7]中诊断标准,并经颅脑CT、MRI等检查明确为缺血性脑卒中;(2)年龄≥18岁。排除标准:(1)出血性脑卒中者;(2)认知功能障碍和感觉性失语未能配合检查者;(3)严重心、肺、肝、肾功能损害;(4)其他系统性神经疾病导致的吞咽功障碍者;(5)脑卒中发病前已存在饮水呛咳、吞咽困难者;(6)病情极危者。共纳入357例病人,年龄48~82岁。采用留一法将病人分为建模集(n=283)和验证集(n=74)。
1.2 吞咽障碍筛查 于所有病人入院治疗后24 h内进行吞咽功能筛查,首先对病人意识状态、自主咳嗽能力、是否存在流涎、呼吸困难、饮食水呛咳、吞咽延迟、构音障碍等情况进行检查,如有异常判定可能存在吞咽功能障碍,再进一步进行洼田饮水试验,筛查结果为3~5级者为吞咽障碍[8]。
1.3 观察指标 通过医院信息系统收集临床资料,具体纳入信息包括性别、年龄、吸烟、高血压、糖尿病、高血脂、冠心病、发病次数、病变部位(基底节区、侧室旁、脑干、额叶、颞叶、顶叶、枕叶、小脑、丘脑)、美国国立卫生研究院量表(National Institutes of Health stroke scale,NIHSS)评分和格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分。
1.4 统计学方法 采用χ2检验、logistic回归分析、C-index和ROC曲线分析。
2 结果
2.1 缺血性脑卒中后吞咽障碍的单因素分析 357例病人发生卒中后吞咽障碍共58例(16.2%),其中建模集44例,基于此将建模集病人分为吞咽障碍组(n=44)和非吞咽障碍组(n=239),结果显示,2组年龄、高血压、糖尿病、脑干梗死、NIHSS评分、GCS评分差异均有统计学意义(P<0.01)(见表1)。
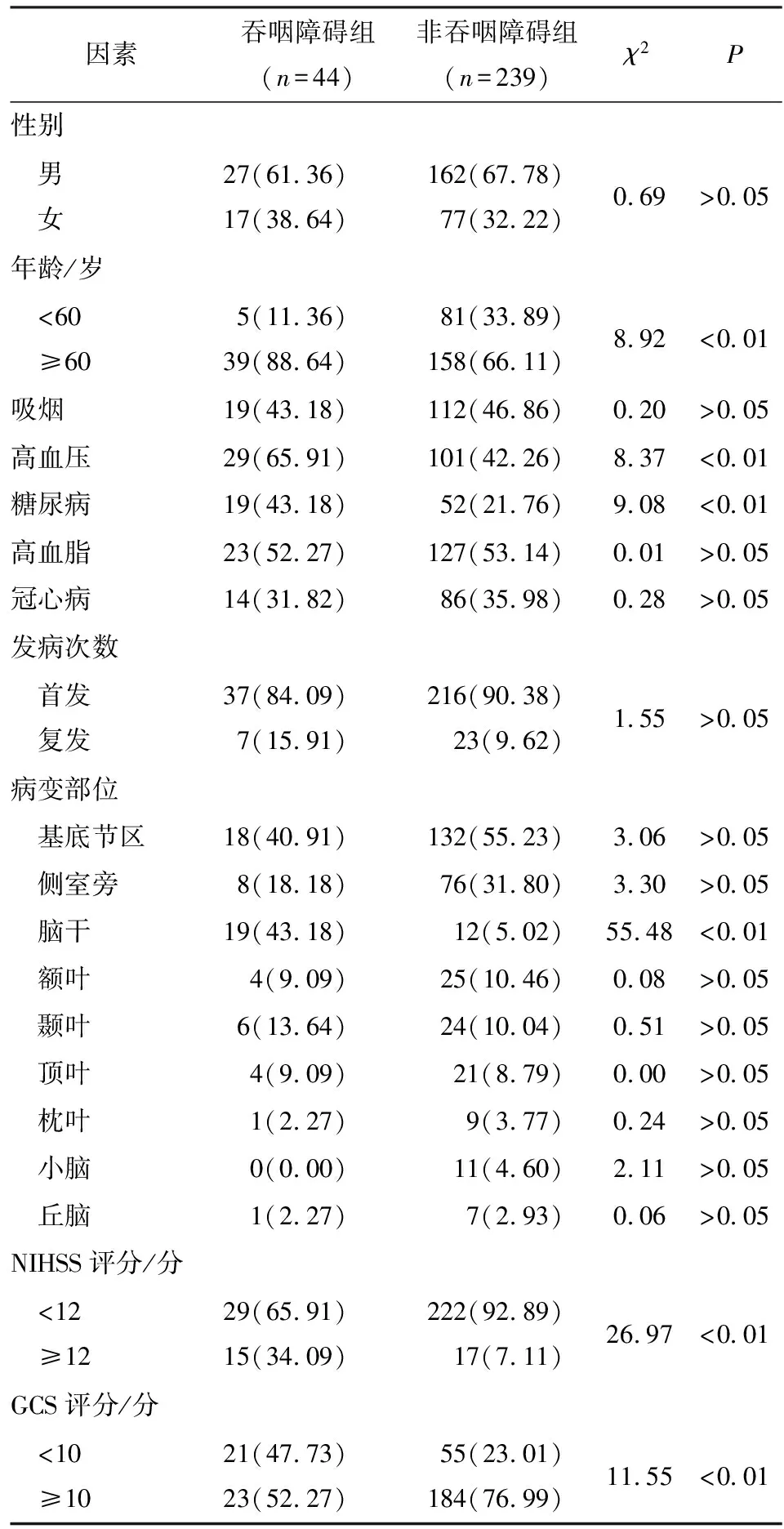
表1 缺血性脑卒中后吞咽障碍的单因素分析[ n;百分率(%)]
2.2 缺血性脑卒中后吞咽障碍的多因素logistic回归分析 以吞咽障碍发生情况为因变量(发生=1,未发生=0),以吞咽障碍组和非吞咽障碍组单因素分析中有统计学意义的6个项目为自变量(年龄:≥60岁=1,<60岁=0;高血压:是=1,否=0;糖尿病:是=1,否=0;脑干梗死:是=1,否=0;NHISS评分:≥12分=1,<12分=0;GCS评分:<10分=1,≥10分=0),进行二分类logistic回归分析,结果显示,年龄≥60岁、高血压、糖尿病、脑干梗死、NIHSS评分≥12分、GCS评分<10分均为缺血性脑卒中后吞咽障碍的独立危险因素(P<0.05~P<0.01)(见表2)。

表2 缺血性脑卒中后吞咽障碍的多因素logistic回归分析
2.3 预测缺血性脑卒中后吞咽障碍的列线图风险模型建立与验证 基于筛选出的独立危险因素,建立预测缺血性脑卒中后吞咽障碍的列线图模型(见图1),通过将建模集原始数据重复抽样1 000次(Bootstrap法)对模型进行内部验证,外部验证通过验证集验证,结果显示,建模集和验证集的C-index指数分别为0.816(95%CI:0.761~0.849)和0.782(95%CI:0.736~0.818),2组校正曲线均与标准曲线拟合较好(见图2),AUC分别为0.882和0.822,证明本次模型具有良好的预测精准度。


2.4 思维导图设计 以缺血性脑卒中后吞咽障碍为中心关键词设计思维导图,通过列线图个体化预测评分,针对危险指标给予相应护理措施,并对病人进行危险分层:低危(总分<160分),相对低危(总分160~<187分),相对高危(总分187~<215分),高危(总分≥215分)(见图3)。
3 讨论
正常吞咽是一种将食物从口腔运送到胃内、同时保护气道的顺序活动过程,脑卒中可引起自主性皮质吞咽控制中心与球核连接的皮质球路径受阻,从而易造成吞咽障碍[9]。AL-KHALED等[10]报道卒中病人出现吞咽障碍的概率约为25%,而在MOURO等[11]报道中甚至高达50%。本次研究中缺血性脑卒中后吞咽障碍的发生率为16.2%,与以上存在偏差,可能是由于样本种族与数量、资料来源、测试方式等存在差异所致,但均提示缺血性脑卒病人是吞咽障碍的高风险人群,掌握诱发吞咽障碍的危险因素对病人的预后至关重要。
本研究采用单因素和多因素回归分析法,筛选出年龄≥60岁、高血压、糖尿病、脑干梗死、NHISS评分≥12分、GCS评分<10分均为缺血性脑卒中后吞咽障碍的独立危险因素(P<0.05~P<0.01)。EHSAAN等[12]报道,年龄与吞咽障碍的发生风险呈正相关关系,与本文结果一致。吞咽是一种需脑部高级神经功能参与的复杂的生理反射过程,随着年龄的递增,高级神经功能减弱,口咽喉等部位发生退行性改变,咽缩肌无力,卒中后易引起吞咽反射功能平衡失调,影响吞咽功能的启动和协调,最终导致吞咽障碍。郝文杰等[13]研究显示,高血压、糖尿病与卒中后吞咽障碍显著相关,与本文一致。分析原因可能是高血压会加速血管硬化,是引起缺血性脑卒中脑损伤的重要危险因素,而口咽部肌群受周围神经支配,糖尿病病人多数存在周围神经病变,导致肌纤维易发生萎缩,对外界刺激反应减弱从而易形成吞咽困难。张国栋等[14]研究显示,脑干梗死病人更易发生吞咽障碍,与本文一致。可能是由于脑干内存在舌咽神经、迷走神经等与吞咽功能密切相关的神经核团和纤维分布,脑干卒中可累及附近控制吞咽的脑干束、核和延髓内的吞咽中心,故易发生吞咽障碍[15]。本研究中还发现吞咽障碍组中NHISS评分≥12分和GCS评分<10分的病人比例显著高于非吞咽障碍组,与国内外文献[16-17]基本一致。NIHSS评分是目前被普遍采纳、可信有效的综合性脑卒中量表,分值与病人神经功能缺损程度呈正相关关系,GSC量表通过对病人睁眼反应、语言反应和肢体活动情况进行评分量化评估意识障碍程度,分值越低代表意识障碍越严重[18-19]。NHISS评分≥12分和GCS评分<10分反映了病人神经功能缺损和意识障碍较为严重,一旦损伤涉及吞咽活动的皮质高级中枢、脑干吞咽中枢和传入传出神经等,极易造成吞咽障碍。

本研究基于筛选出的危险因素建立了预测缺血性脑卒中后吞咽障碍的列线图模型,为保证预测的准确性,避免过度拟合,本文采用多种验证途径针对模型进行了预测效能检验,结果显示建模集和验证集的C-index指数分别为0.816(95%CI:0.761~0.849)和0.782(95%CI:0.736~0.818),校正曲线均与标准曲线拟合较好,AUC分别为0.882和0.822,系统证明了模型具有较高的预测效能。而陈捷等[20]也根据临床诊断的历史数据尝试构建了基于径向基函数神经网络的脑卒中后吞咽障碍智能诊断模型,并通过已有病例样本训练和验证模型证明了模型具有较高诊断分型准确率,但人工智能建模逻辑复杂,使用繁琐,且不具备明确的危险指标和预测能力。相较而言,本文构建的列线图模型可清晰反映各项卒中后吞咽障碍危险因子的影响程度,具有使用方便、直观连续的优势。临床可根据病人在列线图中的各项指标获取相应赋分值,通过函数转换关系得出缺血性脑卒中后吞咽障碍的预测概率,从而完成对病人吞咽情况的个体化、定量化预测。
此外,本研究设计的思维导图,以列线图中的危险指标和预测总分为基础,由中心关键词发散出2级分支,将卒中病人划分为4个危险分层,并针对病人各项指标情况罗列出一系列护理措施。思维导图将复杂的信息转化为高度组织性的图形,可帮助护理人员记忆理解,建立综合分析的思路,有利于对卒中病人并发吞咽障碍的防控和把握护理工作的重点和方向。
综上,年龄≥60岁、高血压、糖尿病、脑干梗死、NHISS评分≥12分、GCS评分<10分均为缺血性脑卒中后吞咽障碍的独立危险因素,基于危险因素建立的列线图模型可有效预测和量化卒中后吞咽障碍的风险,联合思维导图有助于护理人员记忆和理解模型的临床意义,从而进一步改善缺血性脑卒中病人的预后。本次研究的局限性在于:(1)样本量有限,且仅收集单中心病人的临床资料,无法代表其他中心病人的临床特点,数据存在一定程度的偏倚;(2)吞咽功能测试方法单一;(3)危险因素对卒中后吞咽障碍的影响机制尚未完全明确,故本次护理模型尚需纳入更大样本、更敏感的测试方法、更明确的影响因子的研究予以进一步验证。

