香叶木素改善顺铂诱导的鼠肾小管上皮细胞的损伤
陈新亮,陈志宝
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
顺铂是一种有效且有前景的化学治疗药物,可广泛治疗多种肿瘤。然而,使用顺铂的各种重大副作用是不可避免的,例如肾毒性,耳毒性,神经毒性和呕吐,并且顺铂的使用受到限制,其中急性肾损伤(AKI)是造成这类副作用的主要原因[1]。急性肾损伤(AKI)是指由于各种原因引起的肾功能快速下降而引起的临床综合征,表现为肾小球滤过率(GFR)下降,血液中的含氮废物以及水,电解质积累减少和酸碱失衡,尿毒症的严重全身性并发症,细胞凋亡,坏死,炎症和细胞和分子水平的氧化应激[2]。减少顺铂引起的AKI是当前临床上化疗药物亟待解决的问题。
氧化应激是AKI的重要机制之一。在正常情况下,体内氧化剂和抗氧化剂的产生处于平衡状态,当这种平衡被破坏并趋于氧化时,就会发生氧化应激[3]。氧化应激通过直接产生活性氧(ROS)和代谢产物的链反应在AKI中起关键作用[4]。NADPH是一种多亚基复合物,是ROS产生的主要来源之一。所谓的活性氧(ROS),概括地说,是指机体内或者自然环境中由氧组成,含氧并且性质活泼的物质的总称。它们是体内一类氧的单电子还原产物,是电子在未能传递到末端氧化酶之前漏出呼吸链并消耗大约2%的氧生成的。核因子红系2相关因子(Nrf2)是调节细胞氧化应激的重要转录因子,并且是通过诱导一系列抗氧化蛋白的调节来维持细胞内氧化还原稳态的中央调节剂[5]。根据研究,Nrf2是内源性抗氧化酶的关键转录因子,在氧化性和凋亡性损伤的保护作用中起关键作用[6]。在体内施用肾毒性剂量的顺铂导致肾脏中的坏死和细胞凋亡显著增加。有足够的证据表明顺铂激活细胞凋亡的内部线粒体途径[7]。用顺铂处理的肾上皮细胞使Bax易位至线粒体并激活caspase[8]。这些证据表明,氧化应激,细胞凋亡在AKI中发挥了重要的作用。
从中草药植物中提取的化合物是用于治疗和预防各种人类疾病的重要药物。许多研究表明使用天然产品(例如类黄酮)来对抗氧化应激诱导的器官损伤。天然抗氧化剂由于其安全性和天然无害性,是治疗某些困难疾病的良好药物[9]。香叶木素是从柑橘类植物中提取的天然类黄酮,据报道具有各种生物活性,例如抗氧化,抗炎和抗肿瘤[10]。作为良好的抗氧化剂,香叶木素对某些有害的氧化诱导的反应的保护作用已引起广泛关注,尤其是在生物学、医学、营养学和农业化学领域。关于香叶木素的几项体内和体外研究发现,它对肝和肺的损伤具有良好的保护作用[11-12]。研究旨在评估香叶木素对顺铂诱导的肾小管上皮细胞损伤的保护作用。
1 材料与方法
1.1 材料
香叶木素(纯度>99.5%)是从长春京涛生物技术有限公司获得的。3-(4,5-二甲基噻唑-2-y1)-2,5-二苯基四唑溴化物(MTT),二甲基亚砜(DMSO)和DCFH-DA购自Sigma Chemical Co.(美国密苏里州圣路易斯)。Hoechst33342购自invitrogen(美国加利福尼亚州卡尔斯巴德)。10%FBS,100 U×mL-1青霉素,100 U×mL-1链霉素和3 mM谷氨酰胺的DMEM培养基均购自上海碧云天生物技术有限公司。针对Nrf2,Keap-1,HO-1,NQO1的抗体购自Abcam(美国马萨诸塞州剑桥市)。β-肌动蛋白购自SUNGENE BIOTECH(天津,中国)。二抗中包含的兔抗和鼠抗购自Proteintech(美国马萨诸塞州波士顿)。
1.2 细胞培养和MTT分析
从吉林大学购买得到鼠肾小管上皮细胞(mRTEC),在含有10%FBS,100 U×mL-1青霉素,100 U×mL-1链霉素和3 mM谷氨酰胺的DMEM培养基中于37℃,含有5%CO2的培养箱中培养。此外,mRTEC细胞(1.2×104个×孔-1)用香叶木素(10、20和40μM)处理1 h,随后加入顺铂(20μM)培养24 h。处理后,将细胞与MTT(5 mg×mL-1)放入CO2培养箱再孵育4 h。然后,除去上清液,并将形成的蓝色甲瓒溶解在DMSO中。在570 nm处测量光密度,并且将细胞存活率标准化为对照的百分比。
1.3 细胞内ROS测定
将mRTEC接种到96孔板中(1×104个×孔-1)24 h,并在无血清DMEM中培养6 h。接下来,用不同剂量的香叶木素(10、20和40μM)作用24 h,然后向每个孔中加入顺铂(20μM),作用30 min。然后将细胞与50 mM DCFH-DA孵育30 min,分别在485和535 nm的激发和发射波长下评估荧光强度。
1.4 Hoechst33342染色
将mRTEC接种到12孔板中(5×105个×孔-1)24 h,然后在顺铂处理前1h用香叶木素(10、20或40μM)处理。取出培养板,每孔加入2μL的hoechst33342溶液,然后CO2培养箱放置15 min。用PBS洗涤细胞两次,并使用荧光显微镜观察结果。
1.5 蛋白质印迹分析
将mRTEC接种到6孔板中(1×106个×孔-1),并在指定的时间内用不同浓度的香叶木素(10、20和40μM)处理并收集。全细胞裂解液在含有新鲜添加的蛋白酶和磷酸酶抑制剂的裂解缓冲液中制备,处理细胞30 min,随后在条件为4℃,5 min,8 000转的离心机中离心,得到的上清液即为所需蛋白。使用BCA蛋白测定试剂盒(中国,北京)检测蛋白浓度。用10%SDS-聚丙烯酰胺凝胶分离等量的蛋白质,电泳转移到PVDF膜上,并用5%BSA封闭。然后,洗涤膜并用相应的一抗和二抗探测。蛋白条带通过Image Lab得到相应结果。通过使用β-肌动蛋白作为内部对照对蛋白条带的灰色密度进行统一。
1.6 统计分析
上面引用的所有数据均表示为均值±SEM,并使用SPSS19.0(IBM)进行了分析,并进行了P值检验。统计显著性定义为P*<0.05或P**<0.01。
2 结果与分析
2.1 香叶木素对顺铂处理的mRTEC活性的影响
在细胞实验中,为了筛选实验最佳的顺铂浓度,通过MTT检测顺铂在mTEC细胞中的作用,确定最佳的实验剂量。结果表明在顺铂为20μM时,达到半数致死量,我们确定其为建立模型的最佳剂量(图1 A)。在实验过程当中,确保药物本身对实验细胞的毒副作用是否会影响实验是非常重要的一点。为了验证香叶木素的毒性作用,在mTEC细胞中以不同剂量浓度梯度来筛选可能的药物剂量。从结果可以看出在香叶木素的剂量高于80μM后会对细胞的生长有抑制作用,因此我们将选取的药物剂量范围控制在80μM以内(图1 B)。为了筛选顺铂作用之后的mTEC细胞后香叶木素的最佳剂量,以不同剂量的香叶木素作用于加入了顺铂之后的mTEC细胞,筛选最佳的香叶木素治疗剂量。从结果可以看出,顺铂使mTEC细胞的生长受抑制,而加入香叶木素之后,这种抑制作用得到了缓解,并在40μM之前呈现一个剂量依赖的增长。从而我们确定香叶木素的最佳剂量为40μM(图1 C)。
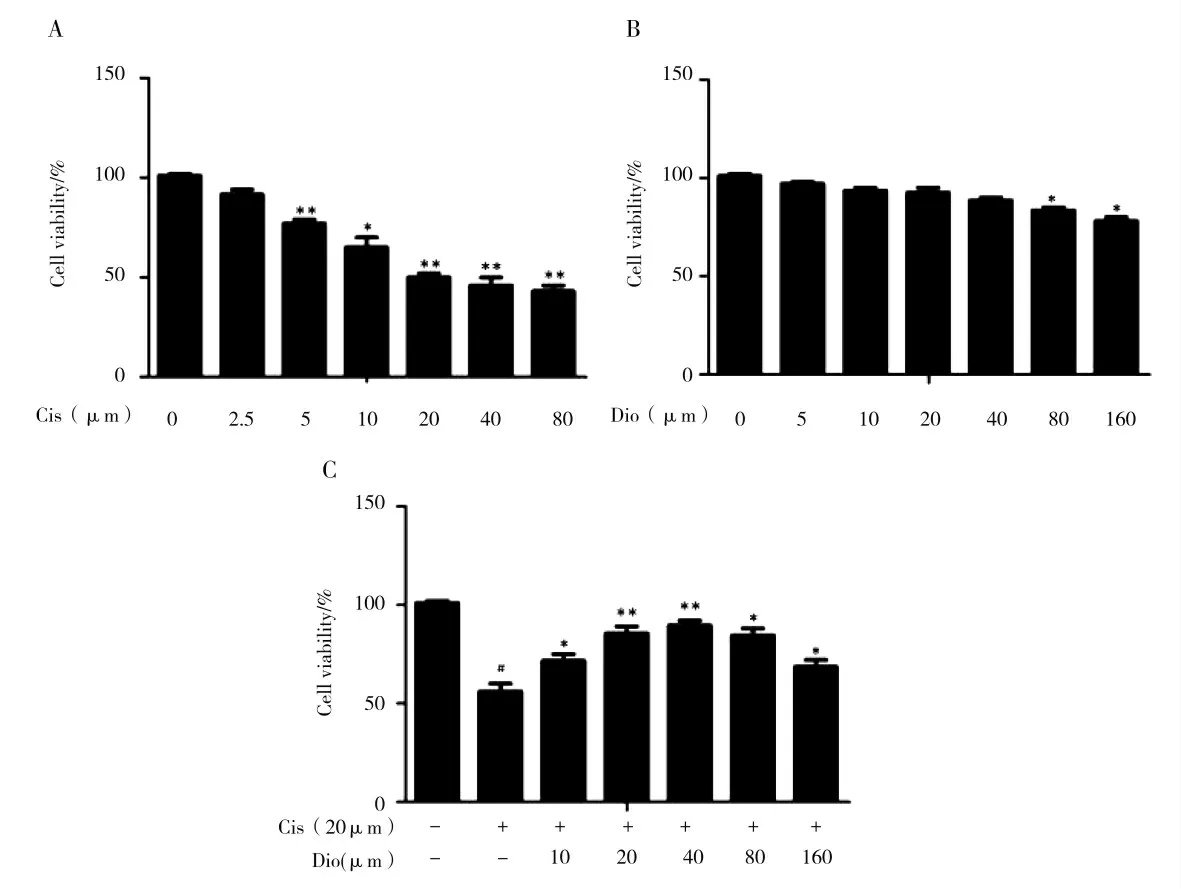
图1 香叶木素对顺铂诱导的mRTEC存活率的影响及药物剂量的筛选Fig.1 Effect of diosmetin on survival rate of mRTECinduced by cisplatin and screening of drug dose
2.2 香叶木素对顺铂处理的mRTECROS产生的影响
确定了香叶木素及顺铂的计量之后,通过检测细胞活性来看香叶木素对顺铂造成的细胞损伤的影响。从结果可以看到顺铂对细胞造成了显著的损伤,而香叶木素对这样的损伤有一个明显的抑制作用。随后,检测了香叶木素对顺铂处理的细胞的ROS产生的影响。在荧光显微镜下观察到的不同药物剂量对加入顺铂后的mTEC细胞的ROS检测实验结果可以看到,顺铂组荧光强度较空白对照组明显增加,随着加入的香叶木素剂量的增加,对于荧光强度的减弱作用也显著降低了,说明香叶木素能够剂量依赖的抑制顺铂对mTEC细胞氧化应激的产生(图2)。
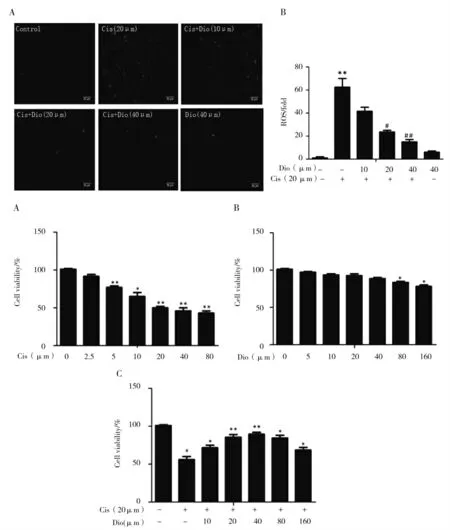
图2 香叶木素对顺铂诱导的mRTEC ROS产生的影响Fig.2 Effect of diosmetin on cisplatin-induced mRTECROSproduction
2.3 香叶木素对顺铂处理的mRTEC细胞凋亡的影响
ROS的检测结果说明氧化应激与细胞的损伤有着密切的联系,进而进行了如下实验。通过在加入了顺铂及香叶木素的细胞培养板中添加Hoechst染料来检验细胞的凋亡状况。从实验结果可以看到,顺铂组较空白组呈现更多的蓝色荧光。相比加入了香叶木素组,其荧光强度和数量呈现一个剂量依赖的递减(图3)。由此可以看出香叶木素在抵抗顺铂对mRTEC的杀伤作用方面起到一个良好的作用。由此可见香叶木素对顺铂造成的细胞凋亡有一个显著的抑制作用。

图3 香叶木素对顺铂诱导的mRTEC细胞凋亡的影响Fig.3 Effect of diosmetin on mRTECcell apoptosis induced by cisplatin
2.4 香叶木素对顺铂处理的mRTEC抗氧化通路的影响
为了验证香叶木素通过Nrf2抗氧化信号通路对顺铂诱导的mTEC细胞的损伤有抑制作用,通过提取mRTEC细胞蛋白,进行了Western Blot实验。结果显示,在细胞中的Keap-1蛋白在顺铂刺激下表达量显著增加了(图4 A),而Nrf2及下游蛋白HO-1,NQO1的表达情况一致地呈现剂量依赖的下调(图4 B,C和D)。说明香叶木素确实能够通过Nrf2抗氧化信号通路来缓解顺铂对mTEC对细胞造成的损伤。
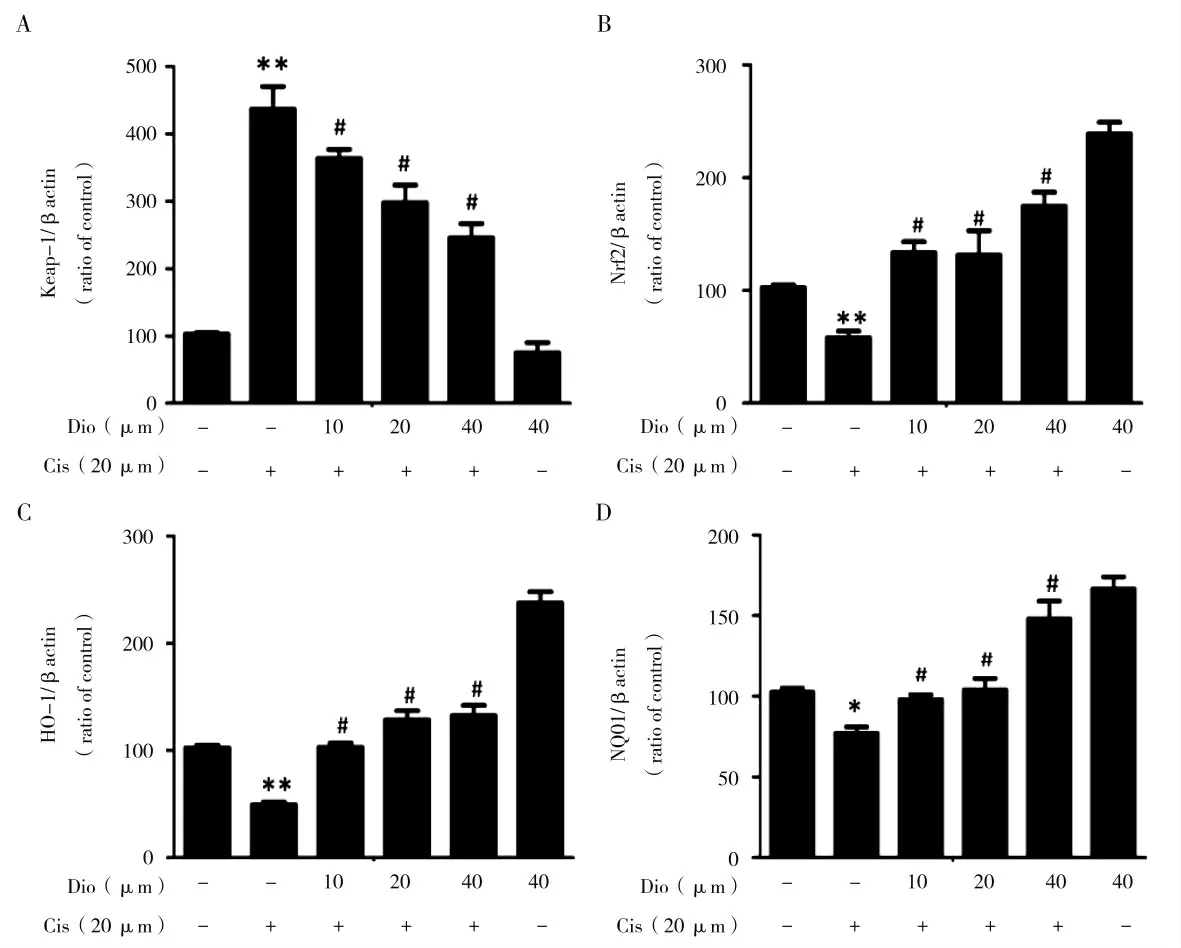
图4 香叶木素对顺铂处理的mRTEC抗氧化通路的影响Fig.4 Effect of diosmetin on cisplatin-treated mRTECantioxidant pathway
2.5 香叶木素对不同癌细胞的影响
香叶木素可以改善顺铂引起的肾损伤。为了研究香叶木素在顺铂抗癌过程中的作用,将顺铂和香叶木素与人肺癌细胞(A549),小鼠T淋巴瘤(OVA),人宫颈鳞状细胞癌(SiHa),人宫颈癌细胞(Hela)一起使用。结果显示香叶木素可以显著抑制A549,SiHa和OVA细胞的生长(图5A,B和C),但是对Hela细胞的作用不明显(图5D)。这表明香叶木素对不同的癌细胞具有一定的抗癌作用。
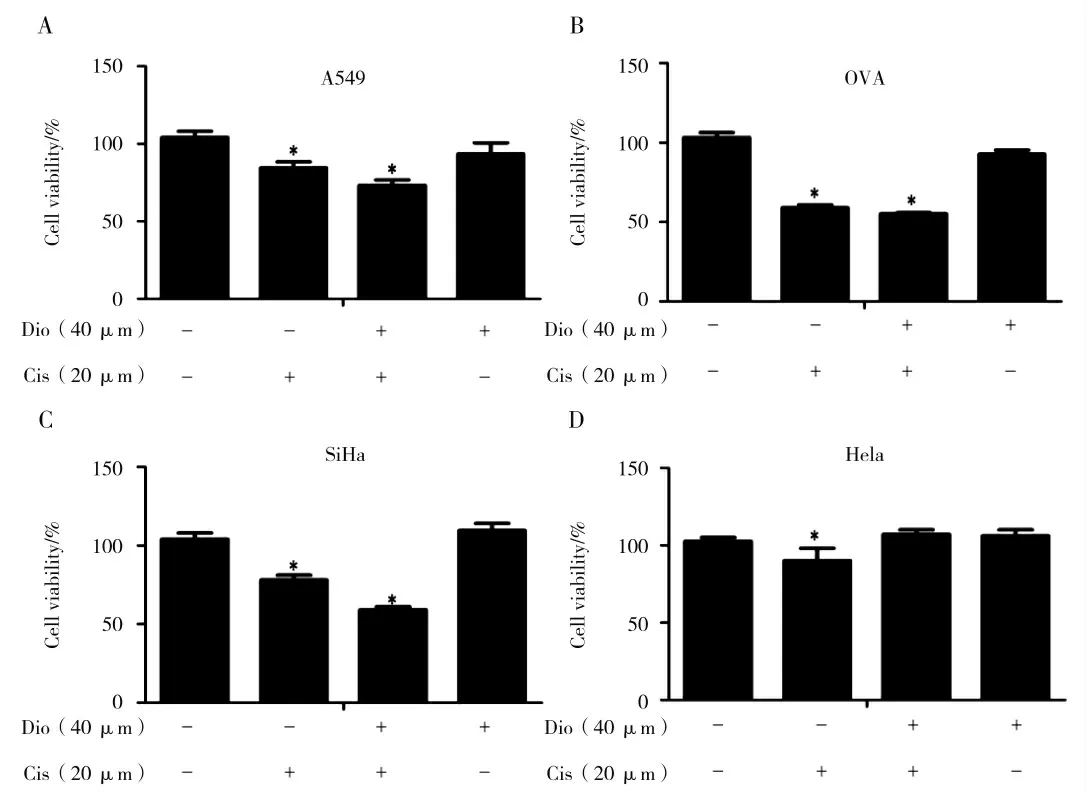
图5 香叶木素对不同癌细胞的影响Fig.5 Effect of diosmetin on different cancer cells
3 结论
根据较早的报道,顺铂引起的急性肾脏损伤的主要机制包括氧化应激,炎症和细胞凋亡。香叶木素对顺铂诱导的mRTEC的氧化应激和细胞凋亡具有保护作用。因此,我们推测香叶木素可以改善顺铂诱导的肾毒性。结果表明,香叶木素可显著改善顺铂诱导的mRTEC的细胞凋亡和氧化应激,对顺铂诱导的急性肾损伤具有保护作用。
氧化应激是一个过程,其中外部刺激或自身变化导致人体的ROS增加或ROS清除。已知氧化应激是通过增加ROS促进顺铂诱导的肾毒性的重要因素。细胞内ROS水平由抗氧化剂基因严格控制,抗氧化剂基因主要由转录因子Nrf2调节[13]。香叶木素可以减少顺铂诱导的mRTEC中ROS的产生,并改善氧化应激诱导的细胞凋亡。Nrf2是细胞抗氧化剂的关键调节剂。在正常条件下,Nrf2识别并与Keap1形成聚合物,而其作用被Keap1抑制。在氧化应激和其他条件下,Nrf2和Keap1解离被激活,激活抗氧化反应元件(ARE),调节II期解毒酶基因和抗氧化酶基因的表达,并增加细胞的氧化应激和亲电性。对诸如生物大分子的物质具有抗性。因此,调节Nrf2激活是预防氧化应激相关疾病风险的有效策略之一[14-16]。据报道,天然类黄酮可通过激活Nrf2途径诱导保护性基因的表达,香叶木素就展现了很好的抗氧化活性[17-18]。
过量的ROS产生导致包括细胞凋亡相关一系列信号通路的激活。p53蛋白是DNA损伤的分子传感器,并且Bcl-2已显示抑制p53介导的细胞凋亡[19]。Bcl-2基因是一种对细胞凋亡具有抑制作用的癌基因,近年来的一些研究已经开始揭示这种作用的机制。Bcl-2可以与Bcl-2家族的Bcl-2,Bcl-Xs,Bax,Bcl-2,Bad和Mc1-1形成同源蛋白质二聚体,而特定的蛋白质二聚体可以用作细胞。死亡信号转导通路上的分子开关。例如,Bcl-2与促凋亡Bax形成二聚体[20-21]。如果Bax的相对量高于Bcl-2,则Bax同二聚体的数量会增加,从而促进细胞死亡。此外,P35蛋白还可以抑制某些半胱天冬酶的功能。实验的结果虽然没有深入探究凋亡相关信号通路揭示香叶木素在顺铂诱导的mRTEC中的作用,但从Hoechst染色结果以及细胞存活率等试验的结果看出细胞凋亡的重要性。香叶木素可以显著抑制顺铂诱导的mRTEC造成的凋亡,具体的机制还尚待深入研究。
顺铂是临床上用于治疗实体瘤的最常用化学治疗药物之一,由于肾毒性的高发生率,其临床应用受到限制。作为卓越的化疗药物,香叶木素能够显著改善顺铂造成的AKI,因此,能否联合顺铂和香叶木素治疗癌症成为了关注点。研究结果显示,顺铂对各种癌细胞具有杀伤作用,而在香叶木素的联合下,其抗癌作用得到了一定的提升,这为临床上治疗癌症提供了一个新的思路。
综上发现证明了香叶木素对顺铂诱导的mRTEC具有保护作用,这种作用可通过氧化应激和凋亡途径得到缓解,而炎症相关的途径还有待进一步的研究。

