干燥方式对毛竹细胞壁孔隙结构的影响
曹梦丹,张雪霞,任文庭,朱家伟,王汉坤,徐皓诚,余雁*
(1. 国际竹藤中心,北京 100102;2. 国家林业与草原局/北京市共建竹藤科学与技术重点实验室,北京 100102;3. 福建农林大学材料工程学院,福州 350108)
竹材是一种重要的可再生资源,综合力学性能优异,但也存在易霉变腐朽、横向渗透性差、较难胶合、易于开裂等缺陷,严重制约其使用。将改性试剂浸注到竹材中,使其与细胞壁中的羟基发生反应,占据或封闭细胞壁中的纳米孔隙,可以达到改善其使用性能的目的[1-2]。细胞壁的孔隙特征在很大程度上决定了所能容纳化学试剂的空间尺寸、负载率等关键指标,同时,细胞壁中的纳米孔隙也是影响生物质预处理效果,以及纤维素水解或酶解效率的重要因素之一[3]。因此,研究竹材细胞壁的孔隙特征对于竹材的科学利用具有重要的理论和指导作用。
根据国际纯粹与应用化学联合会(IUPAC)的分类,多孔材料的孔隙结构根据其孔径大小可划分为微孔(孔径<2 nm)、中孔(2 nm≤孔径<50 nm)、大孔(孔径≥50 nm)[4-5]三类。竹材的大孔主要包括各种细胞腔、纹孔、细胞间隙等。中孔和微孔主要存在于细胞壁和纹孔膜中,其中:中孔可能主要存在于微纤丝之间,是纤维素微纤丝之间被木质素、半纤维素和抽提物部分填充后形成的空间[1];微孔直径较小,可能主要存在于木质素空间网状结构内,也可能存在于纤维素基本纤丝之间[6-8]。表征生物质材料孔隙结构的参数主要有孔隙率、孔径分布、孔隙形状和孔容等,相关的表征研究方法很多,各有其优缺点[9-10]。气体吸附法(gas adsorption isotherms)可以对微孔、中孔和小尺寸大孔的孔径分布和孔体积等参数进行定量分析[11-13]。
干燥是细胞壁孔隙坍塌的一个重要因素。木材干燥有常规干燥、冷冻干燥、溶剂置换干燥和超临界干燥等多种干燥方式。前人已经就干燥对木材孔隙的影响进行了研究[1,14-15],而目前有关竹材细胞壁孔隙特征的报道较少,主要集中在包括纹孔在内的大孔系统中[16-20],这很可能是因为竹材细胞壁孔隙率和比表面积较小,测量难度大[21]。大部分竹材进行改性处理前都要经常规干燥处理,对竹材常规干燥后孔隙结构的了解,有助于优化竹材改性工艺;而CO2超临界和冷冻干燥可以尽可能保持孔隙结构,便于了解竹材的近似天然孔隙特征。笔者以毛竹为研究对象,同时采用N2吸附和CO2吸附对毛竹细胞壁中的中孔和微孔进行研究。在进行表征前,采用常规干燥、冷冻干燥和CO2超临界干燥等3种不同干燥方法对毛竹进行干燥处理,利用N2和CO2吸附系统测定孔容、孔径分布等孔径结构参数,研究不同干燥方式对毛竹细胞壁孔径结构的影响规律。
1 材料与方法
1.1 试验材料
毛竹(Phyllostachysedulis)采自福建省尤溪县百竹园,竹龄为4 a。取竹杆高2 m左右的节间,采样后,将样品立即保存于冰箱以保持其湿润状态。去除样品的竹青与髓环部分后,锯切成4 mm×4 mm×4 mm的小试样,并将这些试样随机分为3组。
1.2 试验方法
1.2.1 干燥处理
测试前采用常规干燥、冷冻干燥和CO2超临界干燥3种方式对试样进行干燥处理。常规干燥:将样品放入干燥箱中进行,80 ℃条件下干燥48 h,样品标记为M(C)。冷冻干燥:首先用液氮将样品完全冷冻,然后迅速将其转移至真空干燥机(FreeZone 2.5L,美国Labconco公司)内,冷阱温度为-80 ℃,压力小于0.6 Pa,干燥 48 h,样品标记为M(FD)。CO2超临界干燥:将样品依次放入体积分数为20%,40%,60%,70%,80%,90%和100%的乙醇溶液中处理1 d,梯度置换试样中的水分[22],置换完成后,放入临界点干燥仪(Autosamdri-815A,美国Tousimis公司)内进行干燥,样品标记为M(SD)。
干燥完成后,经威廉研磨仪(3383-L40,美国Thomas Scientific公司)粉碎过筛得到30~60目(粒径250~600 μm)的竹粉,待用。研磨过程可能会导致竹材细胞壁产生额外直径较大的裂隙,但Shi[22]研究认为,轻度研磨对木材细胞壁的微孔和中孔没有显著影响。
1.2.2 毛竹孔隙结构的显微观察
利用场发射扫描电镜(field emission scanning electron microscope,FE-SEM)对常规干燥毛竹横切面进行形貌观察。进行扫描电镜观察前,所有试样均采用真空溅射镀膜机喷涂金200 s,以提供充分的电导率。
1.2.3 细胞壁孔隙率测试
使用经典的比重瓶法[23]测量毛竹样品细胞壁的孔隙率,介质分别为二甲苯(非极性溶剂)和水(极性溶剂)。由于非极性的二甲苯无法进入细胞壁孔隙,因此测得的为含孔的细胞壁密度;而水则可以进入细胞壁的大部分孔隙,测得的为排除大部分孔隙后的细胞壁实质密度。
具体操作步骤:称取质量为m1(2~3 g)的绝干样品,加入25 mL的比重瓶中;然后向比重瓶中注入液体,待粉末完全浸没后放入真空干燥器中抽真空,直至样品中的气泡完全去除;释放真空后,将液体加入比重计中,使比重计和塞子上的毛细管孔充满置换液,擦去多余的液体并称质量(m2);倒出液体和样品,清洗并烘干比重瓶,重新加满液体后再称质量(m3)。
以水作为介质得到的实质密度为:
以二甲苯作为介质得到的细胞壁密度为:
细胞壁孔隙率为:
式中:ρw为水的密度;ρx为二甲苯的密度。
1.2.4 细胞壁孔隙测试
使用Autoabsorption-1全自动物理化学吸附仪(美国Quantachrome公司),以N2为吸附介质对毛竹细胞壁的中孔进行测试。取1 g左右干燥处理后的竹粉,放入6 mm的球管中。为去除样品表面残余的水分和杂质,所有样品在氮气吸附试验前需在80 ℃下进行10 h以上的抽真空脱气处理,然后再以纯度大于99.999%的高纯氮气为吸附质,在液氮冷却条件下(液氮温度为77 K)进行氮气的等温物理吸附-脱附测定。吸附-脱附的相对压力P/P0(P为吸附压力,P0为氮气在77 K下的饱和蒸气压)在10-7~0.998之间,以65个等距点进行测试,得到吸附等温线。软件默认选择骤冷固体密度泛函理论(quenched solid density functional theory,QSDFT)平衡模型计算N2吸附等温线,得到中孔的孔径分布,用Barrett-Joyner-Halenda(BJH)模型计算中孔的孔容。
使用美国Micromeritics公司的ASAP 2020比表面积及孔径分析仪,CO2作为吸附介质对毛竹细胞壁的微孔进行测试。试验前,以N2吸附前的相同条件进行脱气。试验温度为273 K,吸附-脱附的相对压力P/P1(P1为CO2在273 K时的饱和蒸汽压)范围为0.000 1~0.029,以56个等距点进行测试,获得吸附等温线。软件默认选择非定域密度泛函理论(non-local density functional theory,NLDFT)平衡模型计算CO2吸附等温线,得到样品在微孔区域的孔径分布,用Horvath-Kawazoe(HK)模型计算微孔的孔容。
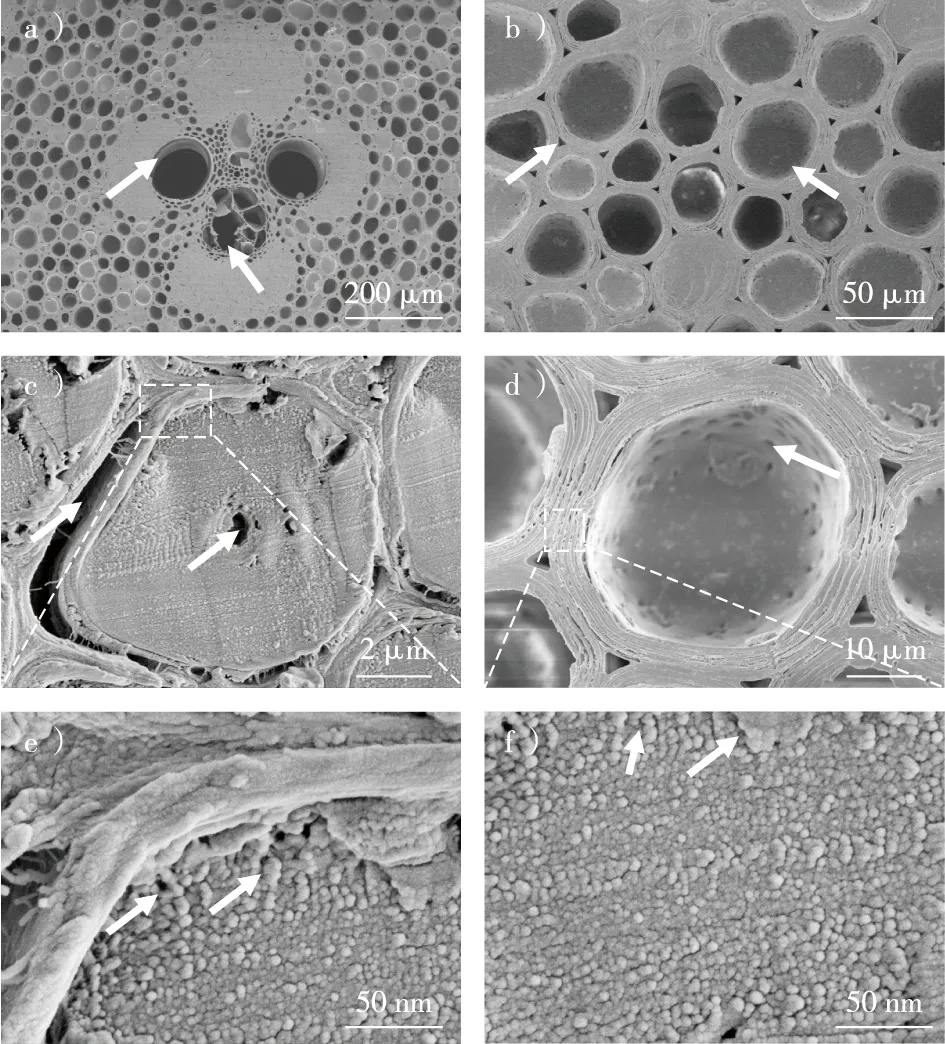
a)维管束的木质部导管和韧皮部筛管;b)薄壁基本组织及其细胞间隙;c)竹纤维横截面的孔隙结构;d)薄壁组织细胞横切面的孔隙结构;e)竹纤维细胞壁上纤维素微纤丝聚集体及之间的孔隙;f)薄壁组织细胞壁的纤维素微纤丝聚集体及其之间的孔隙。图1 毛竹横切面的形态特征Fig. 1 Morphological characteristics of the cross section of Phyllostachys eduli
2 结果与分析
2.1 毛竹孔隙结构的显微观察
应用扫描电镜可以观察到毛竹尺寸较大的孔隙结构,如图1所示。在毛竹的横切面上可见尺度大小不同的孔隙结构,包括原生和后生木质部大导管、韧皮部筛管、薄壁组织细胞腔、竹纤维细胞腔、细胞间隙等。竹纤维腔小、壁厚,细胞壁结构致密,但壁层之间常由于干缩分离产生较大的裂隙(图1c)。在高分辨场发射电镜下,竹纤维细胞壁中纤维素微纤丝聚集体清晰可见,大致呈近似圆形界面,排列紧密,一般难以观察到明显的孔隙。有时可在靠近初生壁的次生壁区域观察到一些纳米尺度较大的孔隙(图1e中箭头所示),这可能是样品制备过程中因干燥而后天形成的。相比之下,薄壁组织细胞腔大、壁薄,细胞腔直径显著大于竹纤维细胞腔,细胞壁上分布着丰富的纹孔(图1d中箭头所示),并且由于干燥,其壁层之间出现明显的裂隙。在高倍FE-SEM图像下,也可以观察到纤维素微纤丝之间形成更多尺寸大小不一的孔隙(图1f中箭头所示)。何盛等[18]用扫描电镜对毛竹孔隙结构进行了观察,结果显示:导管直径在90 μm左右,薄壁细胞直径约30 μm,竹纤维直径约10 μm,纹孔直径约1 μm。刘嵘等[16]采用树脂铸型扫描电镜观察,发现毛竹导管上纹孔内口和外口的直径分别为0.9~2.7和1.1~3.8 μm。由于扫描电镜的能力有限,细胞壁上存在一些无法观察到尺寸的更小孔隙,需要用其他方法进行检测。
2.2 不同干燥处理对毛竹细胞壁孔隙率的影响
将常规干燥、冷冻干燥和CO2超临界干燥对毛竹细胞壁密度、实质密度和细胞壁孔隙率的影响进行了比较,如图2所示。图2a为预处理后的毛竹实质密度,由方差分析可知,在显著性水平0.05下,不同干燥方式对毛竹细胞壁的实质密度影响不显著,数值为1.508 0~1.509 9 g/cm3。杜复元等[24]以水作为置换介质,得到的竹材实质密度为1.481~1.514 g/cm3。因此,干燥方式不影响毛竹的实质密度,即干燥方式不影响毛竹细胞壁物质的体积。
图2b为预处理后的毛竹细胞壁密度,由方差分析可知,在显著性水平0.05下,M(C)的细胞壁密度(1.459 3 g/cm3)显著大于M(FD)和M(SD)(分别为1.434 3和1.428 4 g/cm3),而M(FD)和M(SD)之间无显著差异。由此可见,常规干燥得到毛竹细胞壁密度显著大于冷冻干燥和CO2超临界干燥,但后两种干燥方法之间的差异不显著。因此,干燥方式对毛竹的细胞壁密度有明显影响。杨琳等[25]对尾巨桉(Eucalyptusurophylla×E.grandi)进行了冷冻干燥和常规干燥,发现冷冻干燥能更大程度保持细胞形态,保留孔隙结构。董国利等[26]研究发现,超临界干燥能进一步提高TiO2粉体的性能,比常规干燥的孔容提高了约15倍。
从图2c中可以看出,M(C)的细胞壁孔隙率为3.35%,显著低于M(FD)和M(SD)(分别为4.89%,5.35%),表明冷冻干燥和CO2超临界干燥能较好地保存毛竹细胞壁的孔隙结构,其中CO2超临界干燥保持毛竹细胞壁孔隙的效果最好。根据毛细管吸附理论,常规干燥过程中,自由水的迁移会导致毛细管张力大于细胞壁横纹抗拉强度,造成严重的皱缩现象,产生严重缺陷[27]。冷冻干燥过程中,由于样品处于冷冻状态,冰在真空低温的条件下直接升华,不产生毛细管张力,能较大程度地保持细胞壁形态,避免细胞壁内部孔隙结构发生坍塌[28],同时在液氮冷冻过程中细胞腔中的自由水转化为冰,使液态水在管腔中扩张,赋予细胞壁压应力造成细胞壁水分流失,细胞壁变硬,从而降低收缩率。CO2超临界干燥是在干燥介质CO2的临界温度(31.1 ℃)和临界压力(9.3 MPa)条件下进行的一种干燥方式[29],不存在气液界面,避免了毛细管张力的产生,因此不会造成多孔材料的收缩和结构破坏,保持了多孔结构的完整[30]。
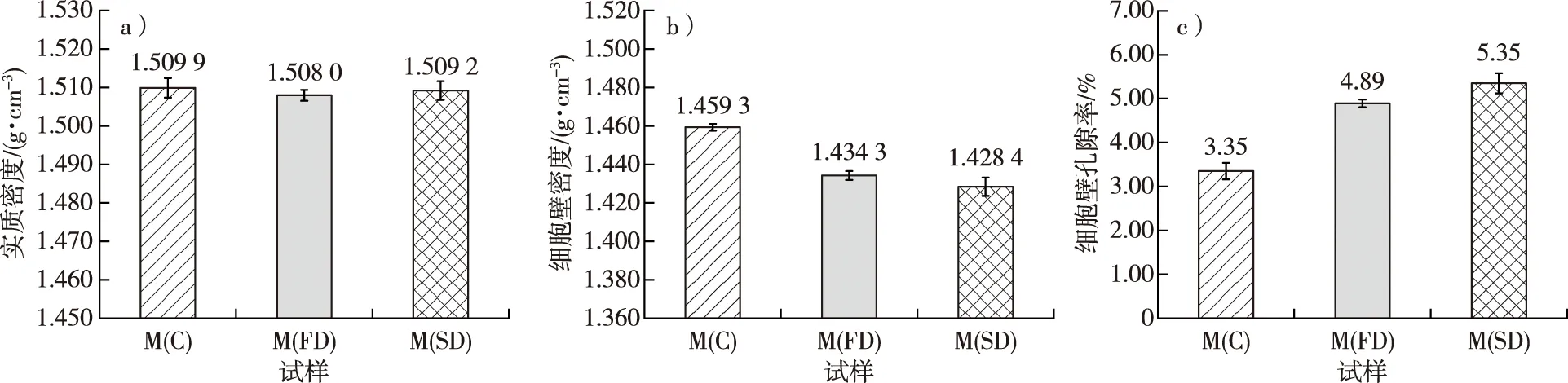
图2 不同干燥处理后的毛竹实质密度(a)、细胞壁密度(b)和细胞壁孔隙率(c)Fig. 2 The density of substance (a), cell wall density (b) and cell wall porosity (c) of moso bamboo using different drying methods
2.3 不同干燥处理对毛竹细胞壁中孔的影响
毛竹N2吸附等温线和中孔的孔径分布见图3。根据IUPAC分类[30],所有样品的吸附等温线均属于Ⅱ、Ⅳ混合型吸附等温线,在较低相对压力下存在一定的吸附量,该阶段主要填充微孔,说明样品中存在微孔。吸附量随相对压力的增加而增加,此时发生毛细管冷凝,表明有中孔的存在。相对压力较高时,吸附量迅速增加,且未能达到吸附饱和。脱附等温线与吸附等温线不一致,存在滞后环。一般认为,滞后环的类型与孔隙形状之间存在相关性[11-12,31]。根据IUPAC的分类,3种干燥处理后的毛竹N2吸附的滞后环均属H3型,在较高相对压力区域吸附量随着相对压力增加而单调递增,没有表现出极限吸附量,反映的是一种具有层状结构的聚集体产生的裂缝状孔隙[11,32]。因此,干燥方式并未改变毛竹细胞壁的孔隙形状。N2的吸附量从小到大依次为M(C)、M(FD)、M(SD),表明细胞壁的总孔容从小到大依次为M(C)、M(FD)、M(SD),这一结果与比重瓶法测得的结果相符。因此,干燥处理的方式对毛竹的细胞壁孔隙数量有显著影响。邱坚等[33]采用CO2超临界干燥制备木材-SiO2气凝胶复合材料,干燥后保持良好的网络结构,孔隙尺寸为13~300 nm。苌姗姗等[15]研究发现,经CO2超临界干燥处理的杨木应拉木具有完好的中孔特征,BET比表面积和中孔孔容显著高于常规和冷冻干燥处理的试样。
由图3b可见,M(C)、M(FD)和M(SD)中孔的孔径分布存在明显差异,分别在孔径为2.0,2.2,3.5 nm处出现峰值,在2.0~4.5 nm范围内,M(FD)和M(SD)的峰值和峰宽明显大于M(C),表明这一范围内孔隙数量较多,主要存在于微纤丝之间[34]。此外,CO2超临界干燥后毛竹细胞壁孔径峰宽也明显大于冷冻干燥后,表明CO2超临界干燥相对冷冻干燥能更好地保持竹材细胞壁的孔隙结构。王学宝等[35]采用自然干燥、冷冻干燥和CO2超临界干燥3种方式制备了高氯酸铵(ammonium perchlorate,AP)/石墨烯复合材料,AP的平均粒径分别为160,162和69 nm,通过冷冻干燥制备的AP/石墨烯复合材料结构疏松,石墨烯骨架坍塌,多孔结构不明显;而通过CO2超临界干燥制备的AP/石墨烯复合材料能基本保持与石墨烯气凝胶相似的外观和多孔结构。由此可见,CO2超临界干燥是保持材料孔隙结构较好的干燥方式,在CO2流体的超临界温度和压力下,可以消除气液表面压力,从而减小毛细管张力,防止细胞壁内部骨架坍塌,保护孔隙结构[15,36]。
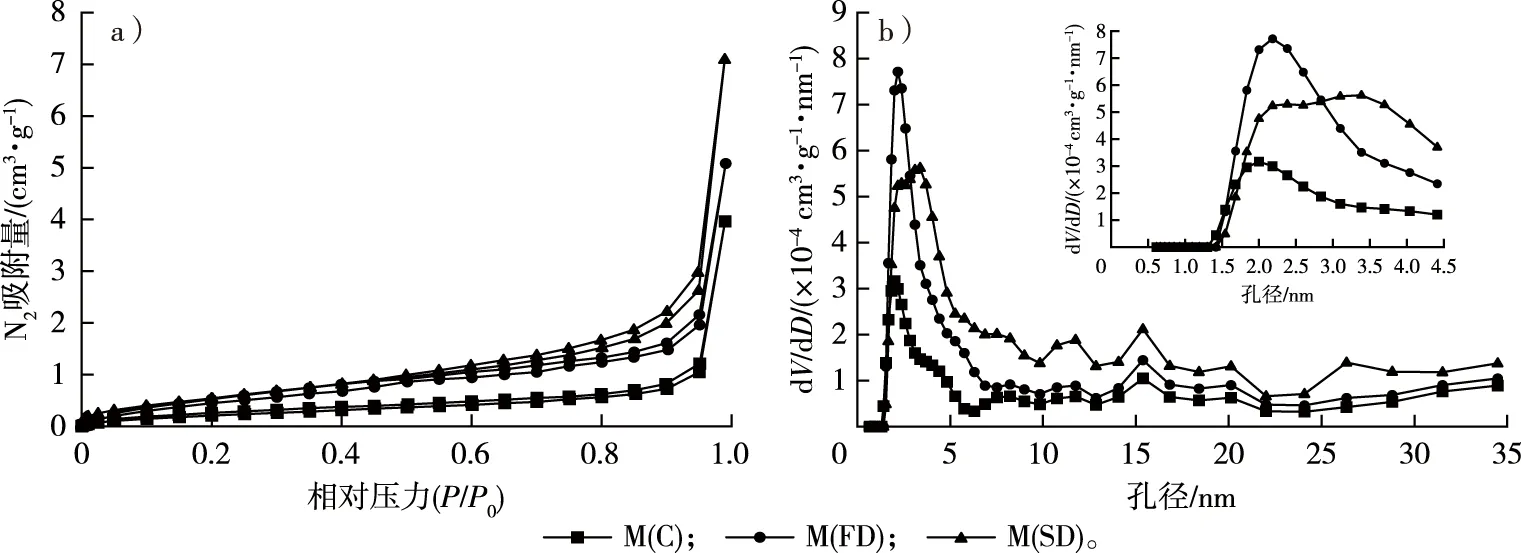
图3 不同干燥方式下毛竹的N2吸附等温线(a)和中孔的孔径分布曲线(b)Fig. 3 The N2 adsorption isotherm (a) and mesopore size distribution curves (b) of moso bamboo using different drying methods
不同干燥处理后毛竹的中孔孔容和不同孔径的孔容占比见图4。通过方差分析可知,在显著性水平0.05下,M(C)和M(FD)的中孔孔容(分别为0.001 8 和0.002 6 cm3/g)无显著性差异,而M(SD)(0.004 3 cm3/g)与其他两种干燥处理有显著差异。由此可见,经过CO2超临界干燥处理后,毛竹细胞壁的孔容显著大于其他两种干燥方式。苌姗姗等[15]的研究发现,CO2超临界干燥处理的杨木应拉木具有最好的介孔特征。M(C)、M(FD)和M(SD)孔径为2~10 nm孔隙的孔容分别占中孔孔容的50.01%,60.78%和54.61%,10~20 nm孔隙的孔容分别占中孔孔容的30.68%,23.81%和27.06%,而孔径在20~35 nm孔隙的孔容分别占中孔孔容的19.31%,15.41%和18.33%。由此可见,干燥的毛竹细胞壁中孔的孔径主要为2~10 nm,且冷冻干燥和CO2超临界干燥处理能更好地保留这一范围的孔隙,其中CO2超临界干燥保留中孔的效果最好。
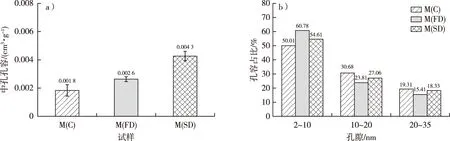
图4 不同干燥方式下毛竹的中孔孔容(a)和不同孔径的孔容占比(b)Fig. 4 The mesopore volume (a) and pore volume ratio of different sizes (b) of moso bamboo using different drying methods
2.4 不同干燥处理对毛竹细胞壁微孔的影响
不同干燥处理毛竹的CO2吸附等温线和微孔的孔径分布见图5。一般地,均匀微孔材料的CO2吸附等温线是可逆的,而毛竹细胞壁的CO2吸附等温线存在明显的滞后现象,Shi等[13]在对木材的研究中也发现了这一现象,原因可能是竹材复杂的微孔结构和选择性捕捉[13,37]。对于CO2的吸附量从小到大依次为M(C)、M(FD)、M(SD),因此,微孔的孔容从小到大依次为M(C)、M(FD)、M(SD)。
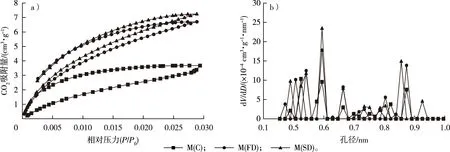
图5 不同干燥方式下毛竹的CO2吸附等温线(a)和微孔的孔径分布曲线(b)Fig. 5 The CO2 adsorption isotherm (a) and micropore size distribution curves (b) of moso bamboo using different drying methods
不同干燥处理后毛竹细胞壁的微孔孔容和不同孔径的孔容占比见图6。方差分析表明,在显著性水平0.05下,M(C)的微孔孔容(0.007 4 cm3/g)显著低于M(FD)和M(SD)(分别为0.010 1和0.010 9 cm3/g),但M(FD)和M(SD)之间无显著差异。因此,冷冻和CO2超临界干燥均能很好地保留微孔结构。M(C)、M(FD)和M(SD)0.4~0.6 nm孔径的孔容分别占微孔孔容的64.34%,61.14%和59.10%;0.6~0.8 nm孔径的孔容分别占微孔孔容的22.69%,16.36%和19.86%;而0.8~1.0 nm孔径的孔容分别占微孔孔容的12.97%,22.50%和21.04%。由此可见,干燥后毛竹细胞壁微孔的孔径主要为0.4~0.6 nm,已有研究表明这部分孔隙主要存在于木质素中[6-8]。当孔径在0.4~0.6和0.8~1.0 nm范围内时,M(FD)和M(SD)的峰值和峰宽明显大于M(C),因此,冷冻和CO2超临界干燥处理能更好地保留这一范围的孔隙,特别是在0.8~1.0 nm范围内,常规干燥导致的孔隙塌陷更加明显。
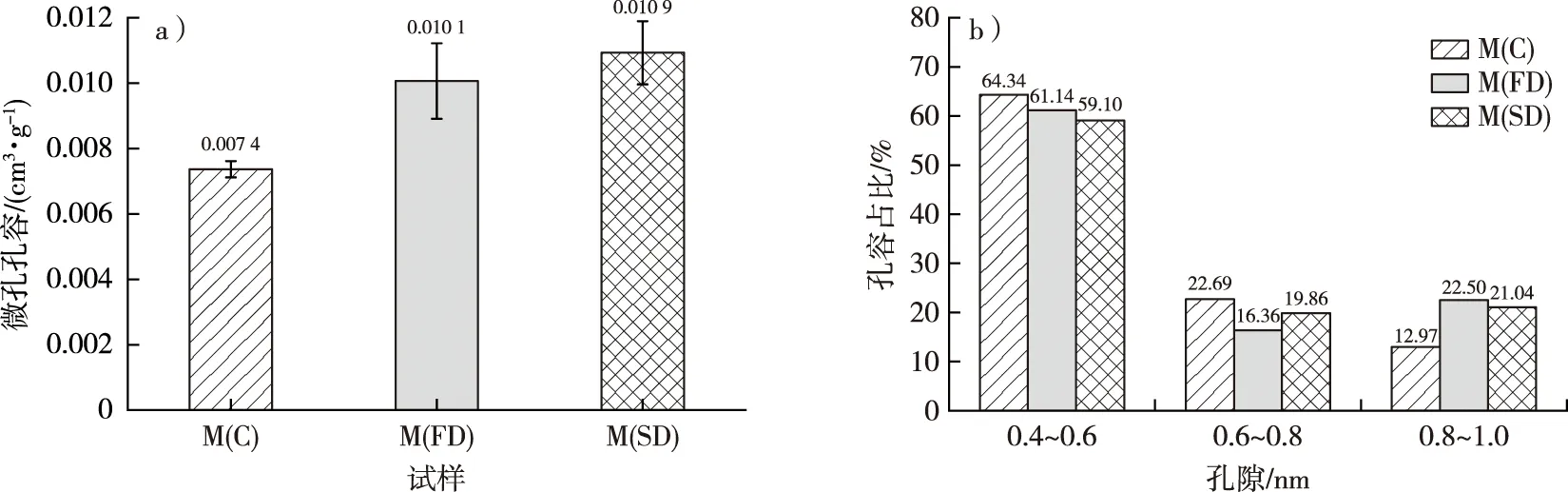
图6 不同干燥方式下毛竹微孔孔容(a)和不同孔径的孔容占比(b)Fig. 6 The micropore volume (a) and pore volume ratio of different sizes (b) of moso bamboo using different drying methods
3 结 论
采用场发射扫描电镜对毛竹尺寸较大的孔隙结构进行观察,发现在毛竹的横切面上可见尺度大小不同的孔隙结构,包括原生和后生木质部大导管、韧皮部筛管、薄壁组织细胞腔、竹纤维细胞腔、细胞间隙等孔隙结构。不同干燥方式对毛竹细胞壁的实质密度影响不显著;常规干燥得到的毛竹细胞壁密度(1.459 3 g/cm3)显著大于冷冻干燥和CO2超临界干燥(分别为1.434 3和1.428 4 g/cm3)。冷冻干燥和CO2超临界干燥处理可以较好地保持毛竹细胞壁的孔隙结构,细胞壁孔隙率分别为4.89%,5.35%,明显高于常规干燥(3.35%)。干燥方式不会改变毛竹细胞壁裂缝状的孔隙结构。CO2超临界干燥处理后,毛竹细胞壁的中孔孔容为0.004 3 cm3/g,显著大于其他两种干燥方式(分别为0.001 8和0.002 6 cm3/g),干燥后毛竹细胞壁中孔的孔径主要为2~10 nm,且冷冻干燥和CO2超临界干燥处理能较好地保留这一范围的孔隙,但后者的效果明显优于前者。常规干燥毛竹的微孔孔容(0.007 4 cm3/g)显著低于冷冻干燥和CO2超临界干燥(分别为0.010 1和0.010 9 cm3/g),干燥后毛竹细胞壁微孔的孔径主要为0.4~0.6 nm,冷冻干燥和CO2超临界干燥处理均能较好地保留这一范围的孔隙,并且两者之间的差异不显著。从总体上看,CO2超临界干燥对毛竹细胞壁孔隙结构的保持效果最优,并且对中孔的保护效果更明显。

