黄芪甲苷抑制缺氧复氧心肌细胞损伤的机制*
梁丽英,陈晶,张永琴,蓝艳梅,刘欢
(广西中医药大学第一附属医院1.医学分子生物学实验室;2.药物临床试验机构办公室,南宁 530023)
随着人口快速老龄化,急性心肌梗死引起的死亡率不断上升,对其的防治任务日益艰巨[1],急性心肌梗死最理想的治疗措施是在冠状动脉已通的基础上实现心肌水平的完全再灌注。研究发现,心肌细胞在经过一段时间缺血后,重新获得血液供应,将会导致该部位心肌结构和功能的损伤,进一步加重心肌缺血-再灌注损伤(myocardial ischemia reperfu-sion injury,MIRI)。如何降低MIRI的发生具有极为重要的临床意义。研究表明心肌细胞损伤是存在于多种心血管疾病中的共同病理现象,微小RNA-21(microRNA-21,miR-21)在抗心肌细胞损伤上具有重要作用[4],其通过调节其靶基因人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome tengene,PTEN),调控心肌细胞的凋亡、增殖,参与氧化应激引起的细胞损伤[2-4]。
从中草药中分离高效低毒活性成分,用于心肌梗死防治,是该领域的一个研究热点[5-7]。黄芪甲苷(astragaloside IV,AS-Ⅳ)是从中药黄芪中分离得到的一种皂苷类化合物。药理学研究显示,黄芪甲苷对心血管系统主要有强心、耐缺氧、保护缺血心肌损伤等作用[8-9],其作用机制仍不清楚。本研究通过建立对缺氧复氧大鼠心肌细胞损伤模型,利用流式细胞技术、实时荧光定量聚合酶链反应(quantitative real-time PCR,qRT-PCR)、免疫荧光等技术分析和探讨miR-21/PTEN途径在黄芪甲苷保护心肌细胞损伤过程中的作用机制,以期为黄芪应用于临床治疗心肌缺血引起的心血管疾病提供实验依据。
1 材料与方法
1.1细胞 心肌细胞H9c2,由中国科学院上海生命科学研究院细胞资源中心提供 。
1.2药品与试剂 黄芪甲苷(中国食品药品检定研究院,每瓶20 mg,货号:84687-43-4);DMEM培养基(Dulbecco's modified eagle medium,DMEM)、胎牛血清(FBS,美国Gibco公司,批号分别为C11885500BT,16000-044);二甲亚砜(DMSO,索莱宝,批号:0231-100)为分析纯; 0.25% 胰蛋白酶-0.02%乙二胺四乙酸(EDTA)溶液(Gibco,批号:25200056);磷酸盐缓冲液(PBS,索莱宝,批号:P1022-500);凋亡试剂盒Annexinv-APC/PI(美国BD公司,批号:7180833);细胞色素C(Cyt-c,上海江莱生物科技有限公司,货号:JL11434);RNA逆转录试剂盒(RT reagent Kit with gDNA Eraser,RR047A)以及荧光定量检测试剂盒(TB GreenTM Premix ExTaqTM II,RR820A)均购自大连宝生物公司;半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)试剂盒(武汉博士德,货号:EK1425);CCK-8试剂(cell counting kit-8,CCK-8,日本同仁,货号:CK04);小鼠抗人B淋巴细胞瘤-2 基因( B-cell lymphoma-2,Bcl-2,武汉博士德,货号:BM0200) 单 克 隆 抗 体;miR-21 模拟物(miR-21mimic) 和 miR-21抑制物 (miR-21 inhibitor)慢病毒由上海吉凯生物公司包装合成,测定病毒滴度后置于-80 ℃保存。
1.3仪器 流式细胞仪(美国贝克曼,CytoFlex)、低温高速离心机(德国eppendorf,5410)、生物安全柜(BIOBASE,BSC-3FA2)、二氧化碳培养箱(美国赛默飞)、三气培养箱(美国赛默飞HERAcell 150i)、酶标仪(美国赛默飞)、倒置荧光显微镜(日本Olympus,IX71)、7500 Fast实时荧光定量PCR系统 (美国Applied Biosystems)。
1.4实验方法
1.4.1细胞培养和缺氧/复氧(hypoxia/reoxygenation,H/R) 模型建立[8]H9c2接种于培养瓶中,加入含10% 胎牛血清,100 U·mL-1青霉素,100 U·mL-1链霉素的 DMEM培养基,于37 ℃、5%CO2饱和湿度的培养箱中培养。隔天换液。待细胞长至约80%,用0.25% 胰蛋白酶消化传代,进行下一步实验。经过条件摸索确定H9c2缺氧复氧模型复制方法:细胞传代铺板常规培养24 h后,缺氧缺糖培养12 h(换成无血清无糖培养基后,置于三气培养箱中 (1%O2,94%N2,5%CO2)孵育12 h,再复氧6 h(换成培养基更换为含10%胎牛血清的DMEM培养基,置于37 ℃、 5%CO2培养箱孵育6 h)。
1.4.2miR-21过表达(miR-21 mimic)和干扰 miR-21(miR-21 inhibitor)慢病毒稳定细胞的转染 将H9c2单细胞悬液接种于25 cm2的培养瓶中培养(5×105个·mL-1),待细胞长至约80%时,按照50 MOI(multiplicity of infection,MOI)的接种病毒量分别接种miR-21过表达和干扰慢病毒至H9c2细胞,接种病毒后12 h吸弃培养液,加入新的培养液继续培养,72 h后荧光显微镜及流式细胞仪观察转染效率,转染效率>90%达到实验要求,为稳定表达miR-21 mimic 或 miR-21 inhibitor细胞,传代细胞进行下一步实验。
1.4.3筛选合适心肌细胞生长的黄芪甲苷浓度
①药物黄芪甲苷的制备:根据前期的研究及参考文献[8-10],选用黄芪甲苷标准品,用时用DMSO溶解(DMSO终浓度<0.1%)。
②黄芪甲苷对H9c2细胞H/R损伤模型细胞增殖的影响:将一定量的生长状态良好的心肌细胞消化后制成细胞悬液,以1×105个·mL-1的密度加入96 孔培养板上中间的孔中,细胞悬液每孔100 μL,将培养板置于37 ℃、5% CO2培养箱贴壁过夜,换成无血清无糖培养基后,置于三气培养箱中 (1%O2、94%N2、5%CO2)孵育12 h,缺氧处理后将培养基更换为含10%胎牛血清的DMEM培养基,置于常规培养箱中培养6 h后以建立缺氧/复氧模型。造模同时分别向各孔加入10 μL 以下各组药物( 黄芪甲苷0,25,50,100, 200 μmol·L-1),每组6个孔,作用至72 h。向每孔加入CCK-8溶液10 μL,继续置于培养箱内孵育1 h,用酶标仪测定在450 nm 处的吸光度(A值),筛选黄芪甲苷对H9c2细胞H/R损伤模型细胞增殖的影响。
1.4.4细胞分组与处置 取对数生长期细胞,传代铺板后随机分为以下6组:正常组 (正常培养72 h)、H/R模型组 (缺氧复氧造模)、H/R+miR-21 mimic组(造模前预先转染miR-21 mimic )、H/R+miR-21 inhibitor组 (造模前预先转染miR-21 inhibitor)、H/R+miR-21 mimic+AS-Ⅳ(造模和AS-Ⅳ干预之前预先转染miR-21 mimic组,造模同时予200 μmol·L-1AS-Ⅳ干预至72 h)、H/R+miR-21 inhibitor+AS-Ⅳ(造模和AS-Ⅳ干预之前预先转染miR-21 inhibitor,造模同时予200 μmol·L-1AS-Ⅳ干预至72 h) 。
1.4.5qRT-PCR检测PTEN、miR-21基因的表达水平 取对数生长期的细胞以2×105个·mL-1的密度接种于 6 孔培养板中,贴壁过夜,按分组要求,经药物孵育72 h后用胰酶消化收集所有细胞使用TRizol法提取细胞总RNA,使用Nandrop2000进行浓度、纯度检测后,按照cDNA逆转录试剂盒说明书,将提取的总RNA逆转录合成第一链cDNA,-20 ℃保存备用。根据NCBI参考序列,设计针对大鼠PTEN、的特异性PCR引物,PTEN (上游序列:ATTCCCAGTCAGG-CGCTA;下游序列:TCACCTTTAGCTGGCAGACC),扩增根据TB GreenTM Premix ExTaqTM II,RR820A试剂盒说明书,扩增后的原始CT值采用2-△△CT方法计算后分析目的基因PTEN的相对表达水平。
使用天根miRcute miRNA提取分离试剂盒提取各组细胞miRNA后,使用miRcute 增强型miRNA cDNA第一链合成试剂盒对所得miRNA同步进行加A尾反应和逆转录反应。对逆转录反应产物采用miRcute增强型 miRNA荧光定量检测试剂盒(SYBR Green)进行qRT-PCR。qRT-PCR扩增后的原始CT值采用2-△△CT方法计算后进行相对定量分析基因表达水平。
1.4.6用流式细胞技术检测心肌细胞凋亡 取对数生长期的细胞以2×105个·mL-1的密度接种于 6 孔培养板中,贴壁过夜,按分组要求处理,经药物孵育72 h后用不含EDTA的胰酶消化收集所有细胞胰酶消化细胞,制成单细胞悬液,按凋亡试剂盒说明书,取100 μL细胞悬液加入5 mL的流式管中,加入Annexinv-APC和PI各5 μL,同时设定对照:对照1,单纯的活细胞,不加任何染料;对照2,活细胞只加Annexinv-APC;对照3,活细胞只加PI,轻轻混匀,室温、避光孵育15 min,加入连接缓冲液400 μL,1 h内用流式细胞仪检测,分析结果。
1.4.7用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和细胞色素C(Cyt-C)的表达 取对数生长期的细胞以2×105个·mL-1的密度接种于 6 孔培养板中,贴壁过夜,按分组要求经药物孵育72 h后用胰酶消化收集所有细胞,每样本细胞数大于1×106个·mL-1,用预冷PBS洗1次,将细胞重悬于PBS中,反复冻融3次后3000 r·min-1离心10 min,取上清液,按ELISA试剂盒说明书要求检测。
1.4.8免疫荧光检测Bcl-2蛋白的表达 取对数生长期的细胞以2×105个·mL-1的密度接种于24孔培养板中,每孔0.5 mL,贴壁过夜,按分组要求处理,细胞按要求处理后,从培养箱中取出,PBS洗3次;4%多聚甲醛固定15 min,PBS洗3次;0.5%Trito-X-100室温通透20 min;PBS洗3次,吸水纸吸干PBS,在培养孔里滴加正常的山羊血清,封闭30 min;吸水纸吸干封闭液,每孔滴加一抗并放入湿盒,4 ℃过夜;PBS洗3次,加入二抗,湿盒中孵育1 h,PBS洗3次;复染核,滴加DAPI避光5 min,洗去多余的DAPI,荧光显微镜观察结果。
1.5统计学方法 实验数据采用SPSS17.0版软件对数据进行方差分析,在方差齐性的前提下通过One-Way ANOVA分析进行各组样本均数间的多重比较,方差不齐时采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1荧光显微镜对转染效率鉴定结果 荧光相差倒置显微镜下可见细胞形态完整,呈纤维状,转染72 h后,荧光显微镜下发现大多数细胞携带荧光(绿色),流式检测结果显示转染效率>90%,符合后续实验要求,见图1。
2.2黄芪甲苷对缺氧复氧心肌细胞H9c2增殖的影响 与0 μmol·L-1黄芪甲苷组比较,200 μmol·L-1的黄芪甲苷作用于细胞,吸光度A值显著提高,A值与细胞增殖呈正相关,根据增殖的能力,选用200 μmol·L-1的黄芪甲苷作用于细胞作为后续的实验条件。见表1。
2.3黄芪甲苷对缺氧复氧损伤细胞H9c2 miR-21、PTEN表达的影响 与H/R模型组比较,正常对照组、H/R+miR-21 mimic组 miR-21的表达量增加、PTEN表达量明显减少,H/R+miR-21 inhibitor组miR-21的表达量下降、PTEN表达量明显增加;与H/R+miR-21 mimic组比较,H/R+miR-21 mimic+AS-Ⅳ组miR-21的表达量增加,PTEN表达量明显减少;与H/R+miR-21 inhibitor组比较,H/R+miR-21 inhibitor+AS-Ⅳ组miR-21的表达量增加、PTEN表达量明显减少,差异有统计学意义(P<0.05或P<0.01)。结果见表2。
2.4黄芪甲苷对缺氧复氧损伤心肌细胞H9c2凋亡百分率的影响 与H/R模型组比较,正常对照组、H/R+miR-21 mimic组凋亡百分率降低,H/R+miR-21 inhibitor组凋亡百分率增加;与H/R+miR-21 mimic组比较,H/R+miR-21 mimic+AS-Ⅳ组凋亡百分率降低;与H/R+miR-21 inhibitor组比较,H/R+miR-21 inhibitor+AS-Ⅳ组miR-21的凋亡百分率降低,差异有统计学意义(P<0.05)。结果见图2和表3。
2.5黄芪甲苷对缺氧复氧损伤心肌细胞H9c2 Caspase-3、Cyt-C表达的影响 与H/R组比较,正常对照组、H/R+miR-21 mimic组Caspase-3和Cyt-C的表达降低,H/R+miR-21 inhibitor组Caspase-3和Cyt-C的表达增加;与H/R+miR-21 mimic组比较,H/R+miR-21 mimic+AS-Ⅳ组Caspase-3和Cyt-C的表达降低;与H/R+miR-21 inhibitor组比较,H/R+miR-21 inhibitor+AS-Ⅳ组Caspase-3和Cyt-C的表达降低(P<0.05或P<0.01)。见表4。
2.6黄芪甲苷对缺氧复氧损伤细胞H9c2 Bcl-2蛋白表达的影响 与H/R组比较,正常对照组、H/R+miR-21 mimic 组形态完整,细胞核清晰,如图蓝色荧光显示,Bcl-2蛋白(表达红色荧光)的表达量减少,与H/R+miR-21 mimic组比较,H/R+ miR-21 inhibitor+AS-Ⅳ组Bcl-2的表达量减少;与H/R+ miR-21 inhibitor组比较,H/R+ miR-21 inhibitor+AS-Ⅳ组Bcl-2的表达量减少,如图3所示。
3 讨论
国家心血管病中心编撰出版的《中国心血管病报告2019》[1]指出,中国心血管病患病率处于持续上升阶段。心血管疾病中以急性心肌梗死(acute myocardial infarction,AMI)的临床症状最为严重,研究AMI的发生、发展过程,寻求有效的治疗药物尤为重要。miR-21及其靶基因 PTEN 在心血管疾病调控的过程中发挥的作用受到人们的关注,其对心脏的保护作用被证实[11]。研究表明,miR-21 可以通过抑制其靶基因PTEN的表达而减轻急性心梗后心肌功能的损伤,同时减少心肌细胞的凋亡,明显地抑制氧化应激及缺血再灌注引起的心肌细胞损伤[12]。本实验采用研究心肌保护作用常用的体外模型H9c2细胞,模拟心肌细胞的缺血再灌注,通过体外缺氧/复氧的模型,试图从调节miR-21的表达水平及其对靶基因PTEN的调节寻求黄芪甲苷对心肌细胞的保护作用机制及靶点。

图1 心肌细胞H9c2转染形态图(×100)
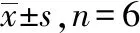
表1 黄芪甲苷对缺氧复氧心肌细胞H9c2增殖的影响
结果显示,黄芪甲苷能明显抑制缺氧/复氧心肌细胞的凋亡。黄芪甲苷能上调缺氧复氧损伤心肌细胞miR-21的表达量,进一步下调损伤心肌细胞PTEN的表达,抑制心肌细胞凋亡。Bcl-2是凋亡分子机制研究的主要靶分子,Caspase-3是凋亡过程中的执行分子,缺氧复氧损伤可诱导线粒体肿胀,增加线粒体膜的通透性,当线粒体接收到凋亡刺激信号,通过释放内外膜间隙里的促凋亡因子,如Cyt-C等,进一步激活下游凋亡通路的半胱氨酸的天冬氨酸蛋白水解酶相关蛋白(Caspase),包括Caspase-9和Caspase-3,参与介导细胞凋亡过程[13-14]。本研究发现,缺氧/复氧损伤后,黄芪甲苷能减少Cyt-C、Caspase-3的释放,抑制细胞凋亡。
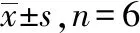
表2 黄芪甲苷对缺氧复氧损伤心肌细胞H9c2 miR-21、PTEN表达的影响
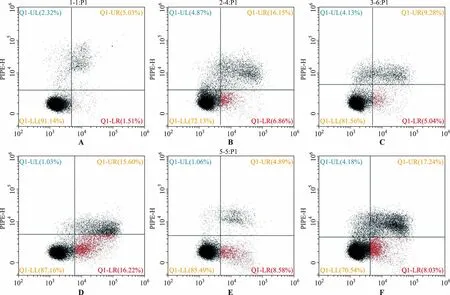
A.正常对照组;B.H/R模型组;C.H/R+miR-21 mimic 组;D.H/R+ miR-21 inhibitor组;E.H/R+miR-21 mimic +AS-Ⅳ组;F.H/R+miR-21 inhibitor +AS-Ⅳ组。
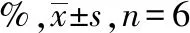
表3 黄芪甲苷对缺氧复氧损伤心肌细胞H9c2 凋亡率的影响
表4 黄芪甲苷对缺氧复氧损伤心肌细胞H9c2 Caspase-3、Cyt-C表达的影响
Tab.4 The effect of Astragaloside on the expression level of Caspase-3 and Cyt-C in hypoxia/reoxygenation injury

组别Caspase-3Cyt-c正常对照组0.63±0.75①1.49±0.13①H/R模型组3.03±0.182.76±0.20H/R+miR-21 mimic组2.35±0.60①2.18±0.12① inhibitor组3.57±0.08①3.71±0.09① mimic+AS-Ⅳ组41.46±0.14①②1.50±0.12①②inhibitor+AS-Ⅳ组2.02±0.13①③2.35±0.28①③F42.9096.74P0.000.00

A.正常对照组;B.H/R模型组;C.H/R+miR-21 mimic 组;D.H/R+ miR-21 inhibitor组;E.H/R+miR-21 mimic+AS-Ⅳ组;F.H/R+miR-21 inhibitor+AS-Ⅳ组。
综上所述,黄芪甲苷抑制缺氧复氧损伤的心肌细胞的凋亡,其机制可能是上调了miR-21的表达,靶向调控PTEN,抑制了相关促凋亡因子Cyt-C、Caspase-3的释放。 miR-21作为一类具有重要调控作用的内源性小分子广泛参与了机体多种生物学过程的调控,它在心血管系统多种生理、病理过程也具有重要的调控作用。从miR-21对心血管系统的调控和作用机制研究心血管疾病,将有助于发现更多天然药物对心血管疾病的作用靶点。然而,本研究仅选择了心肌细胞的缺氧/复氧离体损伤模型,为进一步确证黄芪甲苷对缺血性心脏疾病的保护作用,下一步仍需进行大鼠心肌缺血等整体动物实验研究。

