茶树Ⅲ类过氧化物酶基因家族的鉴定及表达模式分析
史晓霞,张宝会,姚新转,吕立堂,
1. 贵州大学生命科学学院农业生物工程研究院山地植物资源与种质创新省部共建教育部重点实验室,贵州贵阳 550025;2. 贵州大学茶学院,贵州贵阳 550025
过氧化物酶广泛存在于生物体内,可催化作为电子受体的过氧化氢和多种电子供体之间的氧化还原反应[1-2]。根据蛋白序列和结构特征,过氧化物酶分为血红素过氧化物酶和非血红素过氧化物酶,前者主要分为动物类和非动物类血红素过氧化物酶[3],非动物类血红素过氧化物酶又可分为Ⅰ、Ⅱ、Ⅲ类[4]。Ⅲ类过氧化物酶(class Ⅲperoxidases,POD)是植物中一种特殊的氧化还原酶,是一种分泌型过氧化物酶,参与植物体内多种不同的生理过程,如植物防御、细胞壁合成、组织愈伤、植物体内毒性过氧化物的清除等[2-7]。研究表明,POD(也称POX、Prx、Px 或PER)家族成员参与多种植物的生物学过程,如拟南芥(Arabidopsis thaliana)中,AtPrx64 基因过表达可增强转基因烟草植株对铝胁迫的耐受性[8],AtPRX3 基因对植物抗旱和抗盐胁迫具有正向的调节作用[6],AtPrx72基因对叶片木质化有重要影响[9],且POD 基因(At-Prx22,AtPrx39 和AtPrx69)过表达会提高拟南芥的耐寒性[10];萝卜(Raphanus sativus)中,抑制过氧化物酶基因rspral 的表达可发挥抗盐、抗氧化和抗高温功能[11];棉花(Gossypium hirsutum)中GhPOX1 基因具有较高活性氧水平[12],表明GhPOX1 可能通过介导活性氧的产生从而影响细胞生长的过程。
目前,对POD 基因家族在茶树逆境生长中作用的相关研究鲜有报道,因此,本研究在拟南芥全基因组水平上,通过生物信息学方法鉴别茶树POD 基因家族成员,并对其理化特性、系统发育关系、染色体定位、共线性、基序组成和基因结构及在逆境下的表达模式进行系统分析,探讨植物中POD 蛋白序列的进化联系,以期为POD 基因家族的生物学功能研究奠定基础。
1 材料与方法
1. 1 茶树POD 基因家族的筛选及相应蛋白理化性质的预测 根据已报道的拟南芥POD 基因家族信息,从拟南芥信息库(https: / / www.arabidopsis.org /)中下载其氨基酸序列,应用Tbtools 软件(https://github.com / CJ-Chen / TBtools / releases)将下载的序列与茶树基因组数据库进行BLASTP 比对(e <1e-5),初步获得假设的茶树POD 基因,构建关于茶树POD 基因的隐马尔可夫模型,进行第二次搜索鉴定,再次获得假设的茶树POD 基因。将第二次搜索获得的茶树POD 基因蛋白序列提交至NCBI-CDD(https://www.ncbi.nlm.nih.gov / Structure / cdd / wrpsb.cgi)、SMART(http://smart.embl-heidelberg.de/)及Pfam(http://pfam.xfam.org /)系统进行保守结构域鉴定,剔除冗余序列,最终获得茶树POD 基因序列用于后续分析。利用在线软件ExPASy-ProParam(https: // web.expasy.org /compute_pi /)分析茶树POD 基因家族成员蛋白质的相对分子质量及等电点等理化性质。
1. 2 茶树POD 基因家族染色体定位分析 根据Phytozome 12. 0 茶树数据库中的BLASTN 结果,将茶树POD 基因定位至不同的染色体上。
1. 3 系统进化树、基因结构和蛋白质保守基序分析采用MEGA X 软件中近邻连接法(Boostrap 为1 000)构建茶树POD 蛋白序列系统发育树。将茶树POD基因组DNA 序列和CDS 序列提交至GSDS 2. 0(http: / / gsds.cbi.pku.edu.cn /)进行基因结构分析,通过MEME(http: / / meme-suite.org /)进行保守结构域分析,motif 数目设置为15 个,其他均为默认,并利用软件Tbtools 进行作图。
1. 4 拟南芥、葡萄和茶树POD 基因家族的进化分析应用ClustalW 对下载的拟南芥、葡萄和茶树的POD基因蛋白序列进行多序列比对,采用MEGA10. 0 的临近法(neighbor joining,NJ)构建进化树,Boostrap 参数设为1 000。
1. 5 茶树POD 基因家族种内及种间共线性分析利用MCScanX 程序对拟南芥、葡萄和茶树基因组信息进行比对,并通过TBtools 软件分析共线性及基因复制区块。应用DnaSP 5. 0 软件计算非同义替换(Ka)和同义替换(Ks)值[13],剔除同义替换率(Ks)>2. 0 的数值,以避免替代饱和风险。
1. 6 表达模式分析 根据鉴定出的茶树POD 基因的编号,在TPIA(http: / / tpia.teaplant.org)数据库上下载其在茶树不同组织(包括顶芽、嫩叶、成熟叶、老叶、花、果实、茎、根)中及经盐胁迫(0、24、48、72 h)、PEG 诱导的干旱胁迫(0、24、48、72 h)与冷胁迫[非驯化(平均温度10 ℃以下)→完全驯化(平均温度达10 ℃以上)→去驯化]后的转录组数据(TPM 值),对表达数据进行分析并采用TBtools 软件制作热图。
2 结 果
2. 1 茶树POD 基因家族成员鉴定及其相应蛋白的理化性质预测 经BLASTP 比对共获得122 个茶树POD 基因。最长的POD 蛋白(CSSPOD90)含有398个氨基酸残基,最短的(CSSPOD111)含有142 个氨基酸残基;相对分子质量最大为43 700(CSSPOD90),最小为15 300(CSSPOD111);理论等电点(pI)介于4.62(CSSPOD22)~9. 74(CSSPOD67)之间。pI <7 的POD 蛋白达48%(59 个),表明茶树POD 蛋白家族一半富含酸性氨基酸,一半富含碱性氨基酸。
2. 2 茶树POD 基因家族染色体定位分析 获得122 个茶树POD 基因中,CSSPOD11、CSSPOD95、CSSPOD68、CSSPOD24、CSSPOD86、CSSPOD28、CSSPOD108、CSSPOD111、CSSPOD102、CSSPOD62、CSSPOD72、CSSPOD75、CSSPOD93、CSSPOD43、CSSPOD85、CSSPOD94、CSSPOD110、CSSPOD70、CSSPOD67、CSSPOD107、CSSPOD112、CSSPOD2、CSSPOD77、CSSPOD38 共24 个基因不能定位至染色体上,其他98 个基因不均等定位至不同染色体上,其中4 和13 号染色体包含基因个数最多,有12 个茶树POD 基因;14 号染色体不含茶树POD 基因,极有可能发生了高度变异。另外,茶树POD 基因家族存在较多的串联重复基因序列,其中在Chr1、Chr4、Chr7、Chr12、Chr13 染色体上均有2 个,表明这些基因在茶树POD 基因家族的扩张和进化中扮演着重要角色。见图1。
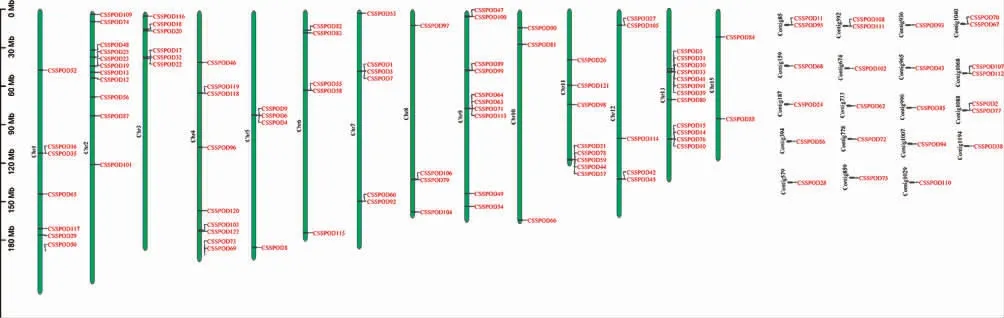
图1 茶树POD 基因家族成员的染色体定位Fig. 1 Chromosome location of members of POD gene family in C. sinensis(L.)
2. 3 系统进化树、基因结构和蛋白质保守基序分析 共鉴定出10 个茶树POD 基因家族成员的保守基序,依次命名为基序1 ~10。亲缘关系越近的成员其基序结构相似度越高;保守基序8 在所有茶树POD 基因家族成员中均有出现,且各亚组所包含的保守基序基本一致,因此该家族蛋白可能具有相似的生物学功能。茶树POD 基因家族有113 个基因含有2 个外显子(最少),推测其功能具有高度保守性,另外9 个基因含有3 ~4 个外显子,其结构可能更为复杂。见图2。
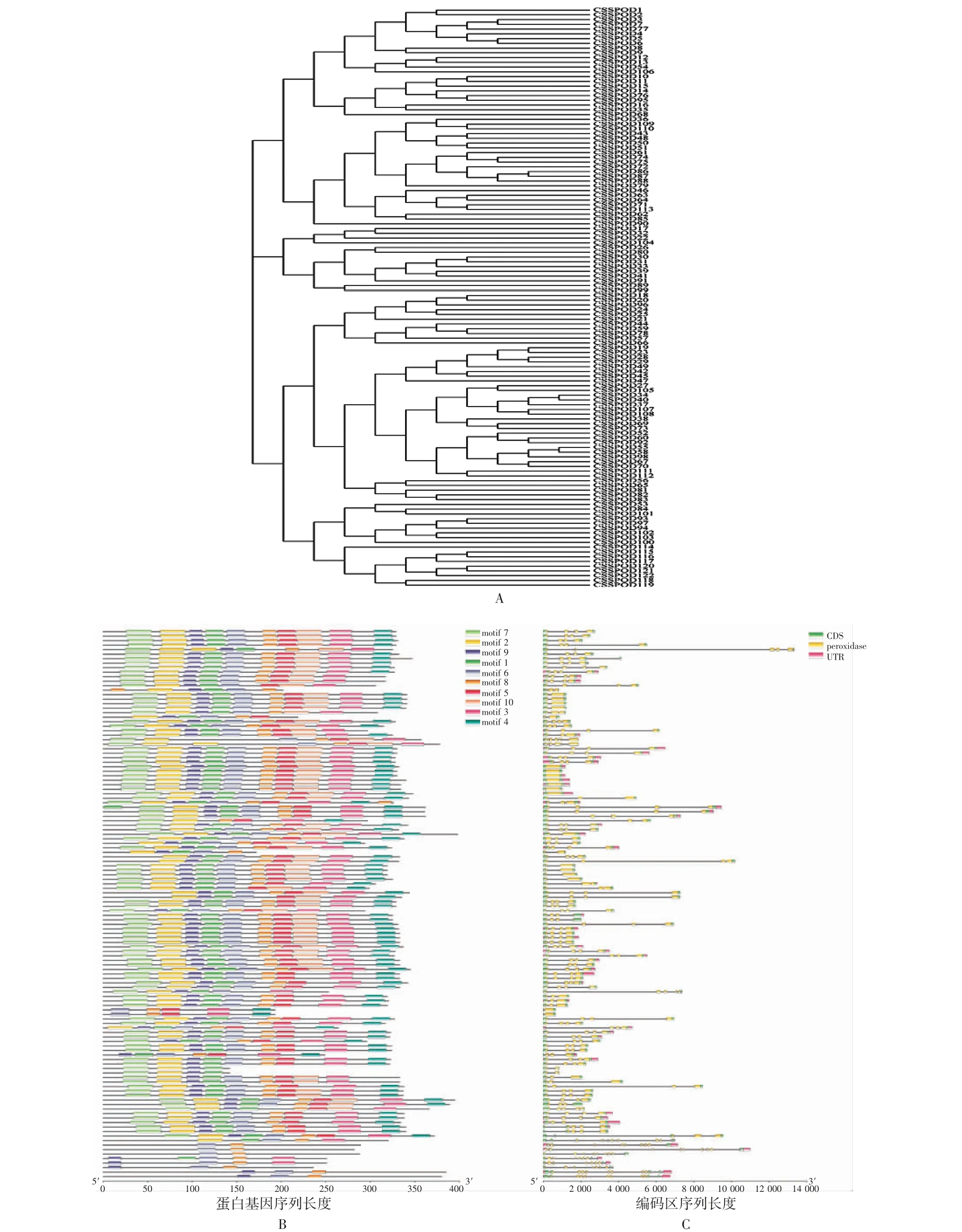
图2 茶树POD 基因的系统进化图(A)、保守基序的示意图(B)及基本基因结构图(C)Fig. 2 Phylogenetic relationships(A), schematic diagram of conserved POD protein motif(B)and basic structure(C)of POD genes in C.sinensis(L.)
2. 4 拟南芥、葡萄与茶树POD 基因家族的进化分析拟南芥、葡萄和茶树POD 基因家族分为5 个簇,其中,簇4 的POD 基因最多,包含49 个茶树POD 基因、27个拟南芥POD 基因和21 个葡萄POD 基因;簇1 的POD 基因最少,包含18 个茶树POD 基因、4 个拟南芥POD 基因和2 个葡萄POD 基因。系统发育树还表明,茶树POD 家族基因与拟南芥、葡萄POD 家族基因有相对亲缘关系。
2. 5 茶树POD 基因家族种内及种间共线性分析122 个茶树POD 基因家族成员中,存在23 对共线性关系,Chr1、Chr2、Chr3、Chr4、Chr6 上的茶树POD 基因家族成员共线性较多,Chr7、Chr9、Chr10、Chr11、Chr15 上的茶树POD 基因家族成员共线性较少。拟南芥和茶树POD 基因间有10 对共线性关系,葡萄和茶树POD 基因间有32 对共线性关系,表明这些POD基因对可能来自共同的祖先,具有相同的功能。另外,葡萄和茶树POD 基因家族具有高度的保守性,在进化过程中发挥重要作用。
2. 6 Ka/Ks 分析 在122 个茶树POD 基因家族成员中筛选出23 对基因进行Ka / Ks 分析,23 个基因对的Ka /Ks 值均<1,见表1。表明这些基因经过较强的纯化选择,复制方式均为全基因组复制或片段复制,在进化中较为保守,结构较为稳定,功能具有一致性。

表1 茶树POD 基因家族的Ka / Ks 分析Tab. 1 Ka / Ks analysis of POD family genes in C. sinensis(L.)
2. 7 茶树POD 基因家族成员在茶树不同组织中的表达分析 CSSPOD94、CSSPOD43、CSSPOD46、CSSPOD50、CSSPOD48、CSSPOD51、CSSPOD115、CSSPOD120、CSSPOD121、CSSPOD67、CSSPOD70、CSSPOD-93、CSSPOD97、CSSPOD68、CSSPOD63 共15 个基因在茶树所有组织中表达量较高,表明这些基因对茶生长发育具有重要作用;CSSPOD66、CSSPOD73、CSSPOD116、CSSPOD118、CSSPOD119、CSSPOD61、CSSPOD78、CSSPOD57、CSSPOD59 在所有组织中均呈微弱表达;相对其他组织比较,CSSPOD120、CSSPOD121 在果实中的表达水平总体较高,CSSPO-D43、CSSPOD48、CSSPOD50、CSSPOD51、CSSPOD36、CSSPOD88、CSSPOD90 在花中的表达水平总体较高;CSSPOD116、CSSPOD118、CSSPOD119 的表达量随着叶片成熟度的增加逐渐上调,CSSPOD94、CSSPOD46、CSSPOD50、CSSPOD51、CSSPOD93、CSSPOD97 的表达量随着叶片成熟度的增加逐渐下调,而CSSPOD43、CSSPOD48、CSSPOD155、CSSPOD120、CSSPOD121、CSSPOD67、CSSPOD70 的表达量随着叶片成熟度的增加呈先上升后下降的趋势。上述结果表明,不同茶树POD 基因可能参与茶树的不同生长发育过程。
2. 8 茶树POD 基因家族成员在干旱胁迫、盐胁迫、冷胁迫条件下的表达模式 在干旱胁迫下,与其他基因的表达水平比较,CSSPOD116、CSSPOD120、CSSPOD121、CSSPOD43、CSSPOD48、CSSPOD115、CSSPOD-50、CSSPOD51 的表达量较高;CSSPOD46、CSSPOD67、CSSPOD70、CSSPOD73、CSSPOD93、CSSPOD97、CSSPOD94 的表达量受到抑制,其中CSSPOD46、CSSPOD67、CSSPOD70、CSSPOD73 的表达水平在48 h 时上调;CSSPOD44、CSSPOD78、CSSPOD57、CSSPOD59、CSSPOD69、CSSPOD118、CSSPOD119、CSSPOD36、CSSPOD-52 的表达水平呈上调趋势;CSSPOD10、CSSPOD11、CSSPOD65、CSSPOD88 等基因不受干旱胁迫处理的调控。在盐胁迫处理下,CSSPOD94、CSSPOD115、CSSPOD116、CSSPOD46、CSSPOD67、CSSPOD70、CSSPOD93、CSSPOD97 的表达受到抑制,CSSPOD40、CSSPOD36、CSSPOD44、CSSPOD78、CSSPOD57、CSSPOD59、CSSPOD69、CSSPOD118、CSSPOD119、CSSPOD52 的表达水平呈上升趋势,CSSPOD10、CSSPOD11、CSSPOD28、CSSPOD29 等基因不受盐胁迫的调控。在冷处理下,CSSPOD120、CSSPOD121、CSSPOD50、CSSPOD51、CSSPOD67、CSSPOD60 基因的表达量在CA1 明显上调,CSSPOD43、CSSPOD48、CSSPOD93、CSSPOD97 的表达量在CA3 明显上调,但大部分基因不受冷胁迫的影响。上述结果表明,盐胁迫增加了茶树大多数POD 表达,干旱胁迫则降低了其表达,茶树在对抗非生物胁迫时POD 基因家族起着重要作用。
3 讨 论
已在多个物种中鉴定出POD 基因家族成员,其中包括拟南芥[14]、水稻[15]、葡萄[20]、毛果杨[16]等,目前,尚无对茶树中的POD 基因家族生物信息学分析的相关报道。本实验在全基因组水平一共鉴定出122 个茶树POD 基因,全面分析了茶树POD 基因家族的基本理化性质、染色体定位、系统发育关系、基序组成和基因结构、共线性关系、组织特异性及非生物胁迫响应。检测结果表明,89%(109 / 122)的茶树POD 的相对分子质量在30 000 ~45 000 范围内,该结果与相关的研究结果相符[2,17];pI 介于4. 62 ~9. 74之间,茶树POD 蛋白家族一半富含酸性氨基酸,一半富含碱性氨基酸。茶树中的大多数POD 基因(113 /122)均带有1 个以上的外显子,这与梨PbPRX(90 /94)和玉米ZmPRX(89 / 91)中POD 基因中外显子的比例相似[18-19]。通过比较分析,确定了拟南芥、葡萄和茶树POD 基因的系统发育关系,系统发育树分成5 个簇,簇4 的POD 基因最多,簇1 的POD 基因最少。基因结构和保守基序分析发现,所有茶树POD蛋白均具有典型的过氧化物酶结构域,保守基序8在所有茶树POD 中均有呈现,推测其在植物防御过程中起作用[20],除1 个亚组外,其他各亚组所包含的保守基序基本一致,因此该家族蛋白可能具有相似的生物学功能。另外,茶树POD 基因在不同亚基因组中数量不同,表明POD 基因在茶树进化过程中发生了基因保留和丢失。共线性分析结果表明,拟南芥、葡萄和茶树POD 基因在进化上具有近缘关系。在进化过程中,基因通常会受到各种选择压力,如纯化选择(Ka / Ks <1),阳性选择(Ka / Ks >1)和中性选择(Ka / Ks = 1)[21],茶树POD 基因组中23 个基因对的Ka / Ks 值均<1,表明这些基因经过较强的纯化选择,在进化中较为保守。
植物体内POD 含量增加可抑制过氧化氢的产生和活性氧的形成,通过这种抑制作用增强植物对胁迫的抗性,如拟南芥AtPRX3 基因对植物抗旱和抗盐胁迫具有正向的调节作用[6],萝卜中过氧化物酶基因rspral 在抑制表达条件下具有抗盐、抗氧化和抗高温功能[11],烟草中过表达长春花过氧化物酶基因CrPrx 和CrPrx1 分别增强了耐寒性和发芽率[22]。本研究表达模式分析结果发现,茶树POD 基因具有组织特异性,CSSPOD94、CSSPOD43、CSSPOD46、CSSPOD50、CSSPOD48、CSSPOD51、CSSPOD115、CSSPOD120、CSSPOD121、CSSPOD67、CSSPOD70、CSSPOD93、CSSPOD97、CSSPOD68、CSSPOD63 等15 个基因在茶树所有组织中均有表达,且具有较高的表达量,表明这些基因在功能上具有多样化,在抵抗胁迫方面具有积极作用。
研究表明,POD 涉及广泛的生理过程,如植物防御过程、细胞壁合成、组织愈伤、植物体内活性氧清除等。本研究结果表明,茶树POD 基因家族在胁迫响应与生长发育过程中可能参与重要的调控作用,为进一步分析茶树POD 基因家族在生物或非生物胁迫及其生长发育中的功能和作用奠定了基础。志谢感谢贵州大学茶学院吕立堂老师对本论文的指导及贵州大学茶学院和生命科学学院的授课老师及同学对本文的帮助
——以多重共线性内容为例

