截短型水痘-带状疱疹病毒糖蛋白E 的原核表达及免疫原性评价
李春明,王丽,马成,刘佳羽,许源航,牟忠梅
1. 长春祈健生物制品有限公司,吉林长春 130012;2. 上海倍谙基生物科技有限公司,上海 200120;3. 赤峰学院附属医院,内蒙古赤峰 024005
水痘-带状疱疹病毒(varicella-zoster virus,VZV)是引起水痘和带状疱疹两种疾病的病原体,其基因组大小为125 000 bp,编码67 种蛋白,含12 种糖蛋白,其中糖蛋白E(glycoprotein E,gE)、gB、gH、gI、gC、gL、gK 和gM 研究较为广泛,这些糖蛋白主要分布在病毒囊膜和感染细胞的胞膜上,与病毒的致病性和免疫原性密切相关。
gE 在病毒表面表达较高,含有T、B 细胞表位,是免疫原性和反应原性最强的糖蛋白。有研究采用类病毒颗粒(virus-like particle,VLPs)、昆虫细胞、中国仓鼠卵巢细胞(Chinese hamster ovary,CHO)等不同表达系统制备了不同长度的gE 蛋白,并对其免疫原性进行了分析,结果表明,gE 具有较强的免疫原性,可作为重组疫苗的候选抗原[1-4]。葛兰素史克公司(GSK)采用CHO 细胞表达了gE 胞外区蛋白,并辅以AS01B 佐剂,制备了带状疱疹疫苗shingrix,临床效果明显优于减毒带状疱疹疫苗,表明抗原的选择和佐剂的使用尤为重要[5-8]。但CHO 细胞表达系统对重组蛋白的表达量较低,且培养周期长,导致产业化生产面临较大困难。原核表达系统是指通过基因克隆技术将外源目的基因插入表达载体,并导入表达菌株,使其在特定原核生物或细胞内表达,常用于生物工程领域,该方法具有成本低、易操作、培养周期短,产量高等优点。因此,本实验通过原核表达系统制备VZV gE 蛋白,并评价其免疫原性,为带状疱疹重组亚单位疫苗的研究提供实验依据。
1 材料与方法
1. 1 细胞、病毒、菌株及载体 第32 代二倍体细胞(2BS 株)及第48 代VZV 由长春祈健生物制品有限公司研究室保存;感受态E. coli DH5α 及感受态E. coli BL21(DE3)购自北京博迈德生物技术有限公司;载体pET-21b 由国药中生生物技术研究院第一研究室许洪林博士惠赠。
1. 2 主要试剂及仪器 MiniBEST Bacteria Genomic DNA Extraction Kit Ver. 3. 0 购自日本TaKaRa 公司;prime STAR HS polymerase DNA 多聚酶、内切酶NdeⅠ、XbaⅠ及EcoRⅠ、T4 DNA 连接酶、质粒提取试剂盒均购自宝日医生物技术(北京)有限公司;氨苄西林及弗氏佐剂购自美国Sigma 公司;Tryptone、Yeast Extract 购自英国OXiod 公司;HRP 标记的羊抗鼠IgG 购自美国STB 公司;鼠抗gE 单克隆抗体由长春祈健生物制品有限公司研究室制备;IPTG、DTT、Tris、Easy Geno 快速重组克隆试剂盒购自天根生化科技(北京)有限公司;Ni sepheroseTM6 Fast Flow购自美国GE healthcare 公司。
1. 3 实验动物 SPF 级BALB / c 小鼠,雌性,10 只,6 ~8 周龄,体重18 ~22 g,购自长春亿斯实验动物有限公司,动物合格证号为:201600012151。本次实验是以科研为目的,对实验动物的饲养、照料、免疫及处置等均符合动物健康和福利的相关规定。
1.4 引物设计及合成 根据GenBank 中登录的VZVgE 序列(AY016450. 1),截取第25 ~537 位氨基酸对应的核酸序列,经密码子优化,合成含截短型位gE蛋白核酸序列的合成质粒pUC-VZV-gE25-537-His,由金唯智生物技术有限公司(苏州)合成。根据合成质粒pUC-VZV-gE25-537-His 序列,应用Primer Premier 5.0软件设计引物,上游引物:5'-AACTTTAAGAAGGAGATATACATATGGCACAAGTAATCAACACTAACA-3' ;下游引物:5'-AAGCTTGTCGACGGAGCTCGAATTCTTAATGATGATGATGATGATGCGCTAACAGAGACAGCACGTTCT-3'(下划线部分为组氨酸标签序列),扩增产物大小为1 560 bp。引物由金维智生物技术有限公司(北京)合成。
1. 5 目的基因的扩增 以合成质粒pUC-VZV-gE25-537-His 为模板进行目的片段的PCR 扩增。PCR 扩增体系为:5×PS buffer 10 μL,模板1 μL,dNTP 4 μL,上、下游引物各1 μL,Prime STAR HS DNA poly-merase 0.5 μL,ddH2O 补足至50 μL。PCR 扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35 个循环;72 ℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳分析。
1. 6 重组表达质粒的构建 采用EasyGeno 快速重组克隆试剂盒将PCR 扩增产物克隆至载体pET-21b(经NdeⅠ和EcoRⅠ线性化)中,连接产物转化至感受态E. coli DH5α,加入无抗生素的LB 培养基,于37 ℃振荡培养45 min;转种于含氨苄西林(100 μg / mL)的LB 固体琼脂平板上,于37 ℃培养12 ~16 h;挑选单克隆,加入至3 mL 含氨苄西林(100 μg/mL)的LB 培养基中,37 ℃振荡培养12 ~16 h;采用MiniBEST Bacteria Genomic DNA Extraction Kit Ver. 3. 0 提取质粒,进行XbaⅠ和EcoRⅠ双酶切鉴定。将阳性克隆送金唯智生物技术有限公司(北京)进行测序,将测序正确的重组表达质粒命名为pET-21b-VZV-gE25-537-His。
1. 7 目的蛋白的表达 将重组表达质粒pET-21b-VZV-gE25-537-His 转化至感受态E. coli BL21(DE3),于37 ℃培养16 ~18 h;挑选单克隆,接种于2 mL含氨苄西林(100 μg / mL)的LB 培养基中,37 ℃,220 r / min 培养4 h;取培养物,加入IPTG 至终浓度为0. 5 mmol / L,继续培养4 h;另取培养物,继续培养4 h。取上述样品各200 μL,10 528 × g 离心1 min,弃上清,进行10% SDS-PAGE 分析。
1. 8 目的蛋白纯化 将表达菌接种至100 mL 含氨苄西林(100 μg/mL)的LB 培养基中,于37 ℃,220 r/min培养4 h;加入IPTG 至终浓度为0.5 mmol/L,继续培养4 h;取培养物,6 700 × g 离心30 min;取沉淀,用20 mL 20 mmol / L Tris-HCl(pH 8. 0)重悬,加入DTT至终浓度为1 mmol / L,超声破碎3 min,6 738 × g离心30 min;分别取上清和沉淀,进行10%SDS-PAGE分析。取培养物菌体沉淀,加入20 mL 的8 mol/L Urea,室温溶解2 h;6 738×g 离心30 min,取上清,加入1 mL 镍离子层析柱,室温结合1 h;用20 mmol / L Tris-HCl + 8 mol / L Urea(pH 8. 0)平衡5 个柱体积;依次用含50、100、200、300、500 mmol / L 咪唑的20 mmol/L Tris-HCl +8 mol/L Urea(pH 8.0)洗脱,收获洗脱液,进行10% SDS-PAGE 分析。将收获的目的蛋白依次用含4、2、1、0 mol / L Urea 的20 mmol / L Tris-HCl(pH 8.0)透析。
1. 9 纯化蛋白的Western blot 鉴定 取1 μg 纯化蛋白,经10% SDS-PAGE 分离后,半干法转移至NC膜,用5% 脱脂奶粉于4 ℃封闭过夜;TBST 洗涤3 次,加入鼠抗gE 单克隆抗体(1 ∶1 000 稀释),室温孵育1 h;TBST 洗涤3 次,加入HRP 标记的抗鼠IgG(1 ∶5 000 稀释),室温孵育1 h;TBST 洗涤3 次,加入DAB显色,用水终止反应。
1. 10 动物分组及给药 将纯化蛋白用1 × PBS 稀释至400 μg/mL,按1 ∶1 的比例与弗氏佐剂混合,充分乳化;另将纯化蛋白用1×PBS 稀释至200 μg/mL。分别用两种抗原经背部皮下多点免疫小鼠,100 μL/只,于0、2、4 周免疫1 次,每次免疫后2 周,经尾静脉采血,分离血清。
1. 11 血清抗体效价的检测 用VZV(10 μg / mL)包被96 孔板,4 ℃包被过夜;含0. 5% Tween20 的PBS(PBST)洗涤3 次,封闭液(含5% FBS 的PBS)于37 ℃封闭2 h;PBST 洗涤3 次,加入每次免疫后2 周的小鼠血清(1 ∶100 ~1 ∶204 800 稀释),100 μL/孔,37 ℃孵育2 h;PBST 洗涤3 次,加入HRP 标记的羊抗鼠IgG(1 ∶10 000 稀释),37 ℃孵育1 h;PBST 洗涤3 次,加入底物,100 μL / 孔,室温反应8 min;加入2 mol / L硫酸溶液,50 μL / 孔,终止反应,用酶标仪检测A450。
1. 12 血清中和效价的检测 将二倍体细胞(2BS株)接种于6 孔板,2 × 105个/ 孔,37 ℃培养3 ~4 d,细胞生长为致密单层。将第3 次免疫2 周的小鼠血清于56 ℃灭活30 min;用PBS 进行稀释(1 ∶2 ~1 ∶128),将1 000 PFU / mL 的VZV 按1 ∶1 的体积比加入至灭活血清,37 ℃水浴孵育60 min;加入6 孔板,100 μL / 孔,37 ℃吸附90 min;补加病毒维持液(MEM + 2%胎牛血清+ 1%谷氨酸钠+ 3%碳酸氢钠),3 mL / 孔,37 ℃,5% CO2条件下培养7 ~10 d;弃培养液,考马斯亮蓝染液染色5 min,计数噬斑数量,Karbar 法计算50%中和效价。
2 结 果
2. 1 目的片段扩增产物的鉴定 目的基因gE25-537的PCR 产物经1%琼脂糖凝胶电泳分析,可见约1 500 bp的目的条带,大小与预期相符,见图1。

图1 目的基因的PCR 产物电泳图Fig. 1 Electrophoritic profile of PCR product of gE25-537 gene
2. 2 重组表达质粒的鉴定 重组表达质粒pET-21b-VZV-gE25-537-His 的双酶切(XbaⅠ/ EcoRⅠ)产物经1%琼脂糖凝胶电泳分析,可见1 638 bp 的目的基因片段及5 359 bp 的载体片段,大小与预期一致,见图2;测序结果表明,目的基因序列与合成序列(pUC-VZV-gE25-537-His)一致。

图2 重组表达质粒的双酶切(XbaⅠ/ EcoRⅠ)鉴定Fig. 2 Restriction map of recombinant plasmid (Xba Ⅰ/EcoRⅠ)
2. 3 表达产物的鉴定 表达产物经10% SDS-PAGE分析,可见相对分子质量约62 000 的目的蛋白条带,大小与预期相符,见图3;目的蛋白主要以包涵体形式表达,见图4。

图3 表达产物的SDS-PAGE 分析Fig. 3 SDS-PAGE profile of expressed protein
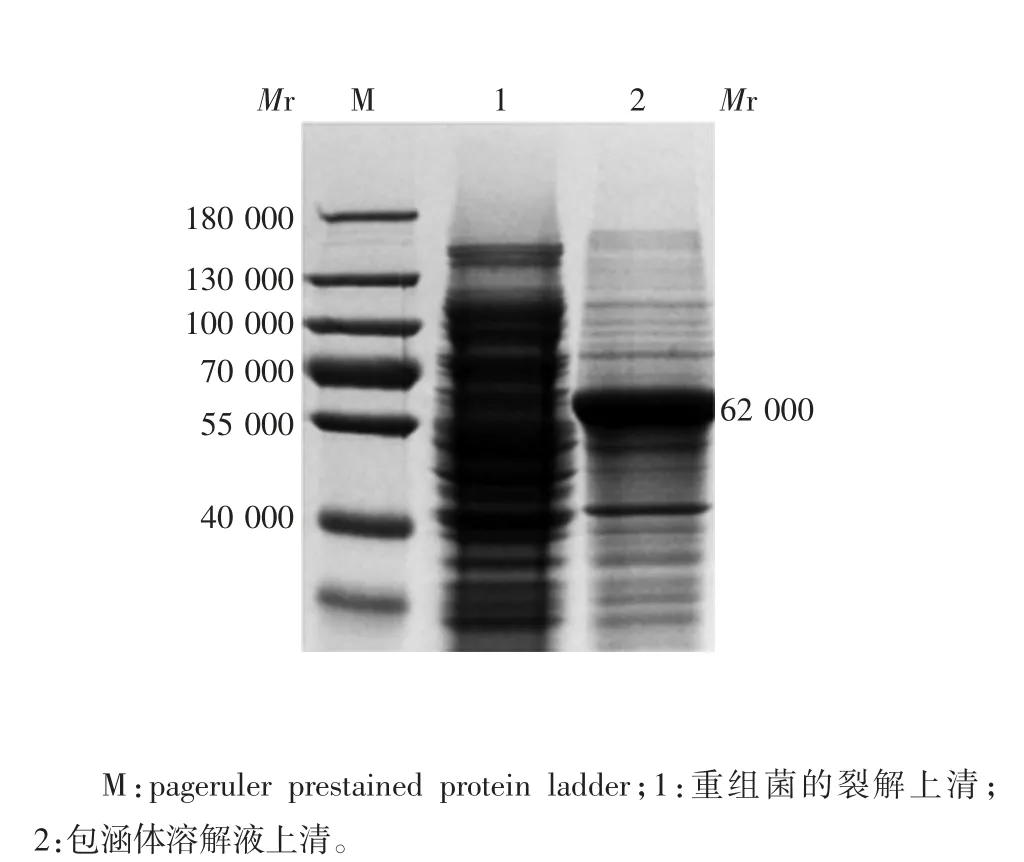
图4 表达产物表达形式的SDS-PAGE 分析Fig. 4 Analysis of form of expressed product by SDS-PAGE
2. 4 纯化产物的鉴定
2. 4. 1 SDS-PAGE 分析 目的蛋白主要在200 ~300 mmol / L 咪唑范围内洗脱下来,洗脱产物经10%SDS-PAGE 分析,可见相对分子质量约62 000 的目的蛋白条带,大小与预期相符,纯度达85%以上,蛋白含量为623 μg / mL。见图5。
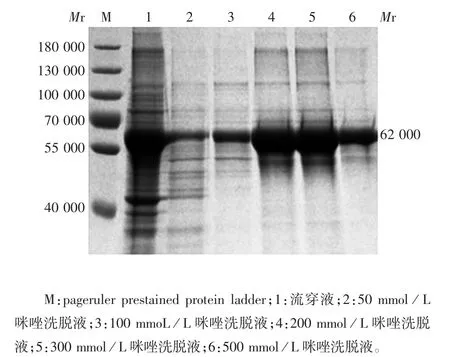
图5 纯化产物的SDS-PAGE 分析Fig. 5 SDS-PAGE profile of purified protein
2. 4. 2 Western blot 分析 纯化目的蛋白可与鼠抗gE 单克隆抗体发生特异性结合,且于相对分子质量约62 000 处可见特异性结合条带,大小与预期一致,见图6。

图6 纯化产物的Western blot 鉴定Fig. 6 Western blotting of purified protein
2. 5 免疫原性分析 两组小鼠随免疫次数的增加,血清抗体水平逐渐增长,3 次免疫后,佐剂组和非佐剂组分别可达1 ∶54 954 和1 ∶25 704,见表1。中和抗体水平分别为1 ∶21. 75 和1 ∶20. 43。
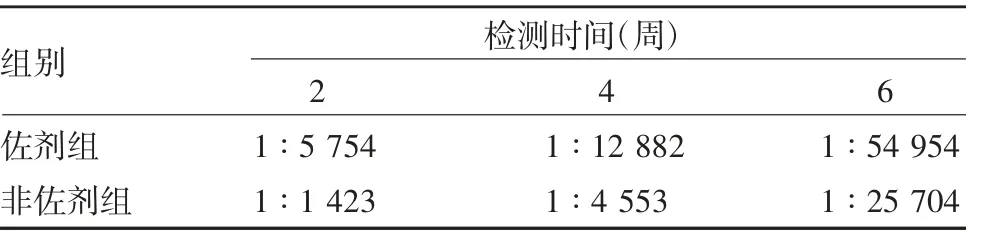
表1 小鼠血清抗体水平Tab. 1 Serum antibody levels of mice
3 讨 论
gE 是VZV 和感染细胞膜表面表达量较高的糖蛋白,具有较强的免疫原性和反应原性,因此对gE 的研究最为广泛,是新一代疫苗的主要候选抗原。葛兰素史克公司研发的带状疱疹疫苗shingrix 的临床效果表明,其免疫效果优于带状疱疹减毒活疫苗,新一代带状疱疹疫苗必将成为研究热点[9-13]。
研究表明,细胞免疫在带状疱疹疾病预防中处于主导地位,抗体水平对该疾病的预防和控制不起主要作用[14-16];另有研究者认为,细胞免疫的产生与肽链更相关,与糖基化水平相关度较小[17]。因此,采用原核表达系统制备gE 蛋白,作为带状疱疹疫苗的候选抗原是可行的。本研究通过基因重组技术构建了重组表达质粒pET-21b-VZV-gE25-537-His,双酶切鉴定获得的目的基因片段略大,这是由于酶切位点选择差异造成的;原核表达后经10% SDS-PAGE分析,确定其以包涵体形式表达,经镍离子层析柱纯化后,纯度可达85%以上,且可与鼠抗gE 单克隆抗体发生特异性结合。将纯化蛋白与弗氏佐剂混合后,经皮下多点免疫小鼠,免疫3 次后,可产生针对VZV 的抗体,抗体水平可达1 ∶50 000。研究表明,针对gE 的血清和单克隆抗体均具有补体依赖性,不加补体时中和活性较低,加入补体后中和活性大幅提高[18],本研究制备的血清未加入补体,中和抗体水平可达1 ∶21. 75,与该文献报道相近。
综上所述,本研究原核表达的VZV gE 具有良好的免疫原性,可作为带状疱疹疫苗的候选抗原。今后将进一步以原核表达蛋白为基础,开展相关佐剂研究,并与真核表达相关抗原进行免疫原性比较,进一步评价加入补体的中和抗体水平。

