枸杞多糖在小鼠脓毒症肝损伤中的保护作用及机制
刘志昌 周海存 余稳稳 兰正苍 吴 彤 张 安 王文安 宁鹏涛 熊诗萌 阎 龙 刘宏斌
脓毒症是因感染导致全身炎性反应失调进而产生免疫抑制的复杂临床综合征,最终产生休克及多器官功能障碍,病死率高。尽管脓毒症住院病死率在逐年降低,但据估计每年全球仍存在3000万起病例和600万人死于脓毒症[1,2]。有研究表明脓毒症可导致严重的肝损害,脓毒症后肝功能障碍是多器官功能障碍和脓毒症死亡的独立危险因素[3,4]。脓毒症患者的肝功能障碍是由组织缺氧、炎性介质、自由基、细菌毒素和药物毒性等因素介导的,减轻肝损伤可降低脓毒症患者的病死率,而细胞凋亡(apoptosis)、炎性损伤和氧化应激是上述多种机制单独或同时作用下的潜在机制[5]。
枸杞作为传统中药之一,在我国已经有2300多年的历史,具有广泛的药理学作用,枸杞多糖(lycium barbarum polysaccharides, LBP)是从中药枸杞果实提取的生物学活性化合物。有研究表明,枸杞多糖在多种疾病中可发挥保护神经、免疫调节、抗氧化、抗肿瘤、抗衰老、抗炎及抗凋亡等功效[6],但在脓毒症甚至肝损伤中的作用尚不明确。
本实验拟采用盲肠穿孔结扎法(CLP)建立小鼠脓毒症肝损伤模型,通过给予枸杞多糖预防干预,检测小鼠血清学指标与组织学变化,观察枸杞多糖对脓毒症肝损伤小鼠的保护作用,并探究了枸杞多糖在脓毒症处理的肝损伤小鼠中可能介导的机制。
材料与方法
1.主要材料:实验动物由中国人民解放军联勤保障部队第九四〇医院实验动物中心提供,枸杞多糖由陕西帕尼尔生物科技有限公司提供,4%多聚甲醛通用型组织固定液由安徽Biosharp科技有限公司提供,AST、ALT检测试剂盒购自南京建成生物研究所,ELISA检测试剂盒购自深圳欣博盛生物公司,BCA蛋白检测试剂盒购自北京索莱宝生物科技有限公司,蛋白质预染标志物购自上海赛默飞世尔有限公司,ECL发光液试剂盒购自安徽Biosharp科技有限公司,SDS-PAGE 试剂盒购自北京索莱宝生物科技有限公司,Bcl-2、Cleaved caspase-3购自英国Abcam公司,TRL-4、p65抗体购自武汉Fine Test生物科技有限公司,β-actin购自北京中衫金桥生物科技有限公司,辣根过氧化物酶HRP标记抗兔IgG购自北京中衫金桥生物科技有限公司,电泳仪、蛋白转膜仪购自美国伯乐生命医学产品有限公司,离心机购自上海赛默飞世尔有限公司。
2.实验动物及药物:健康雄性清洁级BALB/c小鼠(22~25g)分为4组,每组10只,饲养于温度20~24℃、相对湿度40%~75%中国人民解放军联勤保障部队第九四〇医院实验动物中心,自由饮水和饮食。本实验中动物处置方法符合动物伦理学标准,经中国人民解放军联勤保障部队第九四〇医院医学伦理学委员会批准(批准号:2020KYLL157)。
3.模型制备与分组:小鼠适应性喂养1周,随机将小鼠分为Ⅰ组假手术(sham)组、Ⅱ组模型(CLP)组、Ⅲ组枸杞多糖(CLP+LBP)组,Ⅳ组枸杞多糖预处理后假手术(LBP+sham)组,枸杞多糖剂量按照Wu等[7]的报道采用400mg/(kg·d),在造模前2周枸杞多糖组及枸杞多糖预处理后假手术组按0.2ml/kg给予枸杞多糖灌胃处理,Ⅰ、Ⅱ组给予同等剂量的0.9%氯化钠溶液。干预14天后Ⅰ、Ⅳ组小鼠仅施行开腹暴露盲肠并还纳,造模按照Rittirsch等[8]报道的方式采用CLP,实验前12h禁食不禁水,用0.1ml/10g水合氯醛腹腔注射麻醉后,复制严重腹腔感染致脓毒症模型,术后给予动物液体复苏,麻醉苏醒后放回笼中正常喂养。
4.标本采集:造模24h后各组小鼠在无菌条件下麻醉、开腹,采集动物肝脏组织及血清-80℃冰箱保存。另取一份标本保存于4%多聚甲醛通用型组织固定液中。
5.观察指标与方法:(1)肝脏指数的测定:分别于CLP手术后第24h处死小鼠,每只小鼠的肝脏都被取出并称重。切除肝脏上多余的组织和筋膜后,测定肝脏指数。根据以下方法计算肝脏指数:肝脏指数=肝脏质量(mg)/小鼠体质量(g)。(2)检测血清ALT、AST水平:采集血液试管为无热原和内毒素试管,EDTA抗凝,先静置15min,以 3000r/min离心 20min,取血清放置于-80℃冰箱保存。采用比色法检测血清ALT和AST水平,按试剂盒说明书操作。(3)肝组织病理形态观察:24h后处死小鼠,取肝标本于4%多聚甲醛通用型组织固定液固定,常规石蜡包埋,切片,苏木精-伊红(HE)染色后行组织学检查。(4)检测血清 TNF-α、IL-6水平。严格按照ELISA试剂盒说明书检测细胞因子 TNF-α、IL-6。(5)Westem blot法检测:将肝组织匀浆,蛋白提取后使用BCA 蛋白定量试剂盒对蛋白质浓度进行定量,计算蛋白上样量10μg。配制SDS-聚丙烯酰胺凝胶凝胶电泳进行蛋白样品的分离,使用PVDF膜进行转膜,室温条件下5%脱脂奶粉封闭2h,加入Bcl-2、Cleaved caspase-3、TRL-4、p65抗体、β-actin,4℃摇床孵育过夜,使用TBST充分清洗一抗,加入室温下辣根过氧化物酶HRP标记抗兔IgG孵育2h,TBST清洗3遍,显影使用ECL化学试剂盒和凝胶成像系统进行拍照。使用Image J图像分析处理软件对条带进行灰度分析。
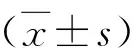
结 果
1.一般情况:Ⅰ、Ⅳ组小鼠麻醉苏醒后神智清楚,精神饱满,活动量较之前略减少。Ⅱ组早期苏醒后呼吸平稳,活动量正常;12h后出现烦躁不安,呼吸急促、浅快;24h后小鼠在之前基础上出现嗜睡、肢体湿冷、寒颤、竖毛、眼角分泌物、活动量减少、呼吸不规则等表现;解剖后发现腹腔内有脓性或血性腥臭分泌物,盲肠肿胀、缺血坏死,与周围组织粘连,肝脏充血水肿,包膜紧张,边缘变钝,颜色暗红。Ⅲ组小鼠24h后出现精神状态萎靡、嗜睡、活动度少、触觉迟钝、竖毛、眼角分泌物等表现较Ⅱ组小鼠明显减少。
2.LBP对肝脏指数的影响:CLP手术处理24h后,Ⅱ组肝脏指数显著高于Ⅰ组(P<0.05)。与Ⅱ组比较,CLP手术前2周经过LBP处理的Ⅲ组的肝脏指数显著降低(P<0.01),Ⅰ、Ⅳ组肝脏指数比较,差异无统计学意义(P>0.05,图1)。

图1 各组肝脏指数
3.LBP对AST和ALT的影响:与Ⅰ组比较,Ⅱ组血清中 ALT 和 AST明显升高;LBP 处理后血清中 ALT和 AST 水平较 Ⅱ 组显著降低(P均<0.05);Ⅰ、Ⅳ组肝酶变化比较,差异无统计学意义(P>0.05,图2)。

图2 枸杞多糖对肝酶的影响A.枸杞多糖对血清中ALT水平的影响;B.枸杞多糖对血清中AST水平的影响。与Ⅰ组比较,*P<0.05,**P<0.01;与Ⅱ组比较,#P<0.05,##P<0.01
4.LBP对肝组织病理改变的影响:各处理组小鼠肝脏的组织病理学表现详见图3,从Ⅰ、Ⅳ组获得的肝脏组织病理学检查显示正常的组织结构和细胞结构。Ⅱ组小鼠的肝组织HE染色显示肝小叶内多灶坏死、肝细胞水肿,少量炎性细胞浸润,表明CLP致肝损伤模型建立成功。与Ⅱ组比较,LBP预处理的小鼠(Ⅲ组)肝细胞肿胀坏死面积明显缩小及炎性反应程度明显减轻。

图3 各组肝组织病理学检测(HE,×200)A.假手术组;B.CLP模型组;C.枸杞多糖组;D.枸杞多糖预处理假手术组
5.LBP对小鼠血清肿瘤坏死因子-α和白细胞介素-6的影响:Ⅰ、Ⅳ组促炎性细胞因子水平无明显变化(P>0.05);与Ⅰ组比较,Ⅱ组血清中促炎性细胞因子(TNF-α、IL-6)水平均显著升高。LBP 处理后血清中促炎性细胞因子 TNF-α、IL-6 水平较CLP 组明显降低(图4)。
6.枸杞多糖对脓毒症诱导肝细胞凋亡的影响:Western blot法检测结果显示,采用CLP 手术造模后的小鼠抗凋亡Bcl-2蛋白水平明显低于对照组(P<0.05),促凋亡 Cleaved caspase-3蛋白水平明显高于对照组(P<0.01),此外,LBP治疗的Ⅲ组小鼠血清抗凋亡蛋白水平明显高于CLP组(P<0.05),促凋亡蛋白 Cleaved caspase-3的表达显著低于CLP组(P<0.01,图5)。
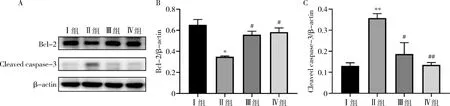
图5 各组凋亡相关蛋白的相对表达量A.Western blot法结果;B.Bcl-2抗凋亡蛋白的相对表达结果;C.Cleaved caspase-3促凋亡蛋白的相对表达结果。与Ⅰ组比较,*P<0.05,**P<0.01;与Ⅱ组比较,#P<0.05,##P<0.01
7.LBP在肝损伤小鼠中肝组织中TLR-4、NF-κB的表达:假手术组与枸杞多糖预处理后假手术组间TLR-4、NF-κB等炎症相关通路的蛋白表达比较,差异无统计学意义(P>0.05);与假手术组比较,CLP 组肝组织中TLR-4、NF-κB 表达水平急剧上升 (P<0.05);LBP干预后TLR-4、NF-κB表达水平较 CLP 组明显降低 (P<0.05,图6)。
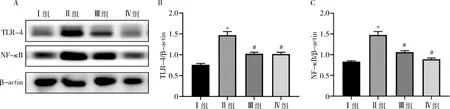
图6 各组TLR-4、NF-κB蛋白的相对表达量A.Western blot法检测结果;B.TLR-4蛋白的相对表达结果;C.NF-κB p65的相对表达结果。与Ⅰ组比较,*P<0.05;与Ⅱ组比较,#P<0.05
讨 论
脓毒症可导致多器官功能障碍,严重威胁到患者生命健康。肝损伤是脓毒症患者常见的并发症之一,已成为世界范围内日益严重的健康和经济负担[9]。虽然目前临床上关于脓毒症及肝损伤的治疗方式多种多样,但均以改善肝功、抑制促炎性细胞因子过度分泌和控制凋亡为特征。此外,已有相当多的研究证明,促炎性细胞因子、凋亡、肝功受损将会加重脓毒症引起的肝损伤[10,11]。因此,以改善肝损伤为靶向可成为治疗脓毒症的一种有潜力的治疗方法。本研究通过枸杞多糖预处理后发现抑制了脓毒症肝损伤小鼠的肝细胞凋亡,对肝损伤具有显著的保护作用,这可能与TLR-4/NF-κB通路有关。
CLP建立的动物模型是目前应用最多的脓毒症模型,因为不但是一个多菌种的脓毒症模型而且与人类脓毒症的发展及特点非常相似,被称作脓毒症动物模型的金标准[12]。当发生脓毒症时,肠黏膜屏障功能受损,大量的内毒素进入血液,当肝细胞受到内毒素的侵害时,会发生肝细胞水肿释放AST、ALT[13]。因此,AST和ALT一直是评估肝损伤的敏感指标[14]。之前Xiao等[15]使用枸杞多糖预处理后证实,在CCL4诱导的肝损伤小鼠中可降低AST、ALT的水平并改善肝细胞损伤。在本研究中给予枸杞多糖预处理的小鼠血清AST及ALT显著降低,组织病理学检查中肝细胞肿胀坏死有明显改善。这与之前的研究一致,表明枸杞多糖对脓毒症诱导的肝损伤中具有一定的保护作用。
另外,脓毒症时大量的内毒素激活枯否细胞释放肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等促炎性细胞因子,进而损伤人体正常的细胞[16]。Xiong等[17]研究发现,促炎性细胞因子在肝损伤中同样发挥重要的作用。在笔者的实验中,枸杞多糖预处理可以有效减少TNF-α、IL-6的产生,从而减轻了小鼠的炎性反应。
最新的研究表明,LBP保护原代海马神经元免受缺血/再灌注损伤的影响,部分是通过抑制细胞凋亡来实现的[18]。LBP还能在非酒精性脂肪性肝炎(NASH)引起的肝损伤和乙醇诱导的酒精肝小鼠中抑制肝细胞的凋亡[19,20]。本研究结果表明,枸杞多糖治疗可以抑制脓毒症时肝细胞的凋亡。细胞凋亡可能是由渗透的中性粒细胞或巨噬细胞衍生的细胞因子,如TNF-α、NO和活性氧引起的。LBP减少这些促炎性细胞因子可能与其抗细胞凋亡作用有关。此外,LBP降低了CLP诱导的肝NF-κB的激活,后者已被证明是细胞凋亡的关键[21]。
研究发现TLR-4通过触发NF-κB依赖的途径来介导炎性反应,而且TLR-4在肝损伤中同样发挥十分重要的作用[22,23]。以往研究表明,NF-κB通过调节炎性细胞因子而加重肝损伤[24]。据报道,枸杞多糖可在LPS诱导的炎性细胞模型中通过抑制TLR-4/NF-κB信号通路减少促炎性细胞因子的产生,控制炎症[25]。然而,枸杞多糖对脓毒症小鼠诱导的肝损伤中关于TLR-4/NF-κB信号通路尚未见报道。本研究发现,与Ⅰ组比较,经过CLP处理的Ⅱ组小鼠肝脏TLR-4、NF-κB蛋白水平升高。枸杞多糖预处理的Ⅲ组与Ⅱ组比较,降低了NF-κB、TLR-4表达。TLR-4/NF-κB信号通路表达的变化趋势与肝损伤和炎性反应的变化趋势一致。因此,笔者推测枸杞多糖对脓毒症诱导肝损伤的缓解作用可能是通过抑制TLR-4/NF-κB信号通路的表达而实现的。然而,枸杞多糖中何种成分或哪些成分在发挥着保护肝脏的治疗作用,仍需在后续研究中进一步探究,并结合细胞实验进一步探讨其具体作用机制。
综上所述,本实验观察到枸杞多糖在脓毒症引起的肝损伤中具有保护作用,并证明枸杞多糖控制脓毒症肝损伤中的炎性反应、凋亡及TRL-4、NF-κB的表达。枸杞多糖可能成为改善脓毒症及肝损伤的一种有潜力的治疗药物。

